抑制P-糖蛋白表达逆转视网膜母细胞瘤多药耐药研究*
西安市第四医院眼科(西安 710004)
白淑玮 张国云
抑制P-糖蛋白表达逆转视网膜母细胞瘤多药耐药研究*
西安市第四医院眼科(西安 710004)
白淑玮 张国云
目的:探讨应用RNA干扰(RNAi)技术逆转视网膜母细胞瘤多药耐药的可行性。方法:将设计合成的针对多药耐药基因MDR1的特异性小分子干扰RNA(siRNA),用脂质体转染具有MDR1基因高表达的视网膜母细胞瘤耐药细胞株SO-Rb50/VCR。用实时定量RT-PCR技术和Westernblot分别测定转染前后细胞MDR1mRNA及P-糖蛋白(P-gp)表达的变化;用CCK-8法和TUNEL法检测转染前细胞株(VCR组),转染后细胞(VCR+siRNA组)对不同浓度长春新碱、依托泊苷和卡铂药物敏感性。结果:VCR+siRNA组较VCR组比较,MDR1基因在mRNA水平和蛋白水平表达显著下降,差异具有统计学意义。随着长春新碱、依托泊苷浓度的升高VCR+siRNA组较VCR组比较,细胞存活率显著降低,差异具有统计学意义。不同浓度的卡铂作用于VCR组、CT组和VCR+siRNA组细胞存活率、细胞凋亡率各组见未见显著性差异。随着长春新碱、依托泊苷浓度的升高,VCR+siRNA组较VCR组比较,细胞凋亡率显著性升高,差异具有统计学意义。结论:在SO-Rb50/VCR细胞中,针对MDR1合成的siRNA能够有效地抑制MDR1mRNA和P-gp的表达,并能恢复肿瘤细胞对长春新碱和依托泊苷的敏感性。应用RNAi技术,能够逆转P-gp引起的视网膜母细胞瘤多药耐药性。
视网膜母细胞瘤(Retinoblastoma,RB)是儿童最常见的原发性眼内恶性肿瘤。Broaddus等调查显示5岁以下儿童RB发病率高达11.8/百万,占同龄儿童恶性肿瘤的6.1%[1]。在我国台湾,RB的5年生存率为81%,其中双眼RB 5年生存率仅64.3%[2]。在我们之前的流行病学研究中发现,我国RB诊断滞后,化学减容治疗疗效不佳,很多患者最终不得不接受眼球摘除术来控制肿瘤的发展[3],这主要是由于部分RB表达多种耐药相关蛋白如P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(Multi-drug related protein,MRP)、肺耐药蛋白(Lung resistance associated protein,LRP)等,因而对化疗不敏感[4],本文通过在视网膜母细胞耐药细胞株中,抑制p-gp的表达来研究肿瘤细胞对长春新碱、卡铂及依托泊苷的敏感性。
材料和方法
1 材 料 具有多药耐药性视网膜母细胞株SO-Rb50/VCR的建立,人视网膜母细胞瘤SO-Rb50为亲本细胞,采用长春新碱浓度梯度法诱导多药耐药细胞SO-Rb50/VCR。采用含10%胎牛血清的RPMI1640 培养液 ,在37 ℃、5%的CO2、饱和湿度下培养,细胞呈悬浮生长,取对数生长期细胞进行实验。
2 方 法
2.1 RNA干扰试验:针对MDR1 基因特异的siRNA 序列设计,由上海吉玛公司完成。序列:(序列: 5 -GGAGGCCAACATACATGCCTT-3(VCR+siRNA组),对照组siRNA(序列5 -UUCUCCGAACGUGUCACGUTT-3(CT组),应用Lipofectamine 2000 Transfection Reagent(美国,Invitrogen ),实验过程按照试剂说明书进行,SO-Rb50/VCR细胞转染后在CO2培养箱中37℃温育48h后进行后续实验。
2.2 Realtime-PCR法检测MDR1:mRNA的转录水平 SO-Rb50/VCR细胞(VCR组) 、VCR+siRNA组和CT组,按照Trizol RNA试剂盒提取细胞总RNA,逆转录反应获得cDNA,然后进行Realtime-PCR,针对MDR1基因的引物序列5-CAGGATAGGTTTGATGGT-3,试剂 Power SYBR Green PCR Master mix (ABI公司),应用 ABI7900HT定量PCR仪,PCR 循环设置:50℃2 min → 95℃10 min → (95℃15 sec → 60℃1 min) × 40个循环→95℃15sec → 60℃15sec→95℃15 sec(生成溶解曲线),利用管家基因18s进行对目的基因的表达进行校正,得到相对定量结果。
2.3 Westernblot法检测P-gp蛋白的表达:VCR组、VCR+siRNA组和CT组,提取细胞总蛋白,应用BCA 蛋白浓度测定试剂盒( 碧云天生物技术研究所)。每组取30μg 蛋白样本,进行SDS-聚丙烯酰胺凝胶电泳分离,电转移蛋白岛硝酸纤维膜,应用封闭液进行封闭后,进行免疫杂交,加入稀释的一抗兔抗人P-gp多克隆抗人(SantaCruz 公司),4℃过夜,TBS液清洗( 碧云天生物技术研究所),然后加入辣根过氧化物酶标记的羊抗兔IgG二抗(cell SantaCruz 公司)1h后,显色,暗室下胶片,曝光,显影定影,扫描输入计算机。β-action为内参。
2.4 CCk-8试验检测细胞存活率:收集VCR组、VCR+siRNA组和CT组细胞,以每孔90μl约5×103个细胞接种于96 孔培养板中,每组3个孔,空白孔只加入100μl培养液,然后在实验孔中分别加入长春新碱浓度梯度0.001μM、0.01μM、0.1μM、1μM,卡铂浓度梯度为1μM、10μM、100μM、500μM,依托泊苷浓度梯度为1μM、50μM、100μM、150μM,培养箱孵育48h后,每孔加入10μl CCK-8 试剂,再孵育3h,然后用酶标仪测定450nm 波长的吸光度值(参比波长为620nm)。按照以下公式计算细胞存活率。细胞存活率(%)= [(As-Ab)/(Ac-Ab)]×100%,其中As:实验孔(VCR组/VCR+siRNA组/CT组+ 药物+CCK-8 ;Ac:对照孔(含有细胞的培养基、CCK-8);Ab:空白孔(培养基、CCK-8)。实验重复3次,取平均值。
2.5 细胞凋亡实验:收集VCR组、VCR+siRNA组和CT组细胞1×108/ml,分别加入长春新碱浓度梯度0.001μM、0.01μM、0.1μM、1μM,卡铂浓度梯度为1μM、10μM、100μM、500μM,依托泊苷浓度梯度为1μM、50μM、100μM、150μM,分别在培养箱孵育48h后,调整细胞浓度至于 1×107/ml,取100μl细胞悬液放入1.5ml离心管中,按照TUNEL检测凋亡试剂盒进行实验(Roche公司)。流式细胞仪进行检测,检测波长488nm检测。
2.6 统计学方法:采用SPSS 17.0统计学软件,统计指标以均数±标准差表示,计数资料采用独立样本t检验;P<0.05 表示差异具有统计学意义。
结 果
1 siRNA作用于SO-Rb50/VCR细胞后MDR1基因表达受到抑制 VCR+siRNA组较VCR组相比,MDR1 mRNA的表达水平显著下降,差异具有统计学意义(图1A)(P<0.05);VCR+siRNA组较VCR组相比,P-gp蛋白表达水平显著下降,差异具有统计学意义(图1B)(P<0.05)。
2 不同浓度的长春新碱、卡铂及依托泊苷分别作用于VCR组、CT组、VCR+siRNA组后细胞生存率的变化 不同浓度的长春新碱0.001μM、0.01μM、0.1μM、1μM,VCR组细胞生存率分别为0.88±0.07、0.80±0.08、0.78±0.05、0.75±0.09,VCR+siRNA组细胞生存率分别为0.78±0.10、0.62±0.07、0.48±0.11、0.22±0.09。CT组与VCR组相比各浓度组细胞存活率未见差异,无统计学意义(P>0.05)。在长春新碱浓度为0.1μM、1μM,VCR+siRNA组较VCR组相比细胞生存率显著下降,具有统计学意义(P<0.05)(图2A)。不同浓度的卡铂,VCR组、CT组和VCR+siRNA组细胞存活率各组间比较,差异无统计学意义(P>0.05)(图2B)。不同浓度的依托泊苷1μM、50μM、100μM、150μM,VCR组细胞存活率分别为0.88±0.06、0.83±0.12、0.75±0.11、0.64±0.10,VCR+siRNA组细胞生存率分别为0.86±0.05、0.81±0.07、0.55±0.09、0.21±0.06。CT组与VCR组相比各浓度组细胞存活率比较,差异无统计学意义(P>0.05)。在依托泊苷浓度为100μM、150μM,VCR+siRNA组较VCR组相比细胞生存率显著下降,具有统计学意义(P<0.05)(图2C)。

图1 A:VCR+siRNA组MDR1基因mRNA表达水平在VCR+siRNA组显著下降;B:VCR+siRNA组P-gp蛋白表达水平在VCR+siRNA组显著下降
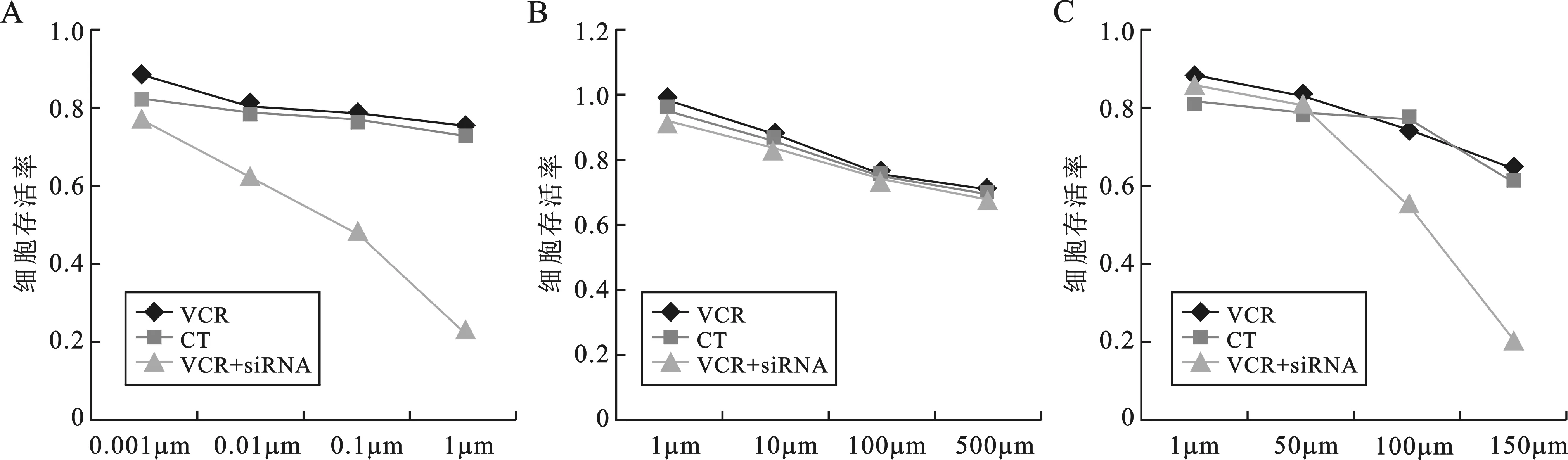
图2 A:长春新碱浓度为0.1μM、1μM,VCR+siRNA组较VCR组相比,细胞生存率显著性下降;B:不同浓度的卡铂,VCR组、CT组和VCR+siRNA组细胞存活率各组见未见统计学差异;C:依托泊苷浓度为100μM、150μM,VCR+siRNA组较VCR组相比细胞生存率显著下降;CT组与VCR组相比药物各浓度组细胞存活率未见统计学差异
3 不同浓度的长春新碱、卡铂及依托泊苷分别作用于VCR组和VCR+siRNA组后细胞凋亡的变化 见表3。

图3 A:长春新碱浓度为0.1μM、1μM,VCR+siRNA组较VCR组相比细胞凋亡率显著升高;B:不同浓度的卡铂,VCR组、CT组和VCR+siRNA组细胞存活率各组见未见统计学差异;C:依托泊苷浓度为100μM、150μM,VCR+siRNA组较VCR组相比细胞凋亡率显著升高;CT组与VCR组相比药物各浓度组细胞存活率未见统计学差异
不同浓度的长春新碱0.001μM、0.01μM、0.1μM、1μM,VCR组细胞凋亡率分别为0.03±0.01、0.05±0.02、0.08±0.02、0.11±0.04,VCR+siRNA组细胞凋亡率分别为0.06±0.01、0.12±0.03、0.23±0.04、0.31±0.04。CT组与VCR组相比各浓度组细胞凋亡率差异无统计学意义(P>0.05)。随着长春新碱浓度的升高,VCR+siRNA组细胞凋亡率都高于VCR组细胞凋亡率,尤其在长春新碱浓度为0.1μM、1μM,VCR+siRNA组较VCR组细胞凋亡率显著升高,具有统计学意义(P<0.05)(图3A)。不同浓度的卡铂,VCR组、CT组和VCR+siRNA组细胞凋亡率各组间比较,差异无统计学意义(P>0.05)(图3B)。不同浓度的依托泊苷1μM、50μM、100μM、150μM,VCR组细胞凋亡率分别为0.03±0.00、0.07±0.02、0.11±0.02、0.17±0.01,VCR+siRNA组细胞凋亡率分别为0.04±0.01、0.08±0.02、0.21±0.02、0.29±0.03,CT组与VCR组相比各浓度组细胞凋亡率差异无统计学意义(P>0.05)。在依托泊苷浓度为100μM、150μM,VCR+siRNA组较VCR组相比细胞凋亡率显著升高,具有统计学意义(P<0.05)(图3C)。
讨 论
早在上世纪80年代就发现化学治疗RB早期疗效明显,但在化疗过程中多数患者会出现耐药而导致治疗失败,化学减容治疗的失败是肿瘤对化疗药物耐药所致。肿瘤多药耐药一直是肿瘤治疗研究的热点问题,大量研究指出通过抑制P-gp蛋白的表达可逆转肿瘤耐药[5-6]。在本研究中,通过RNAi抑制视网膜母细胞瘤耐药株中P-gp蛋白的表达,观察肿瘤细胞对长春新碱、卡铂及依托泊苷的敏感性。
本研究采用的视网膜母细胞瘤长春新碱耐药细胞株(SO-RB50/VCR),其高表达MDR1基因并具有多药耐药性[7]。SO-RB50/VCR细胞在转染针对MDR1基因的siRNA后,MDR1基因mRNA表达水平显著下降,p-gp蛋白表达水平显著下降。而CT组作为阴性对照,无论是基因水平还是蛋白的表达水平均未见抑制作用,这说明siRNA能够成功抑制SO-RB50/VCR细胞中MDR1基因的表达,并且具有一定的特异性。本研究结果还指出,CT组在对化疗药物的敏感性上,与VCR组未见明显差异,这说明对照组siRNA和脂质体对肿瘤细胞的生长并没有影响。而VCR+siRNA组较VCR组,在长春新碱和依托泊苷作用下,细胞生存率显著下降,细胞凋亡显著升高,这说明MDR1基因被成功抑制后,肿瘤细胞对化疗药物由转染前的耐药转变为转染后的敏感。这提示着采用siRNA技术不仅能成功抑制掉MDR1基因的表达,在功能上还可以逆转肿瘤细胞的耐药性,这一研究结果也在很多肿瘤细胞系体外实验中得到证实[5-6]。
长春新碱、卡铂及依托泊苷是目前治疗视网膜母细胞瘤的主要化疗用药。在我们的研究结果指出,在长春新碱浓度为0.1 μM 、1 μM,依托泊苷浓度为100μM、150μM时能明显逆转肿瘤细胞的多药耐药性。这提示着化疗药物有着其特定的作用浓度才能逆转肿瘤耐药,而体外实验的药物浓度应用于体内时还有很多亟需解决的问题,有待我们进一步探索。我们研究还得出,在SO-RB50/VCR细胞中P-gp被抑制后,无法逆转肿瘤细胞对卡铂的耐药性。越来越多的研究也证实铂类药物耐药与P-gp无关,可能存在其他的耐药机制[8]。这也提示着肿瘤细胞的耐药是多因素、多机制共同作用下的结果。
化学减容疗法是RB重要的辅助治疗方法之一,可提高RB的治愈率,改善RB患者的生存质量。肿瘤多药耐药是RB化疗失败的主要原因,因此克服化疗耐药是RB治疗远期疗效的关键。采用RNAi作为一种基因治疗的方法,体外实验已经广泛应用于多种肿瘤细胞。本研究采用siRNA技术抑制SO-RB50/VCR中P-gp蛋白的表达,逆转视网膜母细胞瘤耐药,为RB的治疗提供了新的前景。
[1] Kivela T. The epidemiological challenge of the most frequent eye cancer: Retinoblastoma,an issue of birth and death[J]. Br J Ophthalmol,2009,93(9):1129-1131.
[2] Chang CY,Chiou TJ,Hwang B,etal. Retinoblastoma in Taiwan: survival rate and prognostic factors[J]. Jpn J Ophthalmol,2006,50(3):242-249.
[3] Bai S,Ren R,Li B. Delay in the diagnosis of retinoblastoma in China[J]. Acta Ophthalmol,2011,89(1):e72-74.
[4] Li B,Gao R,Zhang H,etal. Studies on multidrug resistance associated protein in retinoblastoma[J]. Zhonghua Yan Ke Za Zhi,2009,45(4):314-317.
[5] Callaghan R1,Luk F,Bebawy M. Inhibition of the multidrug resistance P-glycoprotein: Time for a change of strategy? [J]. Drug Metab Dispos,2014,42(4):623-31.
[6] Yhee JY,Song S,Lee SJ,etal. Cancer-targeted MDR-1 siRNA delivery using self-cross-linked glycol chitosan nanoparticles to overcome drug resistance[J].J Control Release,2015,28(198):1-9.
[7] Zhang H,Li B,Bai SW,etal. Constitutively active Akt contributes to vincristine resistance in human retinoblastoma cells[J]. Cancer Invest,2010,28(2):156-165.
[8] Yamagishi T,Sahni S. P-glycoprotein mediates drug resistance via a novel mechanism involving lysosomal sequestration[J].J Biol Chem,2013,288(44):31761-71.
(收稿:2015-05-27)
Inhibition of P-glycoprotein expression for reversing multidrug-resistance of retinoblastoma Department of Ophthalmology ,The Fourth Hospital of Xi,an City
( Xi’an 710004)
Bai Shuwei Zhang Guoyun
Objective : To investigate the effects of small interference RNA(siRNA) on the inhibition of MDR1 mRNA and reversal of drug resistance. Methods:The retinoblastoma (RB) multidrug resistant cells (SO-Rb50/VCR) were transfected with human MDR1 specific double-stranded,small interfering siRNA molecules. The expression of MDR1 mRNA was measured by realtime PCR and p-gp expression was detected by westernblot. Cell survival rate of SO-Rb50/VCR before(VCR group) and after transfection(VCR+siRNA group)was determined using a standard colorimetric cell counting kit-8 (CCK-8) to check the drug the sensitivity to three different chemotherapeutic. Rb cells apoptosis was analyzed by TUNEL assay. Result: The protein and mRNA expression level of MDR1 decreased significantly in the VCR+siRNA group compared to that in the VCR group.The percentage of cell survival decreased in VCR+siRNA group compared to that in the VCR group with the high dose of Vincristine or etoposide. The percentage of apoptotic cells to total cells was significantly higher in the siRNA+VCR group than that in the VCR group with the high dose of Vincristine or etoposide. There was no significant difference between groups when RB cells were treated by various dose of carboplatin. Conclusions:Inhibited the express of MDR1mRNA and p-gp by siRNA ,SO-Rb50/VCR cells were sensitive to vincristine and etoposide. RNAi can reverse the drug resistance to chemotherapeutic agents which were transferred by P-gp.
RNA interference Retinoblastoma Multidrug resistance-Associated proteines P-Glycoprotein Drug tolerance
*国家自然科学基金资助项目(81302198)
RNA干扰 视网膜母细胞瘤 多药耐药相关蛋白质类 P-糖蛋白 药物耐受性
R364.7
A
10.3969/j.issn.1000-7377.2015.11.002

