五种红树植物原位根系小分子多酚组成及含量分析*
刘 玉 洪泽珊 彭逸生 徐健荣
(1. 中山大学环境科学与工程学院 广州 510275; 2. 广东省环境污染控制与修复技术重点实验室(中山大学) 广州 510275)
红树植物是一类多酚(polyphenol)又称单宁(tannin)含量较高的植物, 这一特性是红树植物在长期的自然选择过程中与其独特生境协同进化的结果,是红树植物能够长期生存在潮间带高盐度、缺氧及酸性环境下的关键因素, 并成为红树植物在化学成分上的显著特征(Chenet al, 2009; Wanget al, 2014)。
植物多酚分为水解单宁及其相关化合物和缩合单宁及其相关化合物。水解单宁(聚棓酸脂类多酚)包括棓单宁(水解后产生棓酸, 即没食子酸)和鞣花单宁(水解后产生鞣花酸或其它与六羟基联苯二酸有生缘关系的物质)。水解单宁在酸、碱或酶的作用下不稳定, 容易水解。缩合单宁(聚黄烷醇类多酚), 是黄烷醇的聚合物, 主要由黄烷-3-醇(包括表/阿福豆素、表/儿茶素、表/棓儿茶素)缩合而成(石碧等, 2000)。
水解单宁的主要最小单体为没食子酸(gallic acid,简称 GA), 缩合单宁的主要最小单体为儿茶素(catechin, 简称C)、表儿茶素(epicatechin, 简称EC)、棓儿茶素(gallocatechin, 简称 GC)和表棓儿茶素(epigallocatechin, 简称 EGC)。这 5种最小单体是最重要的小分子多酚代表性单体, 具有重要的生态功能, 如植物的化感作用(Liuet al, 2013)。大量研究表明多酚类物质在不同植物群间化感作用中起到重要作用, 包括藻类、真菌、地衣、苔藓、蕨类、裸子植物和被子植物(Inderjit, 1996)。研究美国东部入侵湿地环境最厉害的植物——芦苇(Phragmites communis)对其它植被的化感作用机理, 发现其根泌物中最具化感活性的物质为没食子酸, 其对多种植被系统包括拟南芥(Arabidopsis thaliana)具有化感毒性(Rudrappaet al, 2007)。
红树植物对根际环境中的微型生物群落具有重要的控制作用, 可能与其根系分泌物有关(Kimuraet al, 1989; 李玫等, 2004; 李春强等, 2009)。红树植物根系含有大量的单宁酸, 而单宁酸具有溶藻的性质(Ayoubet al, 1985), 红树植物可能通过根系分泌物对底栖微藻具有抑制作用。
红树植物富含多酚类物质, 红树植物与根际微型生物群落之间存在较好的化感平衡作用。目前仅有少量研究对红树植物根泌物中的总酚和小分子酚酸进行测定, 但对红树植物根系中具体含有多酚类物质的种类尚缺少科学的证据。因此, 本研究选择湛江高桥国家级红树林自然保护区进行原位采样, 对5种红树植物根系进行 5种小分子多酚单体(micro molecule polyphenol monomers)(后简称为多酚单体)的定性及定量测定, 科学回答自然环境下红树植物根系多酚类物质的组成和含量特点, 对全面理解红树植物的生态作用具有重要的理论研究意义, 同时也可为红树林生态系统的科学管理提供理论依据。
1 材料与方法
1.1 研究区域及采样定位
采样在湛江红树林国家级自然保护区研究基地进行, 该保护区是我国现存红树林连片面积最大的一个自然保护区, 高桥红树林保护区是其主要核心区域之一。对5种重要的建群红树植物群落在退潮时进行采样, 为木榄(Bruguiera gymnorrhiza,Bg)、秋茄(Kandelia candel,Kc)、桐花树(Aegiceras corniculatum,Ac)、无瓣海桑(Sonneratia apetala,Sa)群落及红海榄(Rhizophora stylosa,Rs)群落, 并对低潮带桐花树(简称Ac-L)也进行采样。每种红树植物群落内设置3个采样点, 即选择树高相近之3株植物, 每株红树植物均用经纬度仪准确定位, 由于采样面积较大, 范围大致在 21°32′35.06″N, 109°46′09.01″E 间。
1.2 采样时间与方法
采样于2013年9月上旬进行。根系样品采集: 根据不同红树植物根系特征采集红树植物支柱根顶部,将红树植物支柱根周围的土刨开, 然后小心地将根系挖出, 抖落或轻轻刮下根系表面土, 混合根系样品并装入密封袋内冷冻保存。实验室内洗净后选取红树植物根尖10 cm以内的根段。真空冷冻干燥。
1.3 多酚类物质小分子单体测定方法
由于目前尚未发现有同时测定这 5种小分子多酚的文献报道, 本研究对多篇文献中的方法进行整合并改良(Bieriet al, 1979; Wanget al, 2003; Soonget al, 2006; Matilainenet al, 2011), 采用提取-纯化-高效液相色谱(HPLC)测定步骤, 同时测定根系中其含量,预实验结果显示 5种小分子多酚色谱峰分离效果较好, 加标回收率均在60%以上。
(1) 提取和纯化: 称取0.2 g 100目根系冻干样品于10 mL聚四氟乙烯离心管内, 加入3 mL 80%甲醇,45°C下水浴超声30 min(超声频率为100 Hz), 8000 r/min转速下离心10 min, 转移上清液于试管中, 重复提取3次, 合并提取液后过滤至鸡心瓶内, 取3 mL 80%甲醇溶液润洗试管并过滤至鸡心瓶。加10 mL高纯水于鸡心瓶中, 和提取液摇匀后旋蒸去除提取液中的甲醇, 将剩下的水提取液加等量乙酸乙酯进行萃取, 重复3次, 合并3次萃取获得的乙酸乙酯相, 旋蒸至干,密封冷藏保存。上机前加入1 mL 20%甲醇溶液溶解,过0.45 μm滤膜。
(2) HPLC仪测定: 色谱条件: C18柱; 流动相A:0.1%(V/V)磷酸-水溶液; 流动相 B: 甲醇-0.1%(V/V)磷酸溶液。梯度洗脱: 0—15 min, 21% 流动相B; 15—20 min, 21%至50% 流动相B; 检测波长210 nm; 进样量: 10 μL; 流速: 1.0 mL/min; 柱温: 30°C。所用试剂均为高效液相色谱纯级别。
1.4 数据统计与处理方法
综合使用 Excel(2003和 2007)、SPSS(17.0)、OriginPro(8)对数据进行平均值等的分析及图表绘制。
2 结果与讨论
2.1 五种红树植物根系 5种小分子多酚定性和定量分析
按照前述提取方法和色谱条件, 对5种红树植物根系17个根样冻干样品中的5种小分子多酚单体进行了定性定量分析。5种小分子多酚能够较好地分离以及定性定量, 表1和图1分别为5种小分子多酚的保留时间及标样的高效液相色谱图。
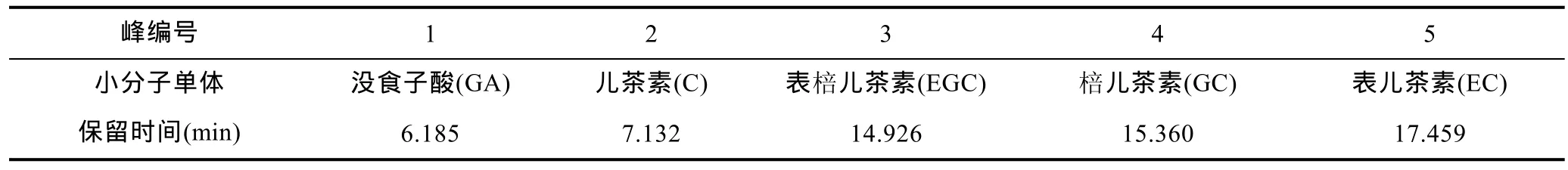
表1 标样中5种多酚单体的保留时间(min)Tab.1 Retention time (min) of 5 polyphenol monomers in standard sample
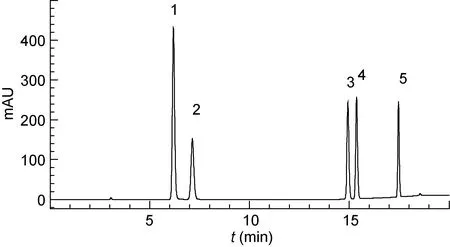
图1 五种多酚单体标样的色谱图Fig.1 Chromatograms of 5 polyphenol monomers in standard sample
红树植物根系中 5种小分子多酚单体的高效液相色谱图(17张谱图中仅挑选桐花树-L1一张展示)见图2, 根据色谱图中各色谱峰出峰时间对5种小分子多酚进行定性分析, 5种红树植物根系基本上全部含有这5种小分子多酚单体(17个样品中应有85个峰,实际出现77个峰, 8个峰为0值)。
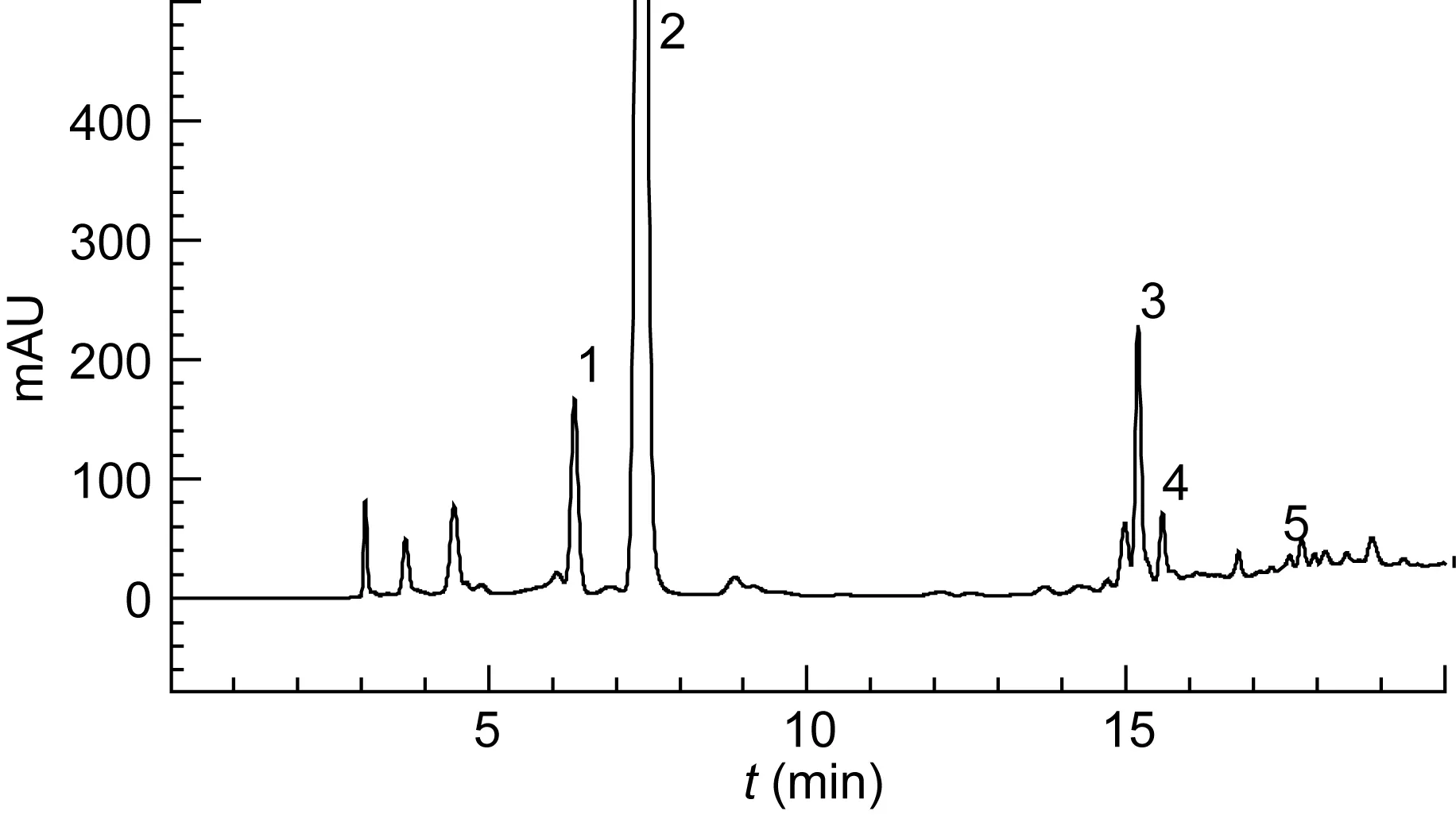
图2 五种红树植物根系提取液中五种多酚单体的液相色谱图(以桐花树-L1为例)Fig.2 Chromatograms of 5 polyphenol monomers in root extracts of five mangrove plants (taking Aegiceras corniculatum-L1 as example)
再根据峰面积计算其含量, 进行分析, 如图 3—图7。

图3 五种多酚单体在五种红树植物根系提取液中单株中最大值比较Fig. 3 Highest contents of 5 polyphenol monomers in root extracts in a single mangrove plant
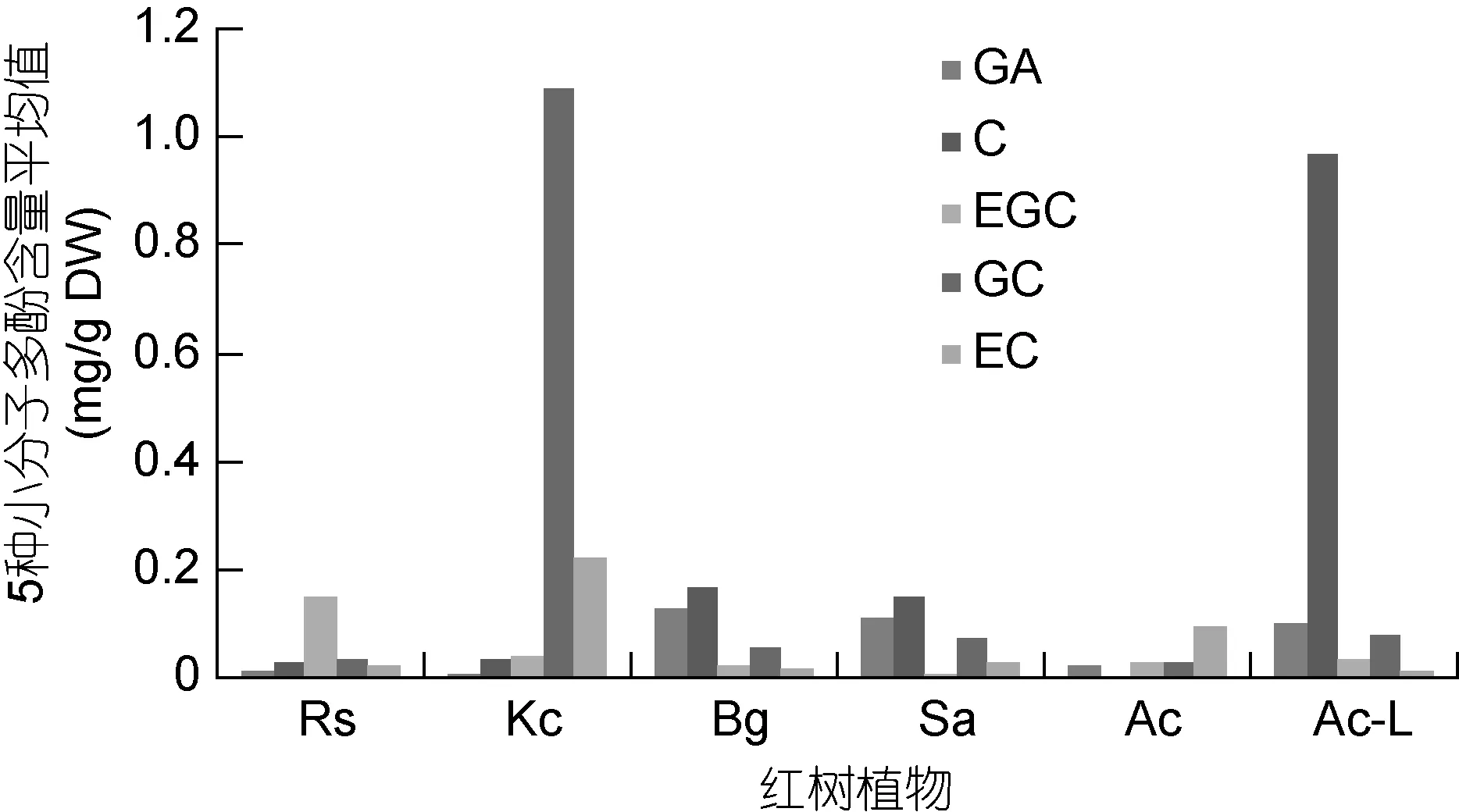
图4 每种多酚单体含量平均值在五种红树植物根系提取液中的比较Fig.4 Average content of each polyphenol monomer in root extracts of five mangrove plants
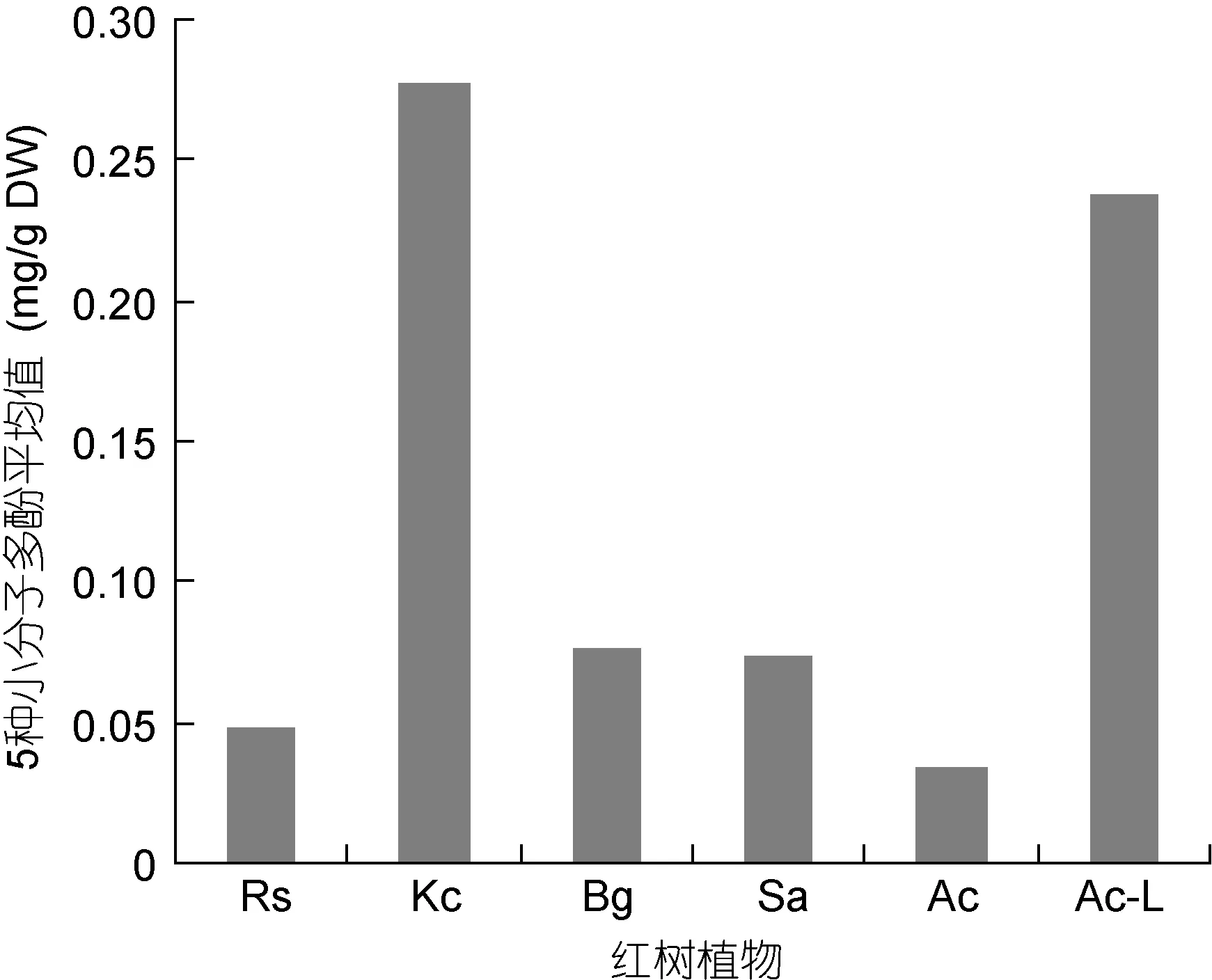
图5 五种多酚单体平均值在五种红树植物根系提取液中的比较Fig.5 The average contents of 5 polyphenol monomers in root extracts of five mangrove plants
对5种红树植物单株根系提取液中5种小分子多酚最高值进行比较, 从图3可以看出, 17个样品中儿茶素(C)单株含量最高值出现在低潮带桐花树样品(Ac-L3)中, 为1.7424 mg/gDW。棓儿茶素(GC)单株含量次高出现在秋茄样品(Kc3)中, 为1.1470 mg/gDW。表 棓儿茶素(EGC)单株含量第 3出现在红海榄样品(Rs3)中, 为0.4457 mg/gDW。没食子酸(GA)单株含量第4出现在木榄样品(Bg2)中, 为0.2374 mg/gDW。表儿茶素(EC)单株含量排最后, 出现在秋茄(Kc3)样品中, 为0.3331 mg/gDW。
对5种红树植物根系提取液中5种小分子多酚含量的3株样品平均值进行比较, 见图4。从图4可以看出, 以秋茄样品 棓儿茶素(GC)的平均含量最高, 3个样品的平均值最高达1.0914 mg/gDW。低潮带桐花树样品中, 以儿茶素(C)含量最高, 平均值最高达0.9650 mg/gDW。秋茄也含有最高的表儿茶素(EC)含量, 平均值最高值为0.2196 mg/gDW。红海榄含有最 高的表 棓儿茶素(EGC)含量, 平均值最高值为0.1500 mg/gDW。木榄含有最高的没食子酸(GA)含量,平均值最高值为0.1289 mg/gDW。
对5种红树植物根系提取液中5种小分子多酚含量的平均值进行比较, 见图5。从图5可以看出, 以秋茄(Kc)和低潮带桐花树(Ac-L)样品5种小分子多酚含量平均值最高, 分别为0.2778 mg/gDW、0.2379 mg/gDW。木榄(Bg)、无瓣海桑(Sa)相差不大, 依次为 0.0766 mg/gDW、0.0734 mg/gDW。红海榄(Rs)、桐花树(Ac)最低, 平均值分别为0.0488 mg/gDW、0.0341 mg/gDW。
对5种红树植物根系提取液中5种小分子多酚含量的总平均值进行比较, 见图6。从图6可以看出, 以棓儿茶素(GC)的含量最高, 平均值最高达 0.2259 mg/gDW,儿茶素(C)含量次高, 平均值最高为0.2234 mg/gDW。表儿茶素(EC)含量第3, 平均值为0.0651 mg/gDW。没食子酸(GA)含量第4, 平均值为0.0638 mg/gDW。表棓 儿茶素(EGC)含量最低, 平均值为0.0457 mg/gDW。

图6 五种多酚单体总平均值含量比较Fig.6 Comparison of the total average contents of 5 polyphenol monomers
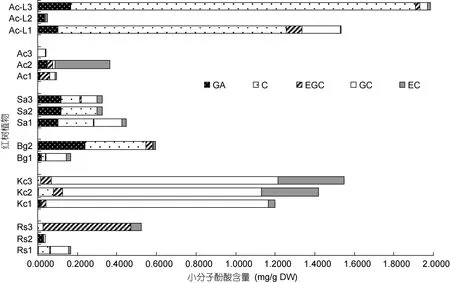
图7 五种红树植物根系中五种多酚单体含量总图Fig.7 Contents of 5 polyphenol monomers in root extracts of five mangrove roots
对5种红树植物根系提取液中5种小分子多酚含量的总体状况进行比较, 见图7。从图7可以看出, 以秋茄(Kc)三株植物的5种小分子多酚含量最高, 其中以 棓儿茶素(GC)为主。低潮带桐花树(Ac-L)样品有 2株分子多酚含量最高, 其中以没食子酸(GA)为主。无瓣海桑(Sa)三株含量相差不大, 以没食子酸(GA)和儿茶素(C)相对含量较高。桐花树(Ac)、红海榄(Rs)、木榄(Bg)单株含量相差较大, 其中有1株相对含量较高。
2.2 红树植物根系小分子多酚组成特点及生态功能
许多研究显示植物分泌的次生代谢物质对水体中的微藻能产生化感抑制作用(Muratovaet al, 2009;Zhuet al, 2010), 且分析检测结果多发现, 有效抑藻成分大多属于多酚类物质。穗花狐尾草(Myriophyllum spicatum)提取物对铜绿微囊藻(Microcystis aeruginosa)存在抑制作用, 在其提取物中检测出多种多酚类物质,包括没食子酸、连苯三酚、儿茶素、鞣花酸、阿魏酸等(Planas, 1981; Nakaiet al, 2000)。14种多酚中有10种具有抑藻作用, 且儿茶素和对苯三酚的抑藻效应最强(Nakaiet al, 2001)。芦苇的腐烂提取液中含有8种多酚类物质, 其中芥子酸、丁香酸、咖啡酸和没食子酸等4种多酚具有很强的抑藻性(Nakaiet al, 2006)。近年研究结果显示, 焦棓酚(pyrogallol)或焦棓酸(pyrogallic acid)对M. aeruginosa和Cylindrospermopsis raciborskii的生长、氧化压力及基因表达都起到作用(Shaoet al,2009; Wuet al, 2013)。
对 14种植物多酚的抑藻效果进行分析, 发现其抑藻效能与其酚羟基的数量及酚羟基的取代位置相关, 拥有 2—3个酚羟基的植物多酚抑藻效果最显著(Nakaiet al, 2001; Sunet al, 2010)。没食子酸和(+)-儿茶素对赤潮藻塔玛亚历山大藻(Alexandrium tamarense)的化感作用比香草醛强, 可能是因为没食子酸和(+)-儿茶素的苯环上都存在3―5个羟基, 而香草醛仅存在1个羟基(杨维东等, 2005)。
有研究显示某些低分子量的多酚对某些微生物具有较强的抑制能力, 包括没食子酸和儿茶素,甚至比单宁酸和茶单宁的抑制能力还强, 原因可能是某些具有毒性的低分子多酚易于透过微生物膜直接对其细胞的代谢作用产生影响, 使得低分子量的多酚毒性可能比单宁还强(石碧等, 2000; Xieet al, 2013)。
本研究证实红树植物根系中普遍含有 5种重要的小分子多酚单体, 有些还具有相当高的单株含量,如儿茶素(C)最高可达1.7424 mg/gDW, 棓儿茶素(GC)最高为 1.1470 mg/gDW, 表棓儿茶素(EGC)0.4457 mg/gDW, 没食子酸(GA)0.2374 mg/gDW, 表儿茶素(EC)0.3331 mg/gDW。这些低分子量的具有多个羟基的小分子多酚是否会以根系分泌物的形式进入到根际环境从而对红树植物根系微型生物群落起到重要调控作用, 以及其调控机理和相关效应大小, 有待进一步深入分析。
3 结论
湛江红树林国家级自然保护区 5种重要的建群红树植物根系基本上全部含有5种小分子多酚单体, 浓度含量范围在0.0007—1.7424 mg/gDW。单株含量最高值分别为, 低潮带桐花树儿茶素为1.7424 mg/gDW, 秋茄棓儿茶素为 1.1470 mg/gDW, 红海榄表 棓儿茶素0.4457 mg/gDW, 木榄没食子酸 0.2374 mg/gDW, 秋茄表儿茶素0.3331 mg/gDW。5种小分子多酚含量的总平均值以秋茄和低潮带桐花树最高, 分别为0.2778 mg/gDW、0.2379 mg/gDW。木榄和无瓣海桑次之, 依次为0.0766 mg/gDW、0.0734 mg/gDW。红海榄和桐花树相对最低, 分别为 0.0488 mg/gDW、0.0341 mg/gDW。五种红树根系内均检测出5种小分子多酚单体, 对全面理解和阐述红树植物的化感作用和生态功能具有重要意义。
石 碧, 狄 莹, 2000. 植物多酚. 北京: 科学出版社
李 玫, 廖宝文, 郑松发等, 2004. 无瓣海桑对乡土红树植物的化感作用. 林业科学研究, 17(5): 641—645
李春强, 刘志昕, 黎娟华等, 2009. 红树植物化感作用对中肋骨条藻生长的影响. 热带作物学报, 30(6): 862—867
杨维东, 张信连, 刘洁生, 2005. 酚酸类化感物质对塔玛亚历山大藻生长的影响. 中国环境科学, 25(4): 417—419
Anu M, Gjessing E T, Lahtinen Tet al, 2011. An overview of the methods used in the characterisation of natural organic matter (NOM) in relation to drinking water treatment.Chemosphere, 83(11): 1431—1442
Ayoub S M H, Yankov L K, 1985. Algicidal properties of tannins.Fitoterapia, 56(4): 227—229
Bieri J G, Tolliver J T, Catignani G L, 1979. Simultaneous determination of alpha-tocopherol and retinol in plasma or red cells by high pressure liquid chromatography. The American Journal of Clinical Nutrition, 32(10): 2143—2149
Chen L Y, Peng S L, Chen B Met al, 2009. Effects of Aqueous extracts of 5 mangrove spp. on cabbage germination and hypocotyl growth ofKandelia candel. Allelopathy Jouranl,23(2): 469—476
Inderjit, 1996. Plant phenolics in allelopathy. The Botanical Review, 62(2): 186—202
Kimura M, Wada H, 1989. Tannins in mangrove tree roots and their role in the root environment. Soil Science and Plant Nutrition, 35(1): 101—108
Liu Y, Li F, Huang Q X, 2013. Allelopathic effects of gallic acid fromAegiceras corniculatumonCyclotella caspia. Journal of Environmental Sciences, 25(4): 776—784
Muratova A, Pozdnyakova N, Golubev Set al, 2009.Oxidoreductase activity of sorghum root exudates in a phenanthrene-contaminated environment. Chemosphere,74(8): 1031—1036
Nakai S, Zhou S, Hosomi Met al, 2006. Allelopathic growth inhibition of cyanobacteria by reed. Allelopathy Journal,18(2): 277—285
Nakai S, Inoue Y, Hosomi M, 2001. Algal growth inhibition effects and inducement modes by plant-producing phenols.Water Research, 35(7): 1855—1859
Nakai S, Inoue Y, Hosomi Met al, 2000.Myriophyllum spicatum-released allelopathic polyphenols inhibiting growth of blue-green algaeMicrocystis aeruginosa. Water Research, 34(11): 3026—3032
Planas D, Sarhan F, Godmaire Het al, 1981. Ecological significance of phenolic compounds ofMyriophyllum spicatum. Verhandlungen Internationale Vereinigung Limnologie, 21: 1492—1496
Rudrappa T, Bonsall J, Gallagher J Let al, 2007. Root-secreted allelochemical in the noxious weedPhragmites australisdeploys a reactive oxygen species response and microtubule assembly disruption to execute rhizotoxicity. Journal of Chemical Ecology, 33(10): 1898—1918
Shao J H, Wu Z X, Yu G Let al, 2009. Allelopathic mechanism of pyrogallol toMicrocystis aeruginosaPCC7806(Cyanobacteria): From view of gene expression and antioxidant system. Chemosphere, 75(7): 924—928
Soong Y Y, Barlow P J, 2006. Quantification of gallic acid and ellagic acid from longan (Dimocarpus longanLour.) seed and mango (Mangifera indicaL.) kernel and their effects on antioxidant activity. Food Chemistry, 97(3): 524—530
Sun Y Y, Liu X X, Yan B Let al, 2010. Effects of p-hydroxybenzoic acid on the growth of two species of red tide microalgae. Environmental Science and Technology,33(7): 36—39, 124
Wang H F, Provan G J, Helliwell K, 2003. Determination of hamamelitannin, catechins and gallic acid in witch hazel bark, twig and leaf by HPLC. Journal of Pharmaceutical and Biomedical Analysis, 33(4): 539—544
Wang Y, Zhu H W, Tam N F Y, 2014. Polyphenols, tannins and antioxidant activities of eight true mangrove plant species in South China. Plant and Soil, 374(1—2): 549—563
Wu Z X, Shi J Q, Yang S Q, 2013. The effect of pyrogallic acid on growth, oxidative stress, and gene expression inCylindrospermopsis raciborskii(Cyanobacteria). Ecotoxicology,22(2): 271—278
Xie X Y, Weiss D J, Weng B Set al, 2013. The short-term effect of cadmium on low molecular weight organic acid and amino acid exudation from mangrove (Kandelia obovata(S.,L.) Yong) roots. Environmental Science and Pollution Research, 20(2): 997—1008
Zhu J Y, Liu B Y, Wang Jet al, 2010. Study on the mechanism of allelopathic in fl uence on cyanobacteria and chlorophytes by submerged macrophyte (Myriophyllum spicatum) and its secretion. Aquatic Toxicology, 98(2): 196—203

