两步碳包覆工艺制备锂离子电池正极复合材料LiFePO4/C
佟 健,石迪辉,曹雁冰,胡国荣
(1.惠州TCL金能电池有限公司,广东惠州 516005;2.四川浩普瑞新能源材料有限公司,四川阿坝 623001;3.中南大学冶金与环境学院,湖南长沙 410083)
锂离子电池作为一种高效的能源储存器件,目前已应用到新能源电动汽车、智能电网及清洁能源(风能和太阳能)储能电站。随着新能源汽车、智能电网、新能源发电等相关产业的快速发展,动力电池的市场需求高速增长,对磷酸铁锂正极材料的需求也随之快速增长。因此,具有低原料成本、资源丰富、环境友好、良好的高温性能、高热稳定性和平稳充放电平台的LiFePO4锂离子电池成为了发展重点[1]。LiFePO4由于其晶体结构使其锂离子扩散慢和电子电导率低,从而导致了材料的可逆性差,倍率循环性能不好[2~4]。改善磷酸铁锂材料的倍率充放电性能必须同时提高其电子电导和离子电导。目前主要通过形貌控制和降低颗粒尺寸[5,6]、表面包覆导电相[7,8]和离子掺杂[9,10]等途径来改善其导电性和电化学性能。
目前碳包覆技术是改善LiFePO4电化学性能最实用和最有效的手段,碳包覆改性对于提高磷酸铁锂材料的倍率性能起到很大的作用[11,12]。但是包覆的碳是非活性物质,碳加入量过多则会影响材料的振实密度和加工性能,从而影响材料的体积能量密度。因此改善碳包覆工艺对于制备磷酸铁锂材料具有重要的实际意义。通过对碳包覆工艺优化来平衡体积比能量与质量比能量,关键是包覆的碳在材料中形成分布均匀的导电网络[13],使导电碳均匀分散在磷酸铁锂表面和颗粒间,降低电荷迁移阻力。
本文以碳氢化合物作为还原剂和碳源,采用分步表面碳包覆的技术途径,进行LiFePO4正极材料的改性研究,以保证制备的LiFePO4/C材料中具有均匀的碳包覆,抑制颗粒尺寸的长大,以期望得到倍率性能和循环性能良好的材料。
1 实验
1.1 样品的制备
将FePO4·2H2O(化学纯,广西比莫比科技开发有限公司制)和葡萄糖(食品级,天津市大茂化学试剂厂制)按比例混合均匀,以水作为分散剂,在搅拌下蒸发至浆糊状,将浆料在80℃下烘干后于氩气气氛炉中以3℃/min的速度升温到550℃,保温2 h后随炉冷却到室温,制取前驱体Fe2P2O7/C。再将Fe2P2O7/C和Li2CO3(99.5%,电池级,四川天齐锂业有限公司制)按比例混合,加入一定量的葡萄糖,以无水乙醇作为分散剂,在行星球磨机上球磨混合4 h,将所得到的浆料在80℃下烘干后于氩气气氛炉中升温到一定温度下保温,随炉冷却到室温,最后制得LiFePO4/C复合材料。
1.2 表征测试
使用的X射线粉末衍射(XRD)仪为日本理学Rigaku D/max 2550VB+18 kW转靶X射线衍射仪:Cu Kα 辐射,40 kV,100 mA,扫描速率 0.5(°)/min,扫描角度2θ为10°~90°,步长为0.02°。采用日本JEOL公司JSM-6360LV型扫描电子显微镜(SEM)在20 kV下分别以不同的放大倍数对样品的形貌进行观察。采用的高分辨率TecnaiG220型透射电子显微镜观察包覆碳的 LiFePO4状态。采用HW2000型红外碳硫分析仪器进行碳含量分析。采用BT-300振实密度测试仪进行材料的振实密度的测定。
1.3 电极制备及半电池组装
将材料制作成CR2025型扣式电池进行充放电循环测试。采用涂膜法制备电极,以N-甲基-2-吡咯烷酮(NMP)为溶剂,按质量比80∶10∶10分别称取活性物质、乙炔黑和聚偏二氟乙烯(PVDF),混合均匀后涂在预处理过的铝箔上,放入真空干燥箱中在120℃干燥得到正极片。在充满氩气的手套箱中,以金属锂片为负极,1 mol/L LiPF6溶解于碳酸乙烯酯(EC)+二甲基碳酸酯(DMC)+乙基甲基碳酸酯(EMC)(体积比为 1∶1∶1)为电解液,Celgard2400多孔聚丙烯膜为隔膜,组装成扣式电池。
在Land电化学仪上进行电化学测试,充电终止电压为4.1 V,放电终止电压为2.5 V。其中,碳包覆的LiFePO4中碳被看作活性物质,电流密度1C=170 mA/g,测试环境为25℃。
2 结果与讨论
首先对原料FePO4·2H2O在550℃下进行预处理2 h,消除结晶水的影响以降低炉内气氛的复杂性,利于实现碳包覆的均匀控制。在预处理的过程中加入葡萄糖完成初次碳包覆过程,然后在后续嵌锂过程中实现第二次碳包覆,优化磷酸铁锂表面原位纳米碳网络的分布状态,改善材料的电化学性能;同时两步碳包覆可以改善材料加工性能,提高振实密度。
图1为550℃预处理温度所得前驱体Fe2P2O7/C的XRD图,从图1中可以看出,有Fe2P2O7尖锐的衍射峰,产物结晶良好,同时没有发现碳的特征峰,说明碳以无定形状态存在。

图1 预处理所得前驱体Fe2P2O7/C的XRD图
第二步选择550~800℃下煅烧4h制备LiFe-PO4/C材料,图2为不同温度煅烧前躯体获得的LiFePO4/C材料的XRD图。从图2中可以看出各个衍射峰都符合橄榄石结构的LiFePO4,无其它杂相,在550℃时就可以得到橄榄石型磷酸铁锂,结晶度相对较差。随着煅烧温度的升高,衍射峰强度增强,峰形更尖锐,样品生长更加完整。当温度升到650℃时,晶体的发育、生长更加良好,晶粒完整均匀,正极材料致密度高,LiFePO4/C材料的物理性能良好。但是当温度到达800℃时,晶粒过大,这将不利于活性材料的锂离子的嵌入/脱出反应,材料的充放电性能受到影响。
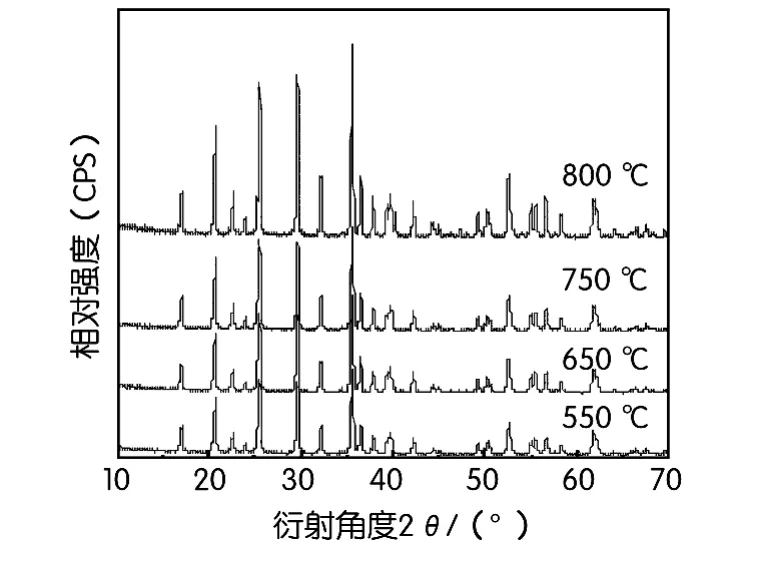
图2 不同合成温度制备的LiFePO4/C材料XRD图
图3为不同煅烧温度下制备的LiFePO4/C材料的SEM图。从图3中可以看出,处理550℃的产物颗粒非常细小,颗粒的表面能较高,一些细小颗粒聚集一起;煅烧650℃的产物颗粒具有规整的微观形貌,颗粒之间的界限比较表明显,颗粒大小分布更均匀。随着煅烧温度的升高,产物的粒径不断增大,颗粒间团聚的趋势变大,温度升高到到800℃时合成的样品颗粒发生了不规则生长,LiFePO4微粒的表面变得光滑,部分形成了大颗粒,团聚现象严重。样品颗粒粒径的异常长大,这对扩散过程控制且受相变影响的LiFePO4材料的电化学性能有不利的影响。因此,通过控制煅烧温度可制备出颗粒粒径均匀细小的正极材料,缩短锂离子扩散的路径,以改善锂离子嵌入-脱出的电化学性能。

图3 不同煅烧温度下制备的LiFePO4/C材料的SEM图
图4为不同煅烧温度制备的LiFePO4/C材料在0.1C倍率充放电时,其首次充放电曲线图。从图4中可以看出,以650℃煅烧的前躯体制备得的LiFe-PO4/C材料在0.1C倍率充放电时,其首次放电比容量达到了149.4 mAh/g,而在550℃、750℃、800℃下煅烧得到的LiFePO4/C材料在0.1C倍率充放电时其首次放电比容量分别为137.3 mAh/g、147.4 mAh/g、143.4 mAh/g。并且在650℃煅烧所得到的正极材料的期放电平台为3.4 V,说明合成的磷酸铁锂正极材料具有较好的电化学性能。
充分混合的 Fe2P2O7/C和 Li2CO3之间形成LiFePO4材料的固相反应主要受扩散控制、合成过程中晶格重组及化合要靠离子间的相互迁移扩散而进行,即LiFePO4的形成在很大程度上受固相介质中Li+、Fe2+离子迁移速率的控制。固相原子间扩散的速度相对缓慢,必须控制一定合成时间才能获得高纯度结晶良好的材料。
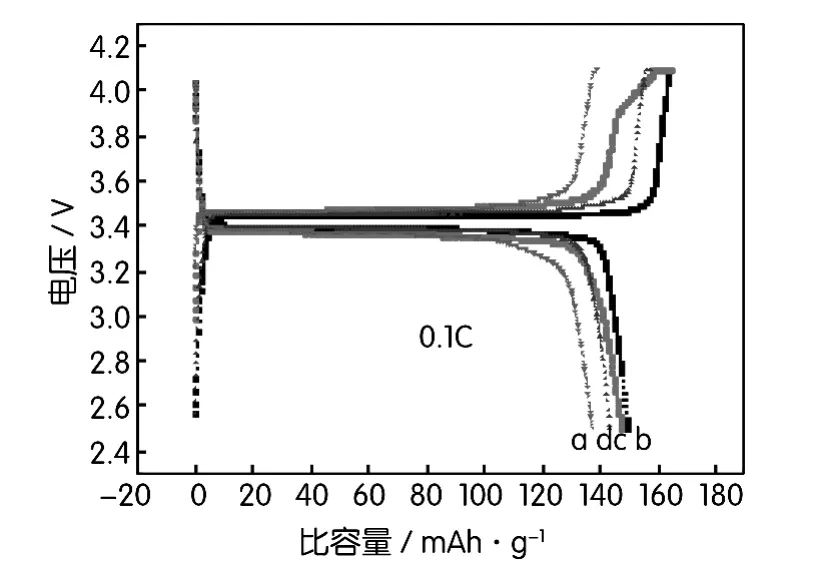
图4 不同煅烧温度制备的LiFePO4/C材料首次充放电曲线
图5为前驱体物料在650℃下分别煅烧4 h、8 h和12 h,以合成LiFePO4/C正极材料的XRD谱图。从图5中可知,不同合成时间得到的样品均为橄榄石型LiFePO4,没有明显的杂质峰且衍射特征峰比较尖锐,结晶良好。
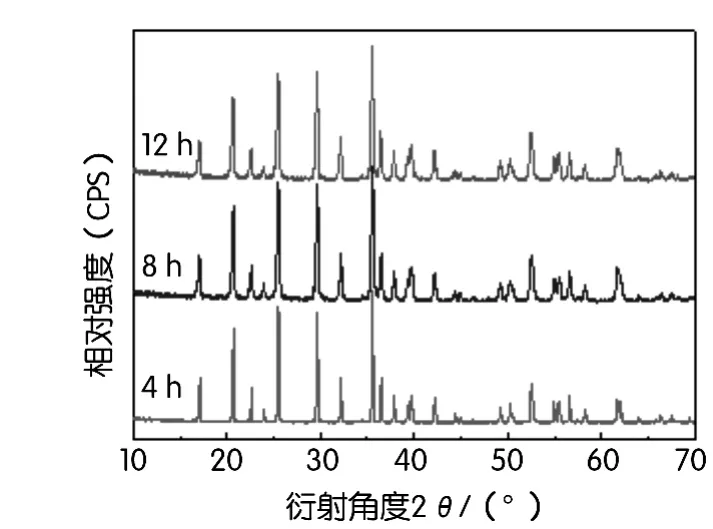
图5 650℃下不同时间合成LiFePO4/C材料的XRD图
图6为不同煅烧时间得到的材料SEM谱图。反应原料经过两次高能球磨处理,颗粒之间具有更大的接触界面促进LiFePO4/C的成核,获得细小的产物颗粒。同时分散于反应前驱体中的高聚物在焙烧过程中分解的碳均匀包覆在产物表面能很好地阻止产物颗粒长大。煅烧4 h的产物颗粒具有规整的微观形貌,颗粒之间的界限比较明显,颗粒大小分布均匀,煅烧8 h的产物虽然颗粒间有聚集但并未异常生长为大颗粒,仍保持细小的颗粒粒径,分散相对较好,这样的结构有利于电解液的渗透和加工性能的改善。随着焙烧时间的延长,产物的粒径不断增大,延长到12 h合成的样品颗粒发生了不规则生长,部分形成了大颗粒。LiFePO4在脱嵌过程时伴随着LiFePO4/FePO4两相界面在颗粒内部的移动。LiFe-PO4颗粒粒径愈大,扩散速率低的Li离子愈难嵌入颗粒中心部分,从而导致LiFePO4放电比容量降低。因此,通过控制煅烧时间可制备出颗粒粒径分布均匀的正极材料,以保证材料的电化学性能同时改善材料的加工性能。

图6 650℃不同煅烧时间得到的LiFePO4材料SEM谱图
图7为不同煅烧时间制备的LiFePO4/C材料在0.1C时的放电曲线。从图7中可以看出,4 h、8 h和12 h合成的LiFePO4/C都具有3.4 V左右的放电平台,其中4 h合成的样品放电平台低于其它时间合成的材料,在3.30 V左右。这是由于合成时间比较短,其晶体生长不完整造成的。8 h合成的样品放电曲线电压平台比较平整,但12 h合成的材料在放电后期的平台比较低。不同合成时间4 h、8 h和12 h获得的LiFePO4/C材料放电比容量分别为149.4 mAh/g、157.4 mAh/g和143.4 mAh/g。所以随着合成时间的延长,产品的晶型更加完美,其放电比容量增大,但产品的微晶尺寸和粒度也会随之增大,材料的粒径增大也就意味着锂离子在其中的扩散路径增大,这使得LiFePO4颗粒内部的锂离子脱嵌困难,不利于材料的充放电过程。所以煅烧时间不宜过长,试验选定材料的煅烧时间为8 h。
碳包覆改性可以在正极材料活性颗粒间形成有效的导电网络结构,提高电极/电解液界面的离子-电子导电性,增强其倍率充放电性能。但是碳不是正极活性材料,碳的引入还会降低材料的密度,进而降低了材料的体积能量密度。为了考察碳含量对LiFePO4/C性能的影响,本实验改变第二步葡萄糖的加入量,650℃处理8 h制备了不同碳含量的LiFe-PO4/C正极材料。
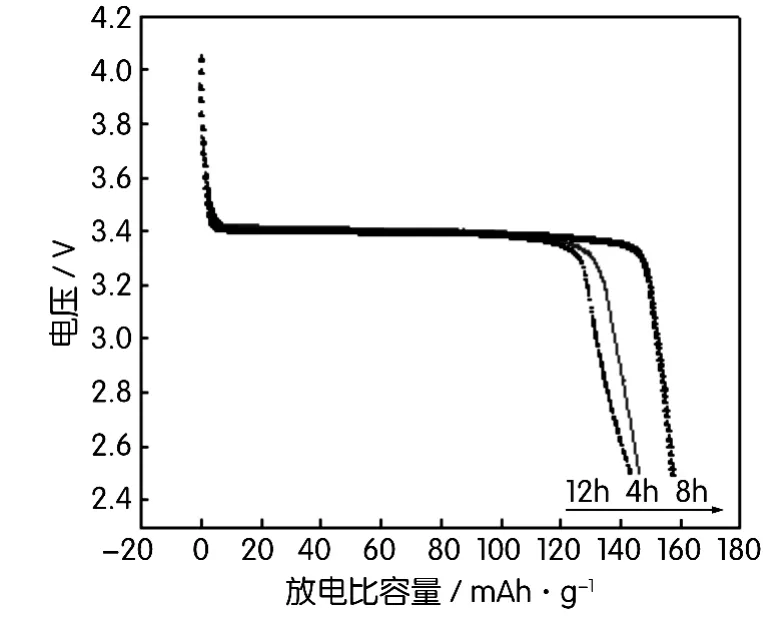
图7 650℃下不同煅烧时间制备的LiFePO4/C材料的首次放电曲线
图8为不同葡萄糖添加量制备的LiFePO4/C材料在0.1C时的充放电曲线。从图中可以看出,不同葡萄糖添加量1 g、1.5 g和2.5 g获得的LiFePO4/C材料充放电容量分别为138.4 mAh/g、157.4 mAh/g和158.3 mAh/g。
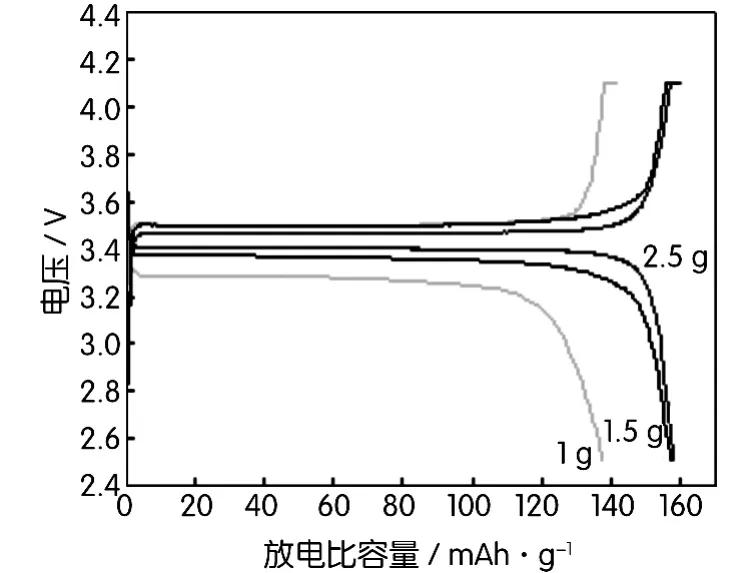
图8 不同葡萄糖添加量制备的LiFePO4/C材料在0.1C时的充放电曲线
表1为不同葡萄糖添加量的活性材料性能对比,随着葡萄糖添加量的增加,放电比容量、比表面积不断增加,振实密度相对减少。但是振实密度在第二次葡萄糖增加量为2.5 g时突然减少很多,而放电比容量只增加了少量,不利于材料的综合性能。综上所述,葡萄糖添加量为1.5 g最好。
图9给出了优化条件(煅烧温度为650℃,煅烧时间为8 h,第二次碳源添加量为1.5 g)下LiFePO4/C复合材料的SEM图,从图9中可以看出,LiFePO4微小粒子通过表面碳层连接,这种表面包覆碳结构使样品颗粒内部形成有效的导电连接,可有效提高LiFePO4的电导率,增强其高倍率充放电性能。粒径细小的粒子缩短了锂离子在本体中扩散路径,有利于提高LiFePO4材料的脱嵌过程中的动力学性能,细小粒子也提供了高的反应比表面积,保证了电解液的充分润湿,这样颗粒表面能同时发生锂离子脱嵌和电子传递的场所就越多,就越有利于减少电极极化。同时微小粒子之间接触紧密,通过碳连接形成了一定尺寸的聚集体,可提高材料的紧密堆积程度,有利于提高材料整体的振实密度和体积比能量。
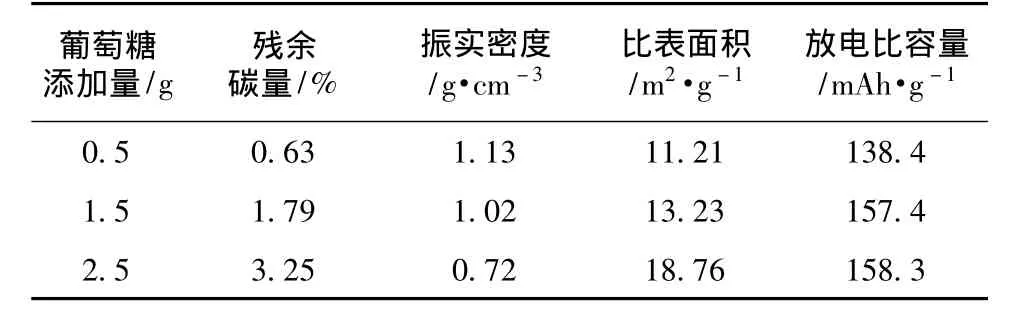
表1 不同葡萄糖添加量的LiFePO4性能对比

图9 最优条件下LiFePO4/C复合材料的SEM图
图10给出了优化条件下制备的LiFePO4/C材料的TEM图。如图10所示,碳在LiFePO4颗粒之间形成连续的连接,可在材料晶粒表面和颗粒间构成有效的导电网络,增加LiFePO4颗粒之间的导电性,整体导电性能得到改善;同时分散的碳加了正极材料的表面积,使材料与电解液充分接触,给电子、离子交换提供较好的通道,有利于电子和锂离子在电极/电解液界面的传递,从而提高电极反应动力学性能。

图10 最优条件下LiFePO4/C复合材料的TEM图
图11为优化条件下LiFePO4/C复合材料的倍率放电性能和循环性能曲线。图11(a)显示LiFe-PO4/C材料在0.2C、0.5C、1C和2C倍率下放电比容量分别为 153.7 mAh/g、147.2 mAh/g、140.0 mAh/g、128.0 mAh/g,保持了0.1C容量的97.6%、93.6%、89.3%和81.4%,并且在不同倍率下都对应着较好的放电平台,显示了良好的倍率性能。图11(b)给出了LiFePO4/C材料的不同倍率下的循环性能。LiFePO4/C材料在较低倍率下循环性能比较稳定,2C倍率下循环放电比容量存在一定的衰减,循环15次后容量降为128.0 mAh/g。良好的倍率循环性能得益于样品结晶良好、均匀的碳包覆。良好的结晶性能保证了材料在循环过程中结构的稳定性,碳包覆改善了LiFePO4材料颗粒之间的导电性,改善了正极材料的电化学反应动力学过程,有利于增强其高倍率充放电性能。
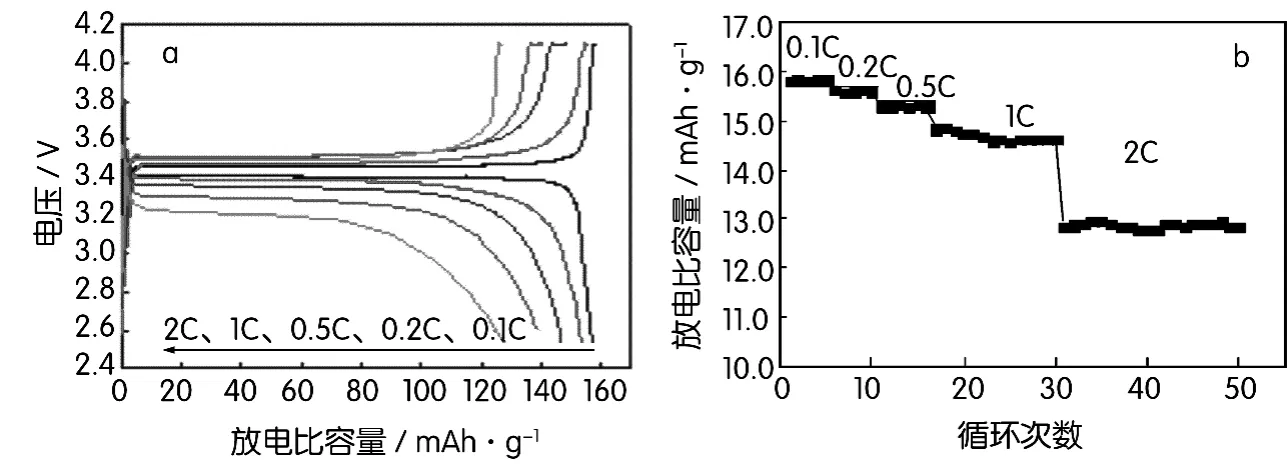
图11 LiFePO4/C材料不同倍率下充放电曲线(a)及其循环曲线(b)
3 结论
采用将FePO4·2H2O在550℃下进行预处理的同时,加入葡萄糖进行第一步包碳,然后在煅烧温度为650℃,煅烧时间为8 h,第二次碳源添加量为1.5 g的优化条件下制备LiFePO4/C材料。通过XRD测试表明材料具有良好的结晶性,TEM测试结果表明碳已包覆在活性物质表面上,形成了均匀的碳导电网络,合成的LiFePO4/C材料0.1C放电比容量是157.4 mAh/g。在0.2C、0.5C、1C和2C倍率下放电比容量分别为 153.7 mAh/g、147.2 mAh/g、140.0 mAh/g、128.0 mAh/g,保持了0.1C容量的97.6%、93.6%、89.3%和81.4%,并且在不同倍率下都对应着较好的放电平台,显示了良好的倍率性能和循环性能。
[1] Padhi A K,Nanjundaswamy K S,Goodenough J B.J.Eletrochem.Soc.Phospholivineses positive electrode materials for rechargeable lithium batteries[J].1997,144(4):1 188 - 1 194.
[2] Nagpure S C,Bhushan B,Babu S S.Raman and NMR studies of aged LiFePO4cathode[J].Applied Surface Science,2012,259(1):49-54.
[3] D Morgan,A Van der Ven,G Ceder.Li conductivity in LixFePO4(M=Mn,Fe,Co,Ni)olivine materials[J].Electrochem Solid-State Lett,2004,7(2):A30 - A32.
[4] Fisher CA J,Hart Prieto V M,Islam M S.Lithiumbattery materials LiMPO4(M=Mn,Fe,Co,and Ni):Insights into defect association,transport mechanisms,and doping[J].Chem Mater,2008,20(18):5 907-5 915.
[5] 郭玉国,王忠丽,吴兴隆,等.锂离子电池纳微结构电极材料系列研究[J].电化学,2010,16(2):119-124.
[6] Recham N,Dupont L,Courty M,et al.Ionothermal synthesis of tailor-made LiFePO4powders for Li-ion battery applications[J].Chem Mater,2009,21(6):1 096 - 1 107.
[7] J Liu,F K Liu,G L Yang,et al.The preparation of conductive nano LiFePO4/PASand its electrochemical performance[J].Electrochim Acta,2010,55(3):1 067 -1 071.
[8] Kang B,Ceder G.Battery materials for ultrafast charging and discharging[J].Nature,2009,145(3):458,190 - 193.
[9] Meethong N,KaoY H,Speakma SA n,et al.Aliovalent substitutions in olivine lithium iron phosphate and impact on structure and properties[J].Adv Funct Mater,2009,19(7):1 060 - 1 070.
[10]罗亮,曹雁冰,杜柯,等.钒掺杂对正极材料LiFePO4/C的电化学性能影响[J].无机化学学报,2014,30(9):2 000-2 005.
[11] Zhang W J.Comparison of the rate capacities of LiFePO4cathode materials[J].JElectrochem Soc,2010,157(10):A1040 - A1046.
[12] Wang H,Yang Y,Liang Y,et al.LiMn1-xFexPO4nanorods grown on graphene sheets for ultrahigh-rate-performance lithiumion batteries[J].Angew Chem Int Ed,2011,50(1):1 -6.
[13] Zhou Xufeng,Wang Feng,Zhu Yimei,et al.Graphene modified LiFePO4cathode materials for high power lithium ion batteries[J].JMate Chem,2011,21(10):3 353 -3 358.

