人参皂苷Rb1对微血管自律性舒缩活动及大鼠心肌微血管内皮细胞内钙瞬时变化的影响
王 鑫,冯 波,孙向婉,李平丽,董 虹*,穆 祥*
(1.北京农学院 兽医学(中医药)北京市重点实验室,北京 102206;2.中国农业大学 动物医学院,北京 100193)
人参皂苷Rb1对微血管自律性舒缩活动及大鼠心肌微血管内皮细胞内钙瞬时变化的影响
王 鑫1,冯 波2,孙向婉1,李平丽1,董 虹1*,穆 祥1*
(1.北京农学院 兽医学(中医药)北京市重点实验室,北京 102206;2.中国农业大学 动物医学院,北京 100193)
探讨人参皂苷Rb1(GSRb1)对人合谷穴区皮内微血管自律性舒缩活动振幅及大鼠心肌微血管内皮细胞(RMMECs)内游离钙离子瞬时变化的影响。利用激光多普勒血流测定仪结合离子导入仪检测微血管自律性舒缩活动的振幅。利用激光共聚焦显微镜、钙离子荧光探针Fluo-3AM检测ATP引起的RMMECs细胞内钙离子的变化及Rb1对其的影响。结果表明:试验确定了能够引起RMMECs细胞内游离钙离子释放的ATP的最低量为0.5 μg·mL-1,瞬时升高差异显著的剂量是0.7 μg·mL-1,能够影响RMMECs细胞内钙离子变化的GSRb1的最低量为8 μg·mL-1。RMMECs经 8 μg·mL-1GSRb1孵育后,能够刺激细胞内游离钙离子释放的ATP的最低量升高为1.5 μg·mL-1。本研究说明,提高微血管自律运动振幅的中药成分GSRb1能够通过对RMMECs胞内钙离子的影响,提高RMMECs对ATP的耐受能力(ATP的刺激量由0.5 μg·mL-1升高到1.5 μg·mL-1)。
微血管自律运动;GSRb1;ATP;Ca2+;RMMECs
微血管的自律运动是一种具有独特的振幅和频率的复杂的似周期性的生物波[1]。众多疾病状态下微血管自律性舒缩活动减弱,如急性和长期慢性炎症[2-3]、糖尿病[4]、高血压[5]和肥胖患者[6]等。有研究显示中药成分[7]、电针[8]、半导体激光[9]等刺激均可提高微血管自律性舒缩活动的幅度,说明提高微血管自律运动幅度对治疗疾病具有潜在的意义。微血管自律性舒缩活动能评估微血管内皮的功能状态[10],而微血管内皮细胞的功能异常会直接导致各种心血管相关疾病的产生。
迄今为止,中药及其有效成分的作用机制研究大多集中在血液流变学[11-12]和对心血管系统的保护作用[13,15]方面。而本研究旨在通过研究中药成分人参皂苷(Ginsenoside Rb1,GSRb1)对微血管自律性舒缩活动振幅以及微血管内皮细胞对外界刺激的耐受能力来探讨中药治疗疾病的机制。
1 材料与方法
1.1 主要试剂
Fluo-3AM购自美国Invitrogen,Pluronic F-127购自美国Invitrogen,GSRb1购自上海融禾医药科技有限公司(纯度>98%),胎牛血清、DMEM、D-Hank’s购自美国Gibco,CD31因子兔抗鼠一抗、FITC标记二抗购自北京博奥森(货号bs-0195R),细胞培养6孔板购自Costar,玻底细胞培养皿(底部带有一个直径10 mm的小坑)购自美国Corning,L-谷氨酰胺购自美国Sigma,胰蛋白酶、胶原酶Ⅱ型冻干粉购自美国GiBco公司。
1.2 微血管自律性舒缩活动的测量
解剖学位置结合穴位定位仪找到志愿者手阳明大肠经上的合谷穴作为待测穴位,并标记。用生理盐水溶解GSRb1(终质量浓度为50 μg·mL-1),以导入生理盐水(Normal saline NS)作为对照。离子导入仪(瑞典Perimed 公司,Milli-QA10型)将药物导入穴位;激光多普勒血流监测仪(瑞典Perimed 公司主机型号PeriFlux5000,探头型号Probe481-1)测量导药前后微血管血流灌注量(PU)。以PUmax-PUmin表示微血管自律性舒缩活动振幅。采用Perimed 提供的统计软件,从每位自愿者导药前后微血管舒缩活动振幅图像中分别选取5段数据计算导药前后振幅平均值﹝(PUmax-PUmin)÷5﹞。
1.3 大鼠心肌微血管内皮细胞(rat myocardial microvascular endothelial cells,RMMECs)的原代培养及鉴定
10日龄SD大鼠,脱颈处死,取出左心室壁,剥离心内膜和外膜,于0.2%的Ⅱ型胶原酶中剪碎,37 ℃消化20 min,终止消化过200目筛,1 500 r·min-1离心6 min,接种于6孔板内,4 h后更换培养液,刮除形态不规则的细胞,待细胞长至80%汇合时传代。第二次传代将细胞培养在培养碟底部的坑内,待细胞贴壁生长20 h后进行试验。形态学结合免疫荧光法鉴定细胞的纯度。倒置显微镜观察细胞的形态;用兔抗大鼠CD31相关抗原一抗(对照不加一抗,加等量PBS)37 ℃孵育2 h,PBS冲洗3次,每次3 min;加FITC标记的二抗,37 ℃孵育45 min,PBS冲洗3次,每次3 min;PBS冲洗2次,去离子水洗1次,荧光显微镜下观察。
1.4 激光共聚焦测量内皮细胞内游离钙的变化
先将Fluo-3AM混于Pluronic F-127(终浓度为0.02%)中,再使用不含Ca2+、Mg2+的无色D-Hank’s稀释,使Fluo-3AM终浓度为5 μmol·mL-1。5 μmol·mL-1的Fluo-3AM装载细胞15 min,不含Ca2+、Mg2+的D-Hank’s洗两遍,加入含有1%胎牛血清的D-Hank’s(不含Ca2+、Mg2+、无色)继续孵育20 min(让细胞内的酯酶将Fluo-3AM水解成Fluo-3),不含Ca2+、Mg2+的D-Hank’s洗两遍,加入Hepes缓冲液(NaCl 140 mmol·L-1,KCl 5 mmol·L-1,Hepes 10 mmol·L-1,Glucose 3 mmol·L-1,CaCl22 mmol·L-1,MgCl21 mmol·L-1,用NaOH调pH为7.4)缓冲5 min后使用激光共聚焦显微镜(Leica TCS SP5,Leica Application Suite Advanced Fluorescence,40倍物镜)检测。
1.5 数据分析
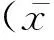
2 结 果
2.1GSRb1对微血管自律性舒缩活动振幅的影响
经皮将NS导入穴位前后微血管血流管住量变化极不显著(图1①)。导入GSRb1后,穴位区皮内的微血管血流灌注量明显增大(图1②)。导药后波动的振幅明显高于导药前波动的振幅(P<0.01)(图1B),其振幅变化为导药前的2倍,而导入生理盐水后振幅的变化不显著。
2.2 细胞培养及探针装载
细胞在倒置显微镜下可见成“铺路石”样生长(图2A),细胞膜和细胞浆内的因子被FITC标记的抗体标记呈现清晰的绿色荧光,而细胞核因缺少CD31因子呈现暗色(图2B)。因此,由形态学和CD31免疫荧光鉴定表明所培养的细胞为RMMECs。经5μmol·mL-1的Fluo-3AM装载细胞15min后,可见Fluo-3均匀分布在细胞内(图2D)。

①,②分别表示导入NS和GSRb1,A表示导入之前,B表示导入之后;③为经统计学方法处理的数据,**表示P<0.01①,② represent the introduction of NS and GSRb1。A is before the introduction,B is after the introduction;③ is statistics data ,** P<0.01图1 GSRb1对微血管自律性舒缩活动振幅的影响Fig.1 Effect of GSRb1 on the microvascular vasomotion amplitude of self-discipline
A.倒置显微镜下细胞;B.倒置荧光显微镜下抗体标记后的细胞;C.阴性为对照;D.5 μmol·mL-1的Fluo-3AM负载细胞15 minA.Cells under inverted microscope photos;B.Antibody marker under inverted fluorescence microscope cell images;C.As negative as control;D.The image of the 5 μmol·mL-1 Fluo-3AM load cell for 15 min 图2 RMMECs的鉴定及探针负载Fig.2 Identification and probe of RMMECs load
2.3 GSRb1对RMMECs内钙的影响
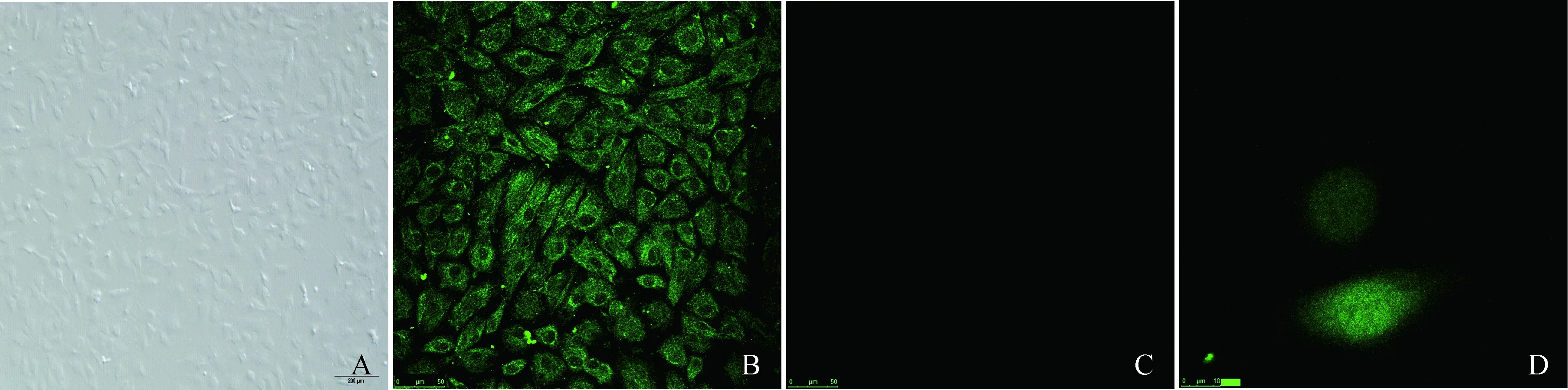
2.3.1 刺激RMMECs细胞内钙瞬时变化的ATP和GSRb1最小剂量 0.3 μg·mL-1的ATP不能够刺激RMMECs内游离钙离子瞬时升高(图3 A)。0.5、0.6 μg·mL-1的ATP刚好能够引起RMMECs胞内出现钙离子峰(图3B、C)。当质量浓度升高到0.7 μg·mL-1时,ATP会诱导细胞内钙离子显著升高(图3E)。Hepes缓冲液对照组结果表明Hepes缓冲液不能诱导RMMECs内游离钙离子瞬时变化(图未展示)。因此,能够诱导RMMECs胞内钙离子瞬时升高ATP的最低剂量为0.5 μg·mL-1,瞬时升高差异显著的剂量是0.7 μg·mL-1。5 μg·mL-1的GSRb1对细胞内钙离子没有影响(图4A),6、7 μg·mL-1的GSRb1刚好能够引起RMMECs内钙降低(图3E)。当质量浓度升高到8 μg·mL-1,GSRb1能够显著降低RMMECs内钙离子(图3 E)。结果表明,能够降低RMMECs内钙离子的GSRb1剂量为8 μg·mL-1。
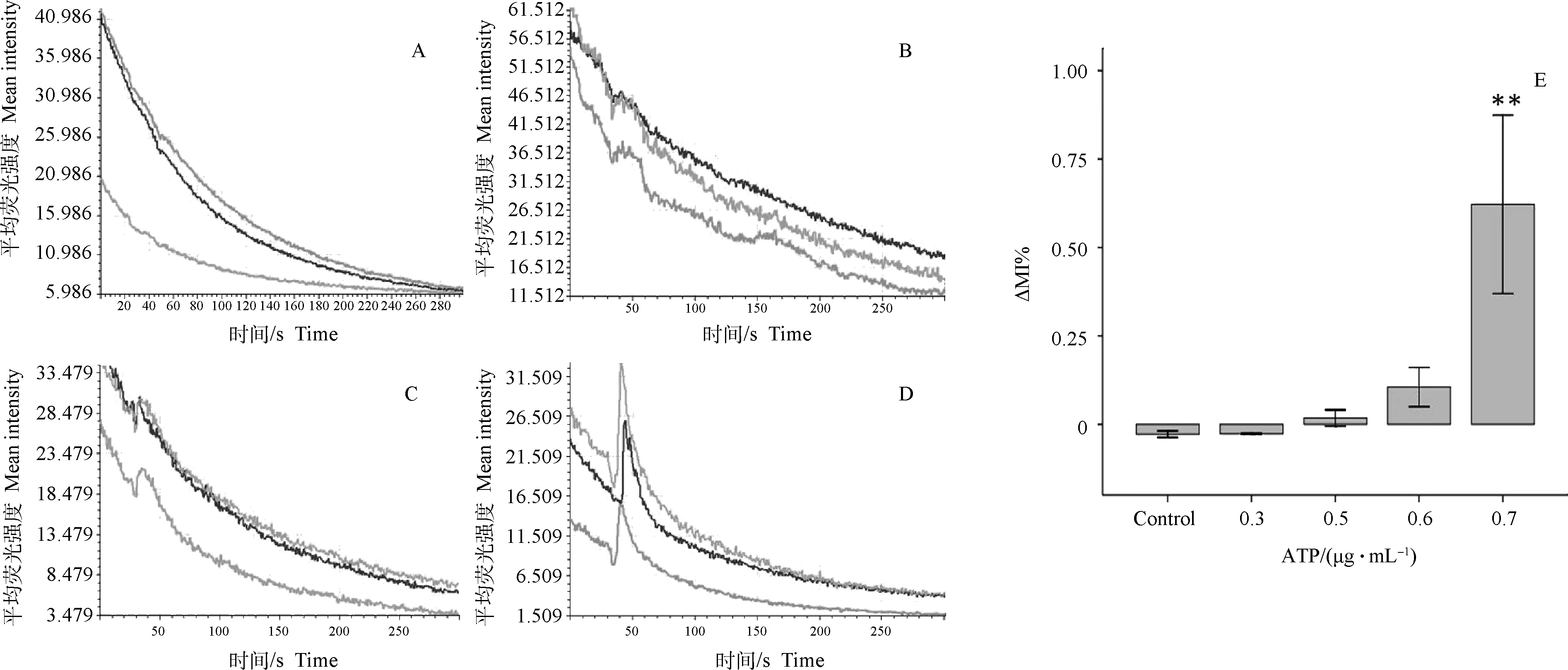
A、B、C、D分别为0.3、0.5、0.6、0.7 μg·mL-1的ATP刺激RMMECs后,细胞内钙离子的变化。开始记录30 s加ATP。E为经统计学方法处理的数据柱状图,**表示P<0.01A,B,C,D are Figures that show the change of intracellular calcium by 0.3,0.5,0.6,0.7 μg·mL-1ATP after RMMECs stimulation,respectively.To start recording 30 s plus ATP.E show the statistics data,** was that P<0.01 图3 不同剂量ATP对RMMECs内钙的影响Fig.3 Effect of different doses of ATP on the RMMECs of intracellular calcium

A、B、C、D分别为5、6、7、8 μg·mL-1的GSRb1对细胞内钙的影响。开始记录30 s后加GSRb1。E为经统计学方法处理的数据柱状图,**表示P<0.01A,B,C,D are the Figures that show the effects of 5,6,7,8 μg·mL-1 GSRb1 on intracellular calcium,respectively.To start recording 30 s plus GSRb1.E show the statistics data,** was that P<0.01图4 不同剂量GSRb1对RMMECs内钙的影响Fig.4 Effect of different doses of GSRb1 on the RMMECs of intracellular calcium
2.3.2 GSRb1对ATP诱导RMMECs细胞内钙变化的影响 经8 μg·mL-1GSRb1孵育细胞20 min后,相对于图3(未经GSRb1孵育,0.5 μg·mL-1的ATP对细胞内钙的影响)0.5 μg·mL-1的ATP不能够诱导RMMECs内钙瞬时升高(图5A)。当ATP质量浓度提高到1.5 μg·mL-1时,才能诱导细胞内钙离子显著升高(图5C)。经相同摩尔浓度的组胺(舒张血管物质)孵育20 min后,用0.5 μg·mL-1的ATP刺激仍会出现明显的钙离子峰(图5D)。

A、B、C分别为8 μg·mL-1 GSRb1孵育20 min后0.5、1、1.5 μg·mL-1 ATP刺激RMMECs内游离钙离子的变化;D为相同摩尔浓度组胺孵育20 min后0.5 μg·mL-1的ATP刺激RMMECs内游离钙离子浓度的变化。开始记录后30 s加ATP。E为经统计学方法处理的数据,**表示P<0.01A,B,C are the Figures that show the effects of 0.5,1,1.5 μg·mL-1 ATP on intracellular calcium after incubation 20 min by 8 μg·mL-1 GSRb1,respectively.D was 0.5 μg·mL-1 ATP on intracellular calcium after incubation 20 min by the same molarity histamine.E show the statistics data,** was that P<0.01图5 GSRb1孵育RMMECs后不同剂量ATP对细胞内钙的作用Fig.5 The effect of different doses of ATP on intracellular calcium after incubation of RMMECs with GSRb1
3 讨 论
微血管自律性的舒缩活动参与多种生理、病理过程的应激反应,对许多生理、病理过程及疾病的发生、发展和转归具有重要意义,故对其检测及研究显得尤为重要。有研究显示提高穴位区微血管自律运动振幅能有效减轻原发性痛经导致的疼痛[16]。因此,提高微血管自律性舒缩活动的振幅具有潜在的治疗疾病的意义。微血管舒缩活动的研究方法主要包括体外分离微动脉、体内显微观察和体表多普勒血流信号采集[17]等。体外分离出微动脉可直接测量微动脉管径的周期性变化[18],但是,该方法不能完全真实反映出体内的变化规律,因而在研究中受到限制。而本试验采用的激光多普勒血流监测仪可以在体表检测到皮肤0.5~1 mm范围内下微血管网血流量的变化,因此在无损伤状态下可反映出微血管舒缩活动,并且利用离子导入仪,将药物在无损伤性的微小电流作用下,导入皮下组织,选用生理盐水配制所用中药有效成分,保证导入后能够反映药物作用的真实性。另外试验中所选用的中药成分均来自天然植物,用量极微,只作用于局部皮肤,对组织不造成损伤。采用激光多普勒血流监测仪结合离子导入仪的方法可准确有效地研究生理条件下中药有效成分对微血管舒缩活动的影响。使用这一研究方法发现,导入GSRb1能够显著增加穴位区皮内微血管血流灌注量最大值与最小值之差(PUmax-PUmin),即提高了微血管自律性舒缩活动的振幅。
研究表明,激光扫描共焦显微镜和Fluo-3AM常用于检测ATP诱导的细胞内游离钙离子的变化[19,20]。本研究中,作者使用激光扫描共焦显微镜及Fluo-3AM检测RMMECs内钙离子的变化。内皮细胞膜表面存在一种受体门控性阳离子通道(purinergic ligand-gated receptor channel,P2X),ATP是该通道配体[21],在细胞外液中有钙和无钙时,ATP均能诱导细胞内出现钙离子峰[22],因此选择ATP作为刺激物。可以将刺激RMMECs内钙产生变化的ATP最低剂量作为细胞对ATP的最低耐受值。能够诱导RMMECs内钙离子瞬时升高的ATP最低剂量为0.5 μg·mL-1,瞬时升高差异显著的剂量是0.7 μg·mL-1,GSRb1能够降低RMMECs内游离钙离子的浓度,最低剂量为8 μg·mL-1。经8 μg·mL-1GSRb1孵育RMMECs后,0.5 μg·mL-1ATP刺激细胞,细胞内钙离子没有任何变化,1.0 μg·mL-1ATP刺激细胞内钙离子虽然有升高,但是没有差异显著,1.5 μg·mL-1ATP刺激细胞内钙离子升高有显著差异。表明GSRb1对胞外ATP诱导的RMMECs内游离钙离子瞬时升高有明显的抑制作用。研究显示,GSRb1对心肌细胞膜Ca2+电流有明显的阻滞作用,是一种钙通道阻滞剂[22],人参总提取物对大鼠感觉神经元高电压激活的钙离子通道具有抑制作用,能抑制高电压激活钙离子通道的电流[23],对大鼠皮层神经元上的L-型钙离子通道也有抑制作用[24]。而将ATP的剂量提高至1.5 μg·mL-1时,才能诱导细胞内钙离子瞬时升高。使用只具有血管舒张作用组胺孵育RMMECs后,0.5 μg·mL-1ATP仍然能使RMMECs内钙离子瞬时变化,说明GSRb1不是单纯的通过提高血管舒缩幅度,还有可能够通过抑制RMMECs上钙离子通道降低细胞对ATP的敏感度。
采用激光多普勒血流监测仪结合离子导入仪,检测出GSRb1能够显著提高微血管舒缩活动振幅;使用激光扫描共焦显微镜和Fluo-3AM检测出GSRb1能提高RMMECs对ATP的耐受能力。推测提高微血管内皮细胞对胞外刺激的耐受能力可能是具有提高微血管自律性舒缩活动振幅的中药成分防治疾病的机制。
[1] 修瑞娟.微血管自律运动的研究Ⅱ.骨骼肌的微血管自律运动及其与血流速度及血流量的关系(简报) [J].中国医学科学院学报,1985,7(2):116. XIU R J.Study on microvascular vasomotion Ⅱ.Vasomotion in skeletal muscle and the relationship between it with blood flow and velocity of blood flow [J].ActaAcademiaeMedicinaeSinicae,1985,7(2):116.(in Chinese)
[2] SCHINDLER T H,NITZSCHE E U,OLSCHEWSKI M,et al.Chronic inflammation and impaired coronary vasoreactivity in patients with coronary risk factors [J].Circulation,2004,110(9):1069-1075.
[3] SIMMONS G H,PADILLA J,JENKINS N T,et al.Exercise training and vascular cell phenotype in a swine model of familial hypercholesterolaemia:conduit arteries and veins[J].ExpPhysiol,2014,99(2):454-465.
[4] TIGNO X T,HANSEN B C,ALBANO A M.Vasomotion spectra and principal components of pooled measures predict diabetes in monkeys[J].IntJBifurcatChaos,2009,19(7):2439-2446.
[5] HUNG M W,KRAVTSOV G M,LAU C F,et al.Melatonin ameliorates endothelial dysfunction,vascular inflammation,and systemic hypertension in rats with chronic intermittent hypoxia[J].JPinealRes,2013,55(3):247-256.
[6] DE JONGH R T,SERNÉ E H,IJZERMAN R G,et al.Impaired local microvascular vasodilatory effects of insulin and reduced skin microvascular vasomotion in obese women[J].MicrovascRes,2008,75(2):256-262.
[7] 宣颖超,张 涛,郭 洋,等.白头翁汤中主要成分导入合谷穴对皮肤微血管舒缩振幅的作用[J].微循环学杂志,2011,21(2):1-3. XUAN Y C,ZHANG T,GUO Y,et al.Effect of components of pulsatilla decoction on amplitude of cutaneous microvasomotion at Hegu Acupoint[J].ChineseJournalofMicrocircUlation,2011,21(2):1-3.(in Chinese)
[8] 赵平平,洪俪凤.针灸对微血管自律运动(微循环)影响的研究概况[J].甘肃中医,1999,12(2):45-48. ZHAO P P,HONG L F.Effect of acupuncture on microvascular vasomotion(microcirculation)[J].GansuJournalofTraditionalChineseMedicine,1999,12(2):45-48.(in Chinese)
[9] 赵 雪,侯 爽,黄 群,等.半导体激光照射对穴位区微血管功能的影响[J].激光杂志,2011,32(6):64-66. ZHAO X,HOU S,HUANG Q,et al.Effect of semiconductor laser radiation on point area microsvascular function[J].LaserJournal,2011,32(6):64-66.(in Chinese)
[10] ROSSI M,CARPI A,GALETTA F,et al.Skin vasomotion investigation:A useful tool for clinical evaluation of microvascular endothelial function?[J].BiomedPharmacother,2008,62(8):541-545.
[11] 彭黎明,邓承祺.现代血栓与止血的实验室检测及其应用[M].北京:人民卫生出版社,2004:277-284. PENG L M,DENG C Q.Modern laboratory technology and its application in thrombosis and hemostasis[M].Beijing:People’s Medical Publishing House,2004:277-284.(in Chinese)
[12] 秦任甲.临床血液流变学(修订版)[M].北京:北京大学医学出版社,2006. QIN R J.Clinical hemorheology (Revision)[M].Beijing:Peking University Medical Press,2006.(in Chinese)
[13] 贾 杰,周 瑛,韦中奎.中药治疗心血管疾病研究概况[J].北方药学,2014(2):63-64. JIA J,ZHOU Y,WEI Z K.The study of traditional Chinese medicine for cardiocerebrovascular disease[J].JournalofNorthPharmacy,2014(2):63-64.(in Chinese)
[14] 王梓宁.中医药治疗心血管病的文献计量分析[D].北京:中国中医科学院,2013. WANG Z N.The biblometric study on traditional Chinese medicine treatment of cardiovascular diseases[D].Beijing:China Academy of Chinese Medicial Sciences,2013.(in Chinese)
[15] 金 戈,明海霞,董晓丽.益气活血中药对家兔心气虚证NO、ET及血液流变学的影响[J].中国老年学杂志,2011,31(15):2916-2918. JIN G,MING H X,DONG X L.The effect of Chinese medicinal with supplementing qi and activating blood circulation in rabbit with syndrome of deficiency of qi in heart to NO,ET and hemorheology[J].ChineseJournalofGerontology,2011,31(15):2916-2918.(in Chinese)
[16] HUANG T,LI Y,JIA S,et al.Capillary blood flow in patients with dysmenorrhea treated with acupuncture[J].JTraditChinMed,2013,33(6):757-760.
[17] 曾昭炜,谢忠明,唐荣福,等.观察动物微循环的实验方法[J].微循环学杂志,2011,21(3):26-32. ZENG Z W,XIE Z M,TANG R F,et al.The experimental technologies of obversing microcirculation in animals[J].ChineseJournalofMicrocirculation,2011,21(3):26-32.(in Chinese)
[18] DESOUZA M D,BOUSKELA E.Arteriolar diameter and spontaneous vasomotion:Importance of potassium channels and nitric oxide[J].MicrovascRes,2013,90:121-127.
[19] WANG H,ZHOU G,GAI H,et al.A fluorescein-based probe with high selectivity to cysteine over homocysteine and glutathione[J].ChemCommun(Camb),2012,48(67):8341-8343.
[20] MASHINO K,SADANAGA N,YAMAGUCHI H,et al.Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma [J].CancerRes,2002,62(10):2937-2941.
[21] KAHLENBERG J M,LUNDBERG K C,KERTESY S B,et al.Potentiation of caspase-1 activation by the P2X7 receptor is dependent on TLR signals and requires NF-kappaB-driven protein synthesis [J].JImmunol,2005,175(11):7611-7622.
[22] 张 斌,金士翱,况 铣.三七皂甙单体Rb1对心肌细胞膜钙离子通道的影响[J].中国药理学通报,1998,14(1):33-35. ZHANG B,JIN S A,KUANG X.Effect of Rb1 on calcium channel in guinea pig ventricular myocytes[J].ChinesePharmacologicalBulletin,1998,14(1):33-35.(in Chinese)
[23] KIM S,NAH S Y,RHIM H.Neuroprotective effects of ginseng saponins against L- type Ca2+channel-mediated cell death in rat cortical neurons[J].BiochemBiophysResCommun,2008,365(3):399-405.
[24] LOUGHREY C M,MACEACHERN K E,COOPER J,et al.Measurement of the dissociation constant of Fluo-3 for Ca2+in isolated rabbit cardiomyocytes using Ca2+wave characteristics[J].CellCalcium,2003,34(1):1-9.
(编辑 白永平)
Effect of Ginsenoside Rb1 Induce Microvascular Vasomotion and the Effect on Sensitive Threshold of Rat Myocardial Microvascular Endothelial Cells
WANG Xin1,FENG Bo2,SUN Xiang-wan1,LI Ping-li1,DONG Hong1*,MU Xiang1*
(1.BeijingKeyLaboratoryofTraditionalChineseVeterinaryMedicine,BeijingUniversityofAgriculture,Beijing102206,China; 2.CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing100193,China)
The aim of this study was to investigate the effects of Ginsenoside Rb1(GSRb1) induce Hegu acupoint microvascular vasomotion and the effect on sensitive threshold of Rat myocardial microvascular endothelial cells(RMMECs).Microvascular vasomotion was detected by laser doppler blood flow monitor combined with iontophoresis device.The changes of calcium in the RMMECs were measured by laser scanning confocal microscopy combined with calcium fluorescent probe (Fluo-3AM).The results were as follows:The minimum amount of ATP could induce calcium transient increase in RMMECs was 0.5 μg·mL-1,the dose of significant difference was 0.7 μg·mL-1and the minimum amounts of GSRb1 inducing calcium changes in RMMECs was 8 μg·mL-1.After incubation 8 μg·mL-1of GSRb1,the minimum amount of ATP could induce calcium transient increase in RMMECs was 1.5 μg·mL-1.Eight μg·mL-1of GSRb1 can inhibit the ATP-induced intracellular calcium transient rise,that meant,GSRb1 increased the sensitive threshold of RMMECs to ATP.
microvascular vasomotion; GSRb1;ATP;Ca2+;RMMECs
10.11843/j.issn.0366-6964.2015.01.020
2014-10-28
国家自然科学基金(31101850);北京市教委科技发展计划重点项目(KZ201110020021);北京市教委科技面上项目(KM201210020008);北京市自然基金(6132007);北京市科技新星(Z141105001814041);2014年北京农学院学位与研究生教育改革与发展项目(2014YJS057)
王 鑫(1992-),男,江西靖安人,硕士生,主要从事中兽医药及疾病防控方面研究,E-mail:williamxin0217@163.com
*通信作者:董 虹,副教授,Tel:010-80799480,E-mail:donghong523@163.com; 穆 祥,教授,Tel:010-80789515,E-mail:muxiang1109@sina.com
R285.5;R331.3
A
0366-6964(2015)01-0156-07
——《艺术自律性研究》评介

