霍乱弧菌DncV蛋白的原核表达及活性分析
韩莹倩,孔江南,王 江,张 超,杨国宇
(河南农业大学农业部动物生化与营养重点开放实验室,郑州 450002)
霍乱弧菌DncV蛋白的原核表达及活性分析
韩莹倩,孔江南,王 江,张 超,杨国宇*
(河南农业大学农业部动物生化与营养重点开放实验室,郑州 450002)
DncV(VC0179)是在霍乱弧菌中发现的一种双核苷酸环化酶,其可以合成c-di-AMP、c-di-GMP和c-GAMP。研究发现c-di-GMP作为胞内的第二信使,通过STING信号通路激活先天性免疫应答。为了体外制备c-di-GMP用于深入研究其功能,构建了VC0179融合cherry标签的丙酸诱导型表达载体,并将该重组表达载体转化至大肠杆菌BL21(DE3)中。利用丙酸钠诱导表达后,观察菌体颜色是否为红色判断融合蛋白质的表达。超声破碎细菌后经SDS-PAGE电泳检测融合蛋白质的可溶性表达。最后通过Ni-NTA Agarose亲和纯化重组蛋白质,获得的重组蛋白质进行体外酶促反应,高效液相色谱检测合成产物c-di-GMP。结果表明:成功构建VC0179丙酸诱导型原核表达载体并获得了高纯度的VC0179重组蛋白质。该重组蛋白质通过体外酶促反应可一步生成c-di-GMP。本试验建立了稳定获得具有酶活性的VC0179重组蛋白质的方法;c-di-GMP的体外合成为其后续功能研究及大量制备奠定基础。
VC0179;c-di-GMP;原核表达;酶促合成法;高效液相色谱
DncV(VC0179)是在霍乱弧菌中发现的一种催化合成c-di-AMP、c-di-GMP、c-GAMP双核苷酸环化酶[1]。其合成产物c-di-AMP与c-di-GMP作为胞内的第二信使可调节细菌体内的多种应答[2]。19世纪90年代,人们首次发现c-di-GMP对醋酸纤维杆菌的生物膜形成具有重要的调节作用,是一种新型纤维素合成酶变构调节因子[3-4]。此外,c-di-GMP在细胞周期、生长发育、菌毛生成、Ⅲ型分泌系统、RNA调节、压力应激、细菌捕食、毒力等多方面发挥调控作用[2,5-6]。在哺乳动物细胞的研究中发现,c-di-GMP、c-GAMP作为胞内的第二信使,可直接与STING相互作用激活干扰素效应模式识别系统,诱导Ⅰ型干扰素的表达[7-9]。鉴于VC0179合成产物在生物体中的重要功能,本试验构建了VC0179丙酸诱导型原核表达载体,并对其进行表达分析与纯化,获得高纯度的VC0179靶蛋白。体外一步法合成c-di-GMP为进一步功能研究及免疫增强剂c-di-GMP产品的制备奠定基础。
1 材料与方法
1.1 主要试剂材料
质粒小量快速提取试剂盒、胶回收试剂盒及PCR纯化试剂盒均购自生工生物工程(上海)有限公司;Ni-NTA Agarose购自Qiagen公司;T4连接酶、限制性内切酶BamHⅠ和XhoⅠ均购自英国NEB公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;GTP标准品购于Aladdin公司;c-di-GMP标准品购于Invivogen公司;4-羟乙基哌嗪乙磺酸(HEPES)、乙酸铵和MgCl2购于Sigma公司;色谱甲醇购于Fisher公司;E.coilDH5α、E.coilBL21(DE3)感受态细胞和TEV酶均为本室保存;含全长VC0179重组质粒pMD19-VC0179及含His和cherry标签的丙酸诱导型载体由本室构建保存。
1.2 表达载体的构建及鉴定
用BamHⅠ和XhoⅠ双酶切pMD19-VC0179,获得VC0179目的片段的全长。用T4连接酶将其与同样酶切处理的丙酸诱导型载体连接,连接产物转化E.coilDH5α。转化菌液涂布于含氨苄青霉素(100 mg·mL-1) LB平板,37 ℃倒置培养过夜。挑选阳性克隆,用BamHⅠ和XhoⅠ酶切验证后,送往生工生物工程(上海)有限公司测序鉴定。
1.3 重组蛋白质的诱导表达及可溶性鉴定
将测序正确的重组质粒转化至E.coilBL21(DE3)。在含Amp的LB平板上挑取含重组质粒的单个菌落,接种于含100 mg·mL-1Amp的2 mL LB液体培养基中,37 ℃培养过夜。将得到的菌液按体积比1∶100接种于含100 mg·mL-1Amp的100 mL LB液体培养基中,37 ℃、220 r·min-1振荡培养至OD600 nm达0.6,将菌液分两等份,一瓶加入20 mmol·L-1的丙酸钠,室温过夜诱导表达,另外一瓶作为空白对照不加诱导剂室温过夜摇菌。次日各吸取1 mL,离心去上清,加PBS重悬,加入等体积2×SDS-PAGE上样缓冲液混匀,沸水煮10 min。剩余的菌液离心收集沉淀,10 mL PBS重悬菌体,加溶菌酶(1 mol·L-1)冰浴30 min后,低温超声波破碎菌体(超声时间4 s,间歇7 s,100次)。分别收集上清和沉淀进行SDS-PAGE分析。
1.4 重组蛋白质的纯化与酶切
将诱导成功的阳性重组菌液接种于2 mL LB(含Amp)培养液中,37 ℃、220 r·min-1振荡培养过夜。次日取1 mL菌液接种于100 mL LB(含Amp)培养基中,37 °C振荡培养至OD600 nm为0.6,加入终浓度为20 mmol·L-1的丙酸钠,室温、180 r·min-1诱导过夜。离心收集菌体细胞,加10 mL Lysis buffer重悬,加溶菌酶(1 mg·mL-1)混匀后冰浴30 min,低温超声破碎。破碎后低温离心30 min,取40 μL上清制备SDS-PAGE分析样品。剩余的上清液加到预前处理好的Ni-NTA,4 °C 200 r·min-1结合60 min,将上清-Ni-NTA混合物分为2份,一份用5倍体积的Wash buffer洗3次,最后用0.5 mL Elution buffer洗脱靶蛋白4次,收集4次的洗脱液。另外一份直接加入2 mL Wash buffer(含TEV酶) 4 °C振荡酶切过夜,次日低速离心取上清。分别吸取40 μL的洗脱液及TEV酶切后的上清液,加入等体积2×SDS-PAGE上样缓冲液混匀,沸水煮10 min,-20 °C保存。
1.5 c-di-GMP的合成及鉴定
1.5.1 标准品及底物溶液的配制 精确称取一定量c-di-GMP及GTP,用水溶解配成质量浓度为20 μg·mL-1的标准品溶液及100 mmol·L-1的底物溶液。
1.5.2 c-di-GMP的合成 纯化的VC0179重组蛋白通过BCA蛋白浓度测定后,取1.2 μmol·L-1VC0179与2 mmol·L-1的GTP在含5 mmol·L-1MgCl2和20 mmol·L-1HEPES的缓冲液中37 ℃反应2 h。
1.5.3 液相色谱条件 Venusil XBP C18(L)色谱柱(5 μmol·L-1,250×4.6 mm,Agela);检测波长:254 nm;流速:1.0 mL·min-1;进样量:5 μL;柱温:25 ℃。流动相:乙酸铵(A)-甲醇(B),采用线性梯度洗脱:流动相在45 min之内从95% A+5% B逐渐降至50% A + 50% B。
2 结 果
2.1 重组表达载体的构建及鉴定
酶切获取VC0179和丙酸诱导型载体的线性片段(图1 A),连接转化后挑取阳性菌落双酶切鉴定,结果与预期相符(图1 B)。阳性克隆测序结果显示重组质粒构建成功。
2.2 重组蛋白质的诱导表达及可溶性鉴定
重组质粒转化至E.coilBL21(DE3),20 mmol·L-1丙酸钠室温诱导过夜。取2 mL菌液离心后观察菌体为红色。超声破碎诱导后菌体分别收集上清和沉淀,SDS-PAGE结果显示诱导后的全菌和上清样品在72 ku处均有一明显的条带(图2)。结果表明,成功诱导表达重组蛋白且为可溶性表达。
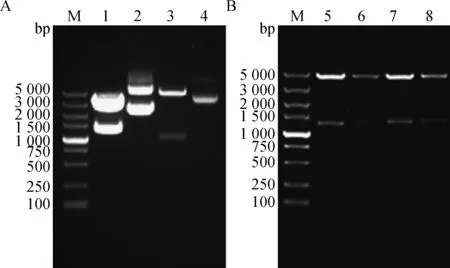
M.5 000 bp DNA相对分子质量标准;1.pMD-19-VC0179酶切后的片段(目的片段为小片段);2.pMD-19-VC0179原质粒;3.丙酸诱导型载体酶切后的片段(目的片段为大片段);4.丙酸诱导型载体原质粒;5~8.重组质粒M.DL5000 DNA marker;1.Product of pMD-19-VC0179 digested by BamHⅠ and XhoⅠ(The target fragment is the shorter one);2.Plasmid of pMD-19-VC0179;3.Product of propionate-inducible vector digested by BamHⅠ and XhoⅠ (The target fragment is the larger one);4.Plasmid of propionate-inducible vector;5-8.Recombinant plasmids图1 酶切获取VC0179与丙酸诱导型载体线性片段及重组质粒BamHⅠ和XhoⅠ酶切鉴定Fig.1 Target fragment of VC0179 and propionate-inducible vector by restriction enzyme and identification of recombinant plasmid digested by BamHⅠ and XhoⅠ
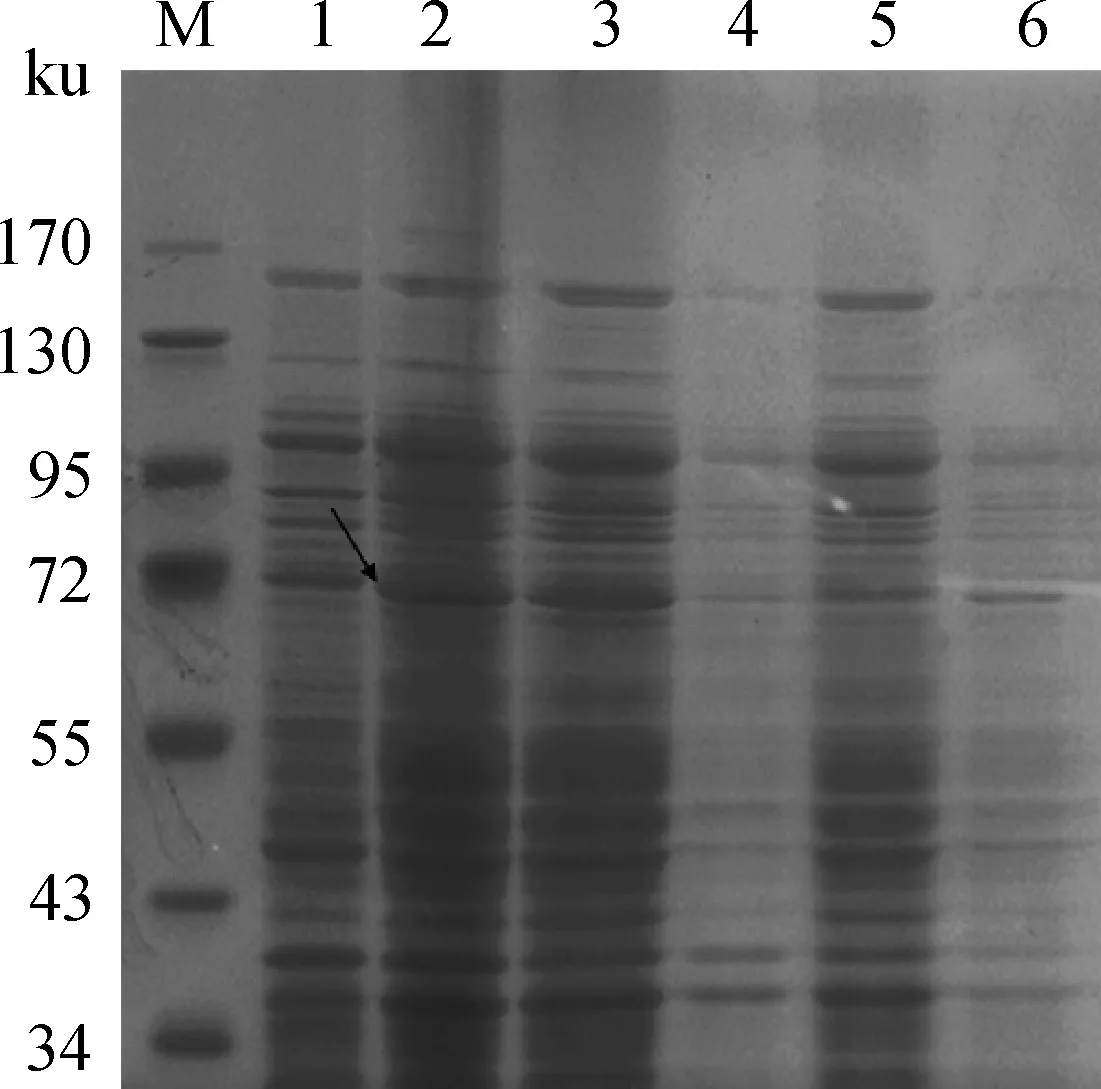
M.蛋白质相对分子质量标准;1.未诱导的重组质粒BL21(DE3) 菌总蛋白质;2.诱导后的重组质粒BL21(DE3) 菌总蛋白质;3.诱导后的重组质粒BL21(DE3) 菌超声破碎的上清液;4.诱导后的重组质粒BL21(DE3) 菌超声破碎的沉淀;5.未诱导的重组质粒BL21(DE3) 菌超声破碎的上清液;6.未诱导的重组质粒BL21(DE3) 菌超声破碎的沉淀M.Protein molecular weight marker;1.Total protein of uninduced BL21(DE3) with recombinant plasmid;2.Total protein of induced BL21(DE3) with recombinant plasmid by propionate;3.Supernatant after ultrasonic of induced BL21(DE3) with recombinant plasmid by propionate;4.Inclusion after ultrasonic of induced BL21(DE3) with recombinant plasmid by propionate;5.Supernatant after ultrasonic of uninduced BL21(DE3) with recombinant plasmid;6.Inclusion after ultrasonic of uninduced BL21(DE3) with recombinant plasmid图2 VC0179重组蛋白在大肠杆菌BL21(DE3)中表达的SDS-PAGE分析Fig.2 SDS-PAGE analysis of the recombinant VC0179 expression in E.coli BL21(DE3)
2.3 重组蛋白质的纯化与酶切
取处理好的各个样品10 μL,经12% SDS-PAGE电泳(图3)。考马斯亮蓝染色结果显示,纯化后获得较高纯度的重组蛋白质,TEV酶成功切除重组蛋白质中的融合标签,获得VC0179靶蛋白。
2.4 c-di-GMP的合成及鉴定
高效液相色谱生成报告显示(图4):VC0179重组蛋白体外酶促反应生成产物的出峰时间与c-di-GMP标准品出峰时间一致。结果表明本试验所获得的重组蛋白质具有功能活性,可在体外一步法生成c-di-GMP。
3 讨 论
VC0179是人们发现的首个可以在革兰阴性菌中合成c-di-AMP、c-di-GMP、c-GAMP的一种新型的双核苷酸环化酶[1]。VC0179作为环化酶可有效促进霍乱弧菌的肠道定殖,同时还可调节趋化性的细菌定殖[1]。随后的研究发现,真核细胞在转染dsDNA或DNA病毒侵染后也可生成c-GAMP,c-GAMP与STING结合后活化TBK1-IRF3信号通路介导Ⅰ型干扰素应答[10]。c-di-GMP也可通过该信号通路诱导Ⅰ型干扰素表达[11]。研究证实c-di-GMP可作为一种疫苗佐剂促进黏膜途径的免疫[12-13]。鉴于VC0179的合成产物在先天性免疫中的重要功能,本试验构建了VC0179原核表达载体对其进行表达及纯化,旨于建立一种稳定获得可溶性表达的有活性的VC0179重组蛋白的方法,进而用于体外酶促反应研究。

M.蛋白质相对分子质量标准;1.诱导前重组质粒BL21(DE3) 菌总蛋白质;2.诱导后重组质粒BL21(DE3) 菌总蛋白质;3.诱导后重组质粒BL21(DE3) 菌超声破碎的上清液;4.纯化的重组蛋白质;5.TEV酶切后的VC0179蛋白M.Protein molecular weight marker;1.Total protein of BL21(DE3) with recombinant plasmid before induction;2.Total protein of induced BL21(DE3) with recombinant plasmid by propionate;3.Supernatant after ultrasonic of induced BL21(DE3) with recombinant VC0179 plasmid by propionate;4.Puried recombinant protein;5.VC0179 protein after TEV cleavage图3 纯化及TEV酶切后VC0179重组蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purification and TEV cleavage of VC0179 recombinant protein
本试验构建的VC0179原核表达载体可使重组蛋白在E.coil中大量廉价表达,便于分离纯化,避免了对包涵体变性复性处理,为纯化保持VC0179活性提供保证。本试验虽然成功获得c-di-GMP,但最佳的合成条件还需进一步摸索以提高GTP的利用率及产量。B.W.Davies等[1]曾用RPHPLC、LCMS、MS/MS、变性凝胶电泳等多种方法检测VC0179的体外合成产物c-di-AMP、c-di-GMP及c-GAMP。本试验仅用高效液相色谱法检测VC0179体外合成产物,更加简便低成本的检测手段还有待进一步研究。
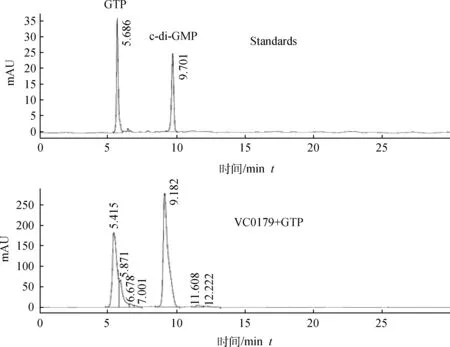
图4 高效液相色谱Fig.4 Chromatograms of high performance liquid chromatography
4 结 论
成功构建VC0179丙酸诱导型原核表达载体,并建立获得有活性VC0179重组蛋白的方法。c-di-GMP的体外合成为后续c-di-GMP功能研究奠定基础。
[1] DAVIES B W,BOGARD R W,YOUNG T S,et al.Coordinated regulation of accessory genetic elements produces cyclic di-nucleotides for V.cholerae virulence[J].Cell,2012,149(2):358-370.
[2] TAMAYO R,PRATT J T,CAMILLI A.Roles of cyclic diguanylate in the regulation of bacterial pathogenesis[J].AnnuRevMicrobiol,2007,61:131-148.
[3] ALONI Y,COHEN R,BENZIMAN M,et al.Solubilization of the UDP-glucose:1,4- beta-D-glucan 4-beta-D-glucosyltransferase(cellulose synthase) from Acetobacter xylinum.A comparison of regulatory properties with those of the membrane-bound form of the enzyme[J].JBiolChem,1983,258(7):4419-4423.
[4] ALONI Y,DELMER D P,BENZIMAN M.Achievement of high rates ofinvitrosynthesis of 1,4-beta-D-glucan:activation by cooperative interaction of the Acetobacter xylinum enzyme system with GTP,polyethylene glycol,and a protein factor[J].ProcNatlAcadSciUSA,1982,79(21):6448-6452.
[5] JENAL U,MALONE J.Mechanisms of cyclic-di-GMP signaling in bacteria[J].AnnuRevGenet,2006,40:385-407.
[6] HENGGE R.Principles of c-di-GMP signalling in bacteria[J].NatRevMicrobiol,2009,7(4):263-273.
[7] SUN L,WU J,DU F,et al.Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway[J].Science,2013,339(6121):786-791.
[8] BURDETTE D L,MONROE K M,SOTELO-TROHA K,et al.STING is a direct innate immune sensor of cyclic di-GMP[J].Nature,2011,478(7370):515-518.
[9] WU J,SUN L,CHEN X,et al.Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA[J].Science,2013,339(6121):826-830.
[10] ISHII K J,CHOON K T.Biological DNA sensor:The Impact of Nucleic Acids on Diseases and Vaccinology[C].Waltham:Elsevier,2014:33.
[11] PARVATIYAR K,ZHANG Z,TELES R M,et al.The helicase DDX41 recognizes the bacterial secondary messengers cyclic di-GMP and cyclic di-AMP to activate a type I interferon immune response[J].NatImmunol,2012,13(12):1155-1161.
[12] CHEN W,KUOLEE R,YAN H.The potential of 3′,5′-cyclic diguanylic acid(c-di-GMP) as an effective vaccine adjuvant[J].Vaccine,2010,28(18):3080-3085.
[13] PEDERSEN G K,EBENSEN T,GJERAKER I H,et al.Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP[J].PLoSOne,2011,6(11):e26973.
(编辑 白永平)
Prokaryotic Expression and Activity Analysis of DncV fromVibrioCholera
HAN Ying-qian,KONG Jiang-nan,WANG Jiang,ZHANG Chao,YANG Guo-yu*
(KeyLaboratoryofAnimalBiochemistryandNutrition,MinistryofAgriculture,HenanAgriculturalUniversity,Zhengzhou450002,China)
DncV(VC0179) is the member of a new family of di-nucleotide cyclases inVibriocholeraand it can catalyzes the synthesis of c-di-AMP,c-di-GMP and c-GAMP.c-di-GMP serves as the second messenger molecule to activate the innate immunity through STING signaling pathway.To generate c-di-GMP in vitro and further investigate its functions,we constructed the propionate-inducible VC0179 prokaryotic expression plasmid fused with cherry-Tag.The recombinant plasmid was transformed intoE.coilBL21(DE3) and induced by propionate.The expression of recombinant protein was observed by red color.SDS-PAGE analysis was used to identify the soluble expression of recombinant protein after ultrasonic decomposition.Moreover,c-di-GMP was enzymatically synthesizedinvitrowith the recombinant protein purified by Ni-NTA purification system and detected by high performance liquid chromatography.We successfully constructed the propionate-inducible VC0179 prokaryotic expression plasmid and acquired the high quality fusion protein,which could catalyze the synthesis of c-di-GMPinvitroby a one-step process.These results suggested that we established a method to generate enzymatically active VC0179 recombinant protein.The synthesis of c-di-GMPinvitrocould facilitate the functional study and high volume production of c-di-GMP.
VC0179;c-di-GMP;prokaryotic expression;enzymatic synthesis;high performance liquid chromatography
10.11843/j.issn.0366-6964.2015.05.026
2014-09-09
农业部948重点计划(2011-G35);河南省重点科技攻关(112102310705)
韩莹倩(1990-),女,蒙古族,内蒙古呼伦贝尔人,硕士生,主要从事动物生物技术研究,E-mail:twgjl@163.com
*通信作者:杨国宇,教授,博士生导师,E-mail:haubiochem@163.com
S852.61
A
0366-6964(2015)05-0868-05

