一株重组鸡传染性支气管炎病毒的分离及结构蛋白基因变异和血清型分析
吴翠兰,何怡宁,李和鸣,孙新宽,谭渝才,韦天超,磨美兰,韦 平
(广西大学动物科学技术学院,南宁 530005)
一株重组鸡传染性支气管炎病毒的分离及结构蛋白基因变异和血清型分析
吴翠兰,何怡宁,李和鸣,孙新宽,谭渝才,韦天超,磨美兰*,韦 平*
(广西大学动物科学技术学院,南宁 530005)
为进一步了解鸡传染性支气管炎病毒(IBV)流行株的遗传变异情况,对2013年从免疫失败的广西某鸡场中分离到的一株IBV(GX-NN130048)进行S1、E、M和N基因的扩增、测序、相似性比较、系统进化树绘制和重组分析以及血清型鉴定。基因序列分析结果表明,分离株GX-NN130048的S蛋白裂解位点序列为RRSRR,S1、E、M和N基因与参考株核苷酸相似性分别在60.8%~90.1%、81.0%~94.2%、86.1%~93.8%和86.0%~93.3%;进化树分析显示,分离株GX-NN130048的S1基因与疫苗毒株4/91同属一群,而E、M和N基因则与毒株LX4属于同一群;重组分析显示,分离株GX-NN130048的S1基因来源于疫苗毒株4/91和GX-HC1006野毒株(LX4型)的重组;血清型分析表明,该分离株的血清型不同于疫苗株H120和4/91。研究表明分离株GX-NN130048是一株重组毒株,其结构基因和血清型均发生变异。本研究再次提供证据说明,疫苗株4/91越来越多参与到IBV流行株通过基因重组导致的遗传变异事件当中,并可能由此导致新血清型的出现。这可能是现场免疫失败的一个主要原因。有必要继续加强对IBV的监测和新疫苗的研发。
传染性支气管炎病毒;重组;基因;血清型;变异
鸡传染性支气管炎(infectious bronchitis,IB)是由冠状病毒鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)引起鸡的一种急性高度接触性传染病[1]。IBV主要危害鸡的呼吸道和泌尿生殖道,引起鸡的气管啰音、打喷嚏、咳嗽、蛋鸡产蛋量和蛋品质的下降等[2- 3],给养鸡业造成较大的经济损失。
IBV为不分节段的单股正链RNA病毒[4-5],基因组全长27.6 kb,包含四种结构蛋白,即纤突(S)蛋白、小膜(E)蛋白、膜(M)蛋白和核衣壳(N)蛋白[6-8]。S蛋白可以裂解为S1、S2两个糖基化蛋白,其中,S1可产生病毒中和抗体和血凝抑制抗体以及交叉反应[9]。S2包含两个抗原决定因素,这可能影响S1的特定抗体结合位点[2,10]。E蛋白是病毒颗粒组装和释放所必需[2,6]。M蛋白是糖基化蛋白,与病毒RNA的合成、诱导白细胞产生α-干扰素有关[11-12]。N蛋白在病毒复制、组装、细胞免疫中起重要作用[1]。以往的研究通常只研究S1基因或部分结构基因[2],极少同时研究四种结构蛋白。同时研究S1、E、M、N这四种结构基因,可避免单基因分析可能造成的假象,更准确、科学分析IBV的遗传变异,有助于了解IBV的变异规律和分子机制。
尽管一直以来都广泛使用多种商品疫苗,但现场IB的问题仍不断出现[13-14],给养鸡企业带来了巨大的经济损失。这主要由于IBV基因组极易发生突变、缺失、插入和重组,导致多种基因型和血清型的产生。目前全世界已有30多种血清型,且不同血清型之间交叉保护效果差或者完全没有保护作用。不同国家、地区流行的IBV存在差异,因此及时掌握本地区现场流行毒株基因的变异乃至抗原性的变化,对该病的防控和疫苗的研发都非常重要。本研究对2013年从免疫失败的广西某鸡场的病鸡中分离得到的一株IBV分离株的S1、E、M和N基因进行序列分析,并与国内外的分离株和疫苗株进行相似性比较、进化树和重组分析以及血清型鉴定,旨在了解该分离株的基因和抗原变异情况,以便更全面阐述IBV变异规律和分子机制以及为新疫苗的研发提供依据。
1 材料与方法
1.1 病料来源
病料来源于广西某鸡场22 d龄病鸡的气管及肾。该鸡群发病率为50%,剖检病变主要为气管下端有黏液以及肾出现尿酸盐沉积等。该鸡群在7 d龄免疫过H120疫苗,13 d龄免疫过某肾型IBV疫苗。
1.2 试验鸡胚
SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;18~20 d龄健康鸡胚购于广西华桂源种鸡场。
1.3 主要试剂
Trizol、dNTP Mix、DL2000 DNA Marker、2×TaqPCR MasterMix和琼脂糖凝胶回收试剂盒均购自Tiangen公司;M-MLV购自Invitrogen公司;pMD18-T载体购自TaKaRa公司;DH5α感受态细胞由本课题组制备保存;DMEM培养基为GIBCO公司产品。
1.4 单因子血清
6种不同血清型的单因子血清:GX-YL5(血清1型)、GX-C(血清2型)、H120(血清3型)、GX-YL1(血清4型)、GX-NN7(血清5型)和GX-YL9(血清6型),由本课题组制备保存[15]。
1.5 引物设计
根据GenBank中已经发表的IBV序列,利用Oligo7软件设计4对特异性引物,具体引物信息见表1。
1.6 病毒增殖
无菌采取病变气管、肾等组织进行充分研磨,反复冻融3次之后,5 000 r·min-1离心5 min,取上清液用0.22 μm微孔滤器除菌后接种于9日龄SPF鸡胚尿囊腔,剂量为0.2 mL·枚-1,37 ℃培养48~96 h后,无菌收集鸡胚尿囊液。
表1 引物序列信息
Table 1 The information of primer sequences

引物Primer序列(5'→3')Sequence(5'→3')长度/bpLength基因片段ThefragmentofgeneS1-FGATTGTGCATGGTGGACAATG2137S1+部分S2 S1andpartialofS2S1-RGATTTGGACCTTATCCATACGE-FCCDCAAAATGCACCTAATG1486部分S2+3abc PartialofS2and3abcE-RCTWGTTGCATABCCATACTGM-FCGGAATTCAGTTTCCTAAGAACGGTTGGAA740部分E+M PartialofEandMM-RCCCAAGCTTCTCTACACGCACACATTTATN-FGAGGATCCATGGCAAGCGGTAAGG1495部分5ab+N Partialof5abandNN-RGACATTTCCCTGGCGATAGAC
1.7 病毒RNA的提取和基因的RT-PCR扩增
参照Trizol试剂盒说明方法抽提鸡胚尿囊的核酸RNA,并按照M-MLV说明书进行反转录。以反转录产物为模板,应用设计的4对特异引物进行PCR扩增。PCR反应体系为25 μL,包括2×TaqPCR MasterMix 12.5 μL,上游引物1 μL,下游引物1 μL,模板2 μL,ddH2O 8.5 μL。S1、E、M、N基因的扩增反应参数:95 ℃ 5 min;95 ℃ 40 s,56 ℃(52 ℃、52 ℃、52 ℃)50 s,72 ℃ 1 min30 s,共35个循环;72 ℃延伸10 min。
1.8 基因的克隆测序和分析
按常规方法纯化回收PCR产物,与pMD18-T连接,转化大肠杆菌DH5α感受态细胞,PCR鉴定后取3个阳性菌液送Invitrogen公司测序。应用MegAlign软件的Clustal W Method进行序列比对和相似性分析,应用MEGA5.10软件的Neighbor-joining method对分离株和包括常用疫苗株、国内分离株及国际上其他血清型的参考毒株[S1(45株)、E(43株)、M(45株)、N(45株)]基因核苷酸序列进行系统进化树分析,应用RDP4.33软件进行重组分析。
1.9 血清型鉴定
鸡胚气管环的制备与培养按照本实验室常规的方法[16];根据Reed-Muench法[17]计算分离株的鸡胚气管环半数感染量(TOC-ID50);然后采用固定病毒稀释各单因子血清的方法,根据TOC-ID50的结果在24孔板上进行血清中和试验[16]。
2 结 果
2.1 病毒的分离和鉴定
将发病鸡气管和肾处理上清液接种鸡胚96 h后无鸡胚死亡。对鸡胚尿囊液的核酸RNA进行RT-PCR鉴定,扩增得到片段与目的片段大小相符,测序结果表明为IBV,命名为GX-NN130048,其S1、E、M和N基因登录号分别为KJ999796、KM279002、KF975406和KJ940503。
2.2 分离株S1、E、M和N基因的扩增和序列测定
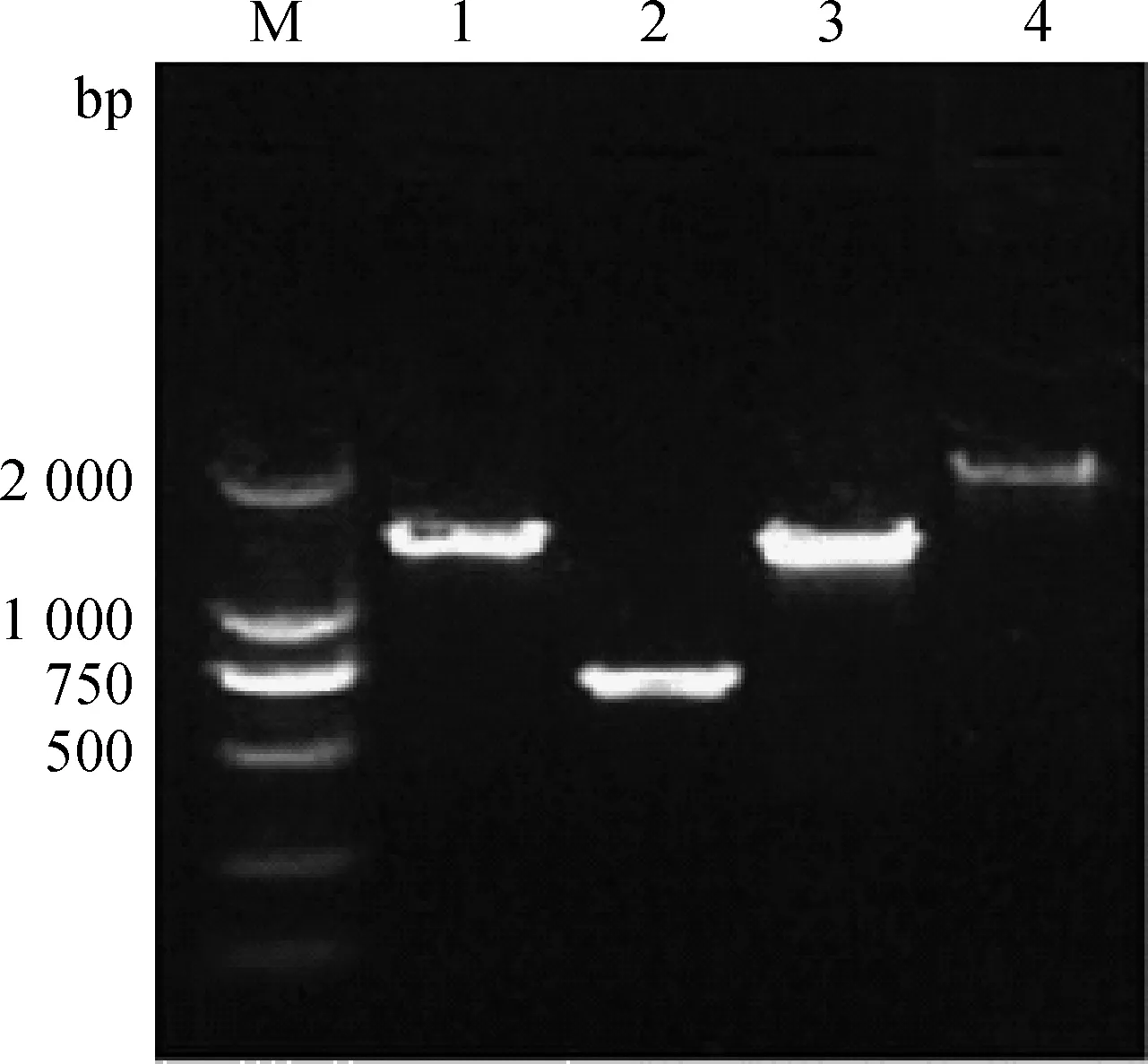
M.DL2000 DNA 相对分子质量标准 ;1~4.分别为4对引物RT-PCR扩增产物M.DL2000 DNA marker;1-4.Products of RT-PCR with 4 primer pairs,respectively图1 毒株GX-NN130048基因RT-PCR扩增电泳Fig.1 Electrophoresis of RT-PCR amplified products of GX-NN130048 isolate
以分离株GX-NN130048核酸RNA为模板,应用设计的4对特异引物对S1、E、M和N基因进行扩增,扩增片段大小分别为2 137、1 486、740和1 495 bp(图1),与预计大小相符。测序结果表明,IBV分离株的S1基因片段长为1 620 bp,编码由540个氨基酸残基组成的多肽,其裂解位点为RRSRR。E基因片段长为327 bp,编码由108个氨基酸残基组成的多肽。M基因片段长为678 bp,编码由225个氨基酸残基组成的多肽。N基因片段长为1 230 bp,编码由409个氨基酸残基组成的多肽。
2.3 基因序列的相似性比较
相似性分析结果表明,分离株GX-NN130048的S1、E、M和N基因与参考株的核苷酸相似性分别在60.8%~90.1%、81.0%~94.2%、86.1%~93.8%和86.0%~93.3%,遗传距离分别在10.6~55.0、6.1~22.0、6.5~15.5和7.1~15.5;推导氨基酸相似性分别在74.0%~88.3%(除与Delaware、Georgia分别为49.3%、48.9%外)、73.5%~94.5%、86.2%~96.9%(除与Gray株为65.9%外)和83.4%~95.6%,遗传距离分别在12.7~31.9(除与Delaware、Georgia分别为81.6、82.9外)、5.7~32.7、3.2~15.3(除与Gray株为45.3外)和4.5~18.8;与疫苗株H120、4/91的核苷酸相似性见表2。与现阶段占主导地位的流行株LX4的核苷酸相似性相比,除了S1(85.9%)基因外,其余基因均在90%以上。以H120为参考,该分离株的S1基因分别在24—25(N)、120—121(GS)处有3个氨基酸插入。
表2 分离株GX-NN130048结构基因与H120、4/91核苷酸相似性比较
Table 2 Nucleotide homology comparison of the structural genes of GX-NN130048 with H120 and 4/91

%
2.4 基因的进化树分析
基于分离株GX-NN130048和参考株的S1、E、M和N核苷酸序列的系统进化树(图2)显示,该分离株GX-NN130048的S1基因与4/91同属一群,且与4/91亲缘关系较近;其余基因均属于LX4型,但E基因及N基因与A2、CK/CH/LHLJ/95I、LDT3、partridge/GD/S14/2003、LX4等毒株亲缘关系较近,而M基因与LX4亲缘关系较近。
2.5 基因序列的重组分析
利用RDP4.33软件对分离株GX-NN130048的S1、E、M及N基因进行重组分析,结果发现分离株GX-NN130048的S1基因来源于疫苗株4/91和LX4型的分离株GX-HC1006之间的重组,重组区域为S1基因C-端部分(3—613 bp),见图3中左侧部分。其RDP、GENECONV、BootScan、MaxChi、Chimaera、SiScan、3Seq的P值分别为1.455×10-38、7.109×10-35、1.235×10-38、1.810×10-26、3.782×10-27、3.251×10-31、2.959×10-79。分离株GX-NN130048的S1基因的C-端和N-端分别与LX4型分离株GX-HC1006和疫苗株4/91具有很高的相似性,分别为99.6%和98.2%。
2.6 分离株的血清型分析
根据Reed-Muench法计算分离株GX-NN130048的TOC-ID50为10-4.5mL- 1,表明该分离株在TOC上生长良好。随即进行的中和试验的结果如表3。根据中和滴度相同或相差一个滴度即属于同一血清型的判断标准[15],分离株GX-NN130048与GX-YL5为同一个血清型,属于血清1型,与常用的疫苗株H120(血清3型)和4/91型(血清5型)[15]均属不同的血清型。
表3 分离株GX-NN130048中和试验结果
Table 3 The results of neutralization test of GX-NN130048 isolate

毒株Virus分离株与各抗血清血清的中和滴度NeutralizationtitersofvirusesagainsttheantiseraGX-YL5GX-CH120GX-YL1GX-NN7GX-YL9GX-NN1300481∶5121∶161∶1281∶641∶641∶32
3 讨 论
广西是全国养禽大省之一,尽管广泛使用疫苗,但近年来IB仍频繁发生,给广西养禽业造成较严重的经济损失。本研究中分离株GX-NN130048是从免疫过H120株和某肾型疫株苗疫苗的鸡群中分离到,说明了免疫的疫苗不能对流行毒株提供足够的保护。相似性分析结果显示,分离株GX-NN130048的S1、E、M和N基因与参考株核苷酸相似性分别在60.8%~90.1%、81.0%~94.2%、86.1%~93.8%和86.0%~93.3%,与疫苗株H120的S1、E、M和N基因核苷酸相似性分别为78.1%、86.2%、90.2%和87.8%,因此,4个结构蛋白基因与疫苗比较均出现明显的变异,其中S1基因变异程度最大,E基因其次。4个结构基因均发生变异在一定程度上解释了鸡群免疫失败的原因。
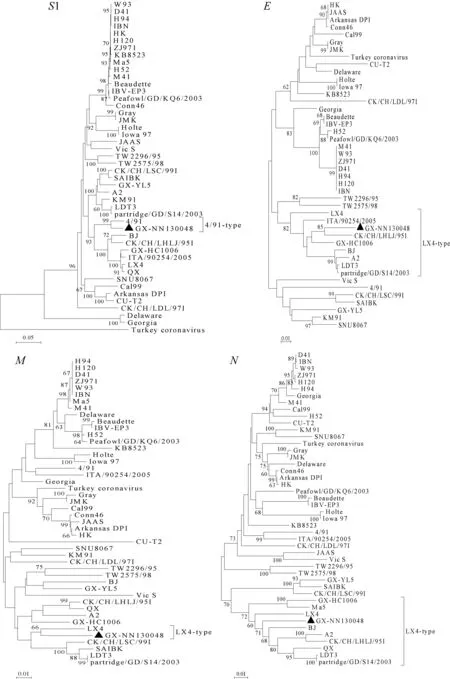
图2 分离株GX-NN130048与参考株的S1、E、M、N基因系统进化树Fig.2 Phylogenetic trees based on nucleotide sequence of S1,E,M and N genes of GX-NN130048 and IBV reference strains

图3 分离株GX-NN130048的RDP重组分析结果,左侧部分为潜在的重组区域Fig.3 RDP screenshots displaying the possible recombination event on GX-NN130048 isolate.The left area demarcates the potential recombination regions
为了更进一步了解分离株GX-NN130048的分子流行病学特征,本研究对其S1、E、M以及N基因分别绘制核苷酸系统进化树。进化树分析表明各结构基因在进化关系上并不平行,S1基因与4/91株为同一群,且与4/91亲缘关系较近;其余基因均属于LX4型,本研究还发现,除了S1基因与疫苗株4/91进化遗传距离较近些,E、M和N基因与常用疫苗株H120、4/91进化遗传距离稍远。由此可知,该分离株已发生变异且不同结构基因变异程度不同。目前我国流行的IBV 主要是LX4型病毒[18]。从20世纪80年代至2011年本课题组从广西共分离到近60株IBV毒株,基于S1基因构建进化树发现存在7个IBV基因型,其中1985-2008年的IBV分离株主要以CK/CH/LSC/99I型为主,2009—2011年主要以LX4型为主[19]。本研究中,根据S1基因的系统进化树,分离株GX-NN130048属于4/91型,不同于当前广泛流行的LX4型毒株,但其另外的三个结构基因均属于LX4型,表明该毒株可能发生了基因重组。因此,进行多个结构基因的分析避免了单基因分析造成的假象,进行多基因的分析是非常有必要的。
重组是IBV发生变异的另一重要机制[20]。通过对IBV重组的研究可以加深对IBV遗传多样性与进化机制的理解,从而更好地控制该病。重组可以发生在野毒株之间[21-22],或者在野毒株和疫苗株之间[23-24]。现阶段,我国流行的IB病例50%以上是LX4型的病毒引起[25],4/91活疫苗也被养殖场广泛地使用。本研究中,重组软件分析结果表明分离株GX-NN130048的S1基因来自LX4型分离株GX-HC1006和疫苗株4/91的重组。本课题组曾发现2006-2007年的5个广西分离株为疫苗株4/91与CK/CH/LSC/99I基因型野毒株的重组株,而CK/CH/LSC/99I基因型正是2006—2007年广西流行野毒株的主要型[26]。国内其他研究团队也发现了涉及疫苗株4/91的重组株[24,26-27],并且重组株毒力增强[27- 28]。因此,随着4/91株活疫苗的应用,该毒株越来越多地参与IBV流行毒株的重组,导致新毒株(包括新基因型和新血清型)的出现,甚至引起毒力增强。4/91活疫苗虽对免疫鸡群产生一定的保护作用,但使用过4/91疫苗的鸡场对该疫苗产生“依赖”作用[29]。此外,另外一个值得思考的问题是,在我们对现场连续多年的跟踪研究证明,4/91型毒株的分离比例比较低(10.5%,6/57)[19]。因此,4/91活疫苗是否有必要作为常规疫苗频繁使用值得思考。
血清型是衡量毒株保护性抗原以及免疫保护最直接的方法,是选择合适疫苗及研发新型疫苗的根据,对疫病控制非常重要。因此,本研究进一步对分离株GX-NN130048进行了血清型鉴定,结果表明,分离株GX-NN130048属于血清1型,与常用疫苗株H120(血清3型)和4/91(血清5型)[15]不属于同一个血清型。根据本研究的分析结果,分离株GX-NN130048可能是由疫苗株4/91和GX-HC1006野毒株重组而来。本课题组前期的研究表明GX-HC1006分离株属于血清5型[30],疫苗株4/91也属于血清5型[15],分离株GX-NN130048属于血清1型,可能的解释是S1基因的重组区域改变了抗原决定簇区域的关键位点,因为大部分的保护性抗原表位位于S1基因C端的1/4区域和3/4区域中[2,10]。本课题组前期对1985—2011年的50多株IBV的血清型进行研究,发现广西IBV分属于7个不同的血清型而且不同时期各血清型所占比例也不同,现阶段优势血清型为1、2、3型(三者所占比例总和达到70%以上)[31-32]。本研究结果再次提供证据表明,研制包括血清型1、2、3型的IBV多价灭活油苗对广西IB的防控具有重要的现实意义。
IBV整个基因组均可发生重组,最容易发生重组的是IBV的nsp 2(non-structural proteins)、nsp3、nsp16和S蛋白基因,重组断点(breakpoints)在S基因的附近或S基因内部可能会导致新血清型或新冠状病毒的出现[33]。本研究中分离株GX-NN130048的重组断点在S基因内部,其血清型已发生改变,除了S1基因外,其他非结构基因是否存在重组,有必要对全基因序列进行测序。同时,重组可能导致IBV毒力的增强[27-28],有必要对该毒株的致病性、免疫原性等生物学特性进一步研究。
4 结 论
IBV分离株GX-NN130048是来源于LX4型野毒株与疫苗株4/91的重组株,分离株的4个结构基因和血清型均发生变异,而且其血清型也与常用疫苗株的不同。研究结果说明流行株的变异是引起免疫失败的主要原因,同时说明疫苗株4/91越来越多地参与IBV流行株的遗传变异并可能导致新血清型的出现,值得注意这一问题,而且有必要加强对IBV的监测和新疫苗的研发。
[1] 苏敬良,高 福,索 勋,译.禽病学[M].12版.北京:中国农业出版社,2012:108-130. SU J L,GAO F,SUO X,the main translation.Diseases of poultry[M].12thedition. Beijing:China Agriculture Press,2012:108-130.(in Chinese)
[2] MO M L,HONG S M,KWON H J,et al.Genetic diversity of spike,3a,3b andEgenes of infectious bronchitis viruses and emergence of new recombinants in Korea[J].Viruses,2013,5(2):550-567.
[3] CAVANAGH D.Severe acute respiratory syndrome vaccine development:Experiences of vaccination against avian infectious bronchitis coronavirus[J].AvianPathol,2003,32(6):567-582.
[4] SELIM K,ARAFA A S,HUSSEIN A H,et al.Molecular characterization of infectious bronchitis viruses isolated from broiler and layer chicken farms in Egypt during 2012[J].IntJVSciMed,2013,1(1):102-108.
[5] 孙 裴,施 雷,魏建忠,等.鸡传染性支气管炎病毒感染的分子机制[J].动物医学进展,2013,34(12):199-203. SUN P,SHI L,WEI J Z,et al.Advance in molecular mechanism of infectious bronchitis virus infection[J].ProgressinVeterinaryMedicine,2013,34(12):199-203.(in Chinese)
[6] LIU X L,SU J L,ZHAO J X,et al.Complete genome sequence analysis of a predominant infectious bronchitis virus(IBV) strain in China[J].VirusGenes,2009,38(1):56-65.
[7] 肖朝庭,时 莉,宋翥远,等.传染性支气管炎病毒疫苗株H52的全基因组克隆与分析[J].中国动物传染病学报,2009,17(2):17-23. XIAO C T,SHI L,SONG Z Y,et al.Cloning and sequence analysis of the complete genome of infectious bronchitis virus vaccine strain H52[J].ChineseJournalofAnimalInfectiousDiseases,2009,17(2):17-23.(in Chinese)
[8] KUO S M,KAO H W,HOU M H,et al.Evolution of infectious bronchitis virus in Taiwan:Positively selected sites in the nucleocapsid protein and their effects on RNA-binding activity[J].VetMicrobiol,2013,162(2-4):408-418.
[9] JIA W,KARACA K,PARRISH C R,et al.A novel variant of avian infectious bronchitis virus resulting from recombination among three different strains[J].ArchVirol,1995,140(2):259-271.
[10] CAVANAGH D,DAVIS P J,COOK J K,et al.Location of the amino acid differences in the S1 spike glycoprotein subunit of closely related serotypes of infectious bronchitis virus[J].AvianPathol,1992,21(1):33-43.
[11] 磨美兰,李 孟,韦 平,等.鸡传染性支气管炎病毒广西流行株3种主要结构蛋白基因的遗传变异分析[J].畜牧兽医学报,2010,41(9):1138-1146. MO M L,LI M,WEI P,et al.Genetic variations of main structural genes of infectious bronchitis virus strains isolated in Guangxi province of China[J].ActaVeterinariaetZootechnicaSinica,2010,41(9):1138-1146.(in Chinese)
[12] 胡北侠,杨少华,许传田,等.2008-2012年山东省鸡传染性支气管炎病毒遗传演化分析和致病性研究[J].畜牧兽医学报,2014,45(5):795-801. HU B X,YANG S H,XU C T,et al.Phylogenetic analysis and pathogenicity infectious bronchitis virus isolated in Shangdong province during 2008-2012[J].ActaVeterinariaetZootechnicaSinica,2014,45(5):795-801.(in Chinese)
[13] 磨美兰,李 孟,韦正吉,等.广西1985年~2008年IBV分离株S1基因高变区I和N基因的序列和系统进化分析[J].中国预防兽医学报,2009,31(10):761-766. MO M L,LI M,WEI Z J,et al.Sequence and phylogenetic analysis of S1 gene hypervariable region I and N genes of infectious bronchitis viruses isolated in Guangxi province of China from 1985 to 2008[J].ChineseJournalofPreventiveVeterinaryMedicine,2009,31(10):761-766.(in Chinese)
[14] MO M L,HUANG B C,WEI P,et al.Complete genome sequences of two Chinese virulent avian coronavirus infectious bronchitis virus variants[J].JVirol, 2012,86(19):10903-10904.
[15] 王秀英,韦 平,陈秋英,等.鸡传染性支气管炎病毒广西分离株血清型的分析[J].中国兽医学报,2010,30(2):183-187. WANG X Y,WEI P,CHEN Q Y,et al.Serotyping of Guangxi isolates of infectious bronchitis virus[J].ChineseJournalofVeterinaryScience,2010,30(2):183-187.(in Chinese)
[16] 李康然,韦 平,梁梅芳,等.用气管环培养中和试验对鸡传染性支气管炎病毒进行血清定型[J].广西农院学报,1991,10(3):1-6. LI K R,WEI P,LIANG M F,et al.The serotyping of Guangxi isolates of avian infectious bronchitis virus by neutralization test in chicken tracheal cultures[J].JournalofGuangxiAgriculturalCollege,1991,10(3):1-6.(in Chinese)
[17] YU L,JIANG Y,LOW S,et al.Characterization of three infectious bronchitis virus isolates from China associated with proventriculus in vaccinated chickens[J].AvianDis,2001,45(2):416-424.
[18] HAN Z X,SUN C Y,YAN B,et al.A 15-year analysis of molecular epidemiology of avian infectious bronchitis coronavirus in China[J].InfectGenetEvol,2011,11(1):190-200.
[19] 磨美兰,李 孟,何 坤,等.近期广西鸡传染性支气管炎流行概况及防控措施[J].广西畜牧兽医,2013,29(2):67-70. MO M L,LI M,HE K,et al.The general situation and preventive measure of infectious bronchitis virus in Guangxi province recently[J].GuangxiJournalofAnimalHusbandry&VeterinaryMedicine,2013,29(2):67-70.(in Chinese)
[20] CAVANAGH D.Coronavirus avian infectious bronchitis virus[J].VetRes,2007,38(2):281-297.
[21] POHUANG T,CHANSIRIPORNCHAI N,TAWATSIN A,et al.Sequence analysis of S1 genes of infectious bronchitis virus isolated in Thailand during 2008-2009:Identification of natural recombination in the field isolates[J].VirusGenes,2011,43(2):254-260.
[22] MARDANI K,NOORMOHAMMADI A H,IGNJATOVIC J,et al.Naturally occurring recombination between distant strains of infectious bronchitis virus[J].ArchVirol,2010,155(10):1581-1586.
[23] OVCHINNIKOVA E V,BOCHKOV Y A,SHCHERBAKOVA L O,et al.Molecular characterization of infectious bronchitis virus isolates from Russia and neighbouring countries:Identification of intertypic recombination in the S1 gene[J].AvianPathol,2011,40(5):507-514.
[24] ZHANG Y,WANG H N,WANG T,et al.Complete genome sequence and recombination analysis of infectious bronchitis virus attenuated vaccine strain H120[J].VirusGenes,2010,41(3):377-388.
[25] LI M,MO M L,HUANG B C,et al.Continuous evolution of avian infectious bronchitis virus resulting in different variants co-circulating in Southern China[J].ArchVirol,2013,158(8):1783-1786.
[26] MO M L,LI M,HUANG B C,et al.Molecular characterization of major structural protein genes of avian coronavirus infectious bronchitis virus isolates in Southern China[J].Viruses,2013,5(12):3007-3020.
[27] LIU X L,MA H J,XU Q Q,et al.Characterization of a recombinant coronavirus infectious bronchitis virus with distinct S1 subunits of spike and nucleocapsid genes and a 3’untranslated region[J].VetMicrobiol,2013,162(2-4):429-436.
[28] 张小荣,程靖华,张建军,等.QX型与4/91型传染性支气管炎病毒毒株间的重组分析[C].中国畜牧兽医学会禽病学分会第十六次学术研讨会论文集,2012. ZHANG X R,CHENG J H,ZHANG J J,et al.Recombination analysis of infectious bronchitis virus between QX-type and 4/91-type[C].Poultry epidemiology branch of Chinese association of animal science and veterinary medicine on the 16thacademic conference proceedings,2012.(in Chinese)
[29] 刘胜旺.我国鸡传染性支气管炎流行现状及原因分析[J].中国家禽,2010,32(16):5-9. LIU S W.The current situation and analysis of causes of infectious bronchitis virus in China[J].ChinaPoultry,2010,32(16):5-9.(in Chinese)
[30] 孙 蓉.鸡传染性支气管炎病毒广西分离株血清型的鉴定及免疫原性的研究[D].南宁:广西大学,2012. SUN R.Serotype identification and immunogenicity of Guangxi isolates of avian infectious bronchitis virus[D]. Nanning:Guangxi University,2012.(in Chinese)
[31] 王秀英,李 孟,韦 平,等.鸡传染性支气管炎病毒广西分离毒株抗原相关性的研究[J].病毒学报,2012,28(6):621-627. WANG X Y,LI M,WEI P,et al.Evaluation of antigenic relationship of Guangxi isolates of infectious bronchitis virus[J].ChineseJournalofVirology,2012,28(6):621-627.(in Chinese)
[32] 秦丽莉,李 孟,孙 蓉,等.广西2009~2011年鸡传染性支气管炎病毒分离株的基因分型及血清分型[J].病毒学报,2014,30(2):162-170. QIN L L,LI M,SUN R,et al.Genotypes and serotypes of avian infectious bronchitis viruses isolated during 2009-2012 in Guangxi,China[J].ChineseJournalofVirology,2014,30(2):162-170.(in Chinese)
[33] THOR S W,HILT D A,KISSINGER J C,et al.Recombination in avian gamma-coronavirus infectious bronchitis virus[J].Viruses,2011,3(9):1777-1799.
(编辑 白永平)
Isolation and Analysis of Structural Protein Genes Variation and Serotype of a Recombinant Strain of Chicken Infectious Bronchitis Virus
WU Cui-lan,HE Yi-ning,LI He-ming,SUN Xin-kuan,TAN Yu-cai,WEI Tian-chao,MO Mei-lan*,WEI Ping*
(CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning530005,China)
In order to further understand the genetic variation of circulating infectious bronchitis virus(IBV),S1,E,MandNgenes of an IBV strain(GX-NN130048),which was isolated from chickens with immunoprophylaxis defeat in Guangxi,were amplified by reverse transcriptase polymerase chain reaction(RT-PCR),and then cloned,sequenced,and similarity comparison,phylogenetic tree,recombination and serotype analysis were conducted.The results showed that the gene sequence of cleavage site within S protein of GX-NN130048 was RRSRR.The nucleotide similarities ofS1,E,MandNgenes with those of other reference strains were 60.8%-90.1%,81.0%-94.2%,86.1%-93.8% and 86.0%-93.3%,respectively.According to the phylogenetic tree analysis,it was clustered into 4/91-type based onS1 gene,while itsE,MandNgenes belonged to LX4-type.Recombination event was detected inS1 gene,which was a recombinant between vaccine strain 4/91 and isolate GX-HC1006(LX4-type).The serotype analysis revealed that the serotype of GX-NN130048 was different from vaccine strains H120 and 4/91.The results indicated that isolate GX-NN130048 was a recombinant strain and variation existed both in structural genes and serotype.Our results also provide the evidence that the vaccine strain 4/91 has been increasingly involved in genetic variation of IBV epidemic strains,which may lead to the emergence of new serotype,and that may be one of the main causes of vaccine break in the field.Therefore,it is necessary to strengthen the monitoring of IBV field isolates and development of new vaccines.
infectious bronchitis virus;recombination;genes;serotype;variation
10.11843/j.issn.0366-6964.2015.05.018
2014-09-10
国家自然科学基金项目(31360611;31160516);广西自然科学基金项目(2014GXNSFDA118011;2013GXNSFCA019010)
吴翠兰(1988-),女,苗族,湖南凤凰人,硕士生,主要从事禽病与病原分子生物研究,E-mail:cuilanwu@163.com
*通信作者:磨美兰,E-mail:momeilan@163.com;韦 平,E-mail:pingwei8@126.com
S852.659.6
A
0366-6964(2015)05-0815-09

