猪圆环病毒2型对小鼠淋巴细胞发育的抑制作用
吴 斌,肖 惠,胡 林,杨了寒,叶十一,何启盖,蔡双双,张淑君*
(1.华中农业大学动物科技学院动物遗传育种与繁殖教育部重点实验室,武汉 430070; 2.华中农业大学动物医学院农业微生物学国家重点实验室,武汉 430070;3.湖北三峡职业技术学院,宜昌 443000)
猪圆环病毒2型对小鼠淋巴细胞发育的抑制作用
吴 斌1,肖 惠1,胡 林1,杨了寒1,叶十一2,何启盖2,蔡双双3,张淑君1*
(1.华中农业大学动物科技学院动物遗传育种与繁殖教育部重点实验室,武汉 430070; 2.华中农业大学动物医学院农业微生物学国家重点实验室,武汉 430070;3.湖北三峡职业技术学院,宜昌 443000)
猪圆环病毒2型(PCV2)是引起仔猪断奶多系统衰竭综合征的病原微生物,该病毒可以降低免疫反应引起严重的免疫抑制,直接导致体内淋巴细胞的凋亡和耗竭。为研究PCV2对发育中淋巴细胞的影响,本文以小鼠为试验模型,用免疫荧光法统计骨髓、胸腺、脾CD3、CD19阳性淋巴细胞数,qPCR定量分析淋巴细胞发育相关基因转录水平,MTT法检测体外培养淋巴细胞增殖能力。结果表明:(1)PCV2造成感染早期小鼠外周血淋巴细胞不同程度减少,并抑制体外培养淋巴细胞的增殖;(2)PCV2导致骨髓和脾CD19阳性B淋巴细胞极显著降低(P<0.01),并抑制淋巴细胞发育相关基因的转录;(3)PCV2对发育中淋巴细胞的凋亡也有一定促进作用。因此,PCV2抑制早期淋巴细胞的发育和促进发育中淋巴细胞凋亡可能是导致体内淋巴细胞大量耗竭的原因之一。
PCV2;T淋巴细胞;B淋巴细胞;细胞发育
猪圆环病毒2型(porcine circovirus type 2,PCV2)是引起仔猪断奶后多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)的主要病原体[1],为单链DNA病毒,该病毒主要侵害免疫系统,对单核巨噬细胞具有极强的亲嗜性,导致淋巴结、脾、胸腺等不同程度的病变,引起淋巴细胞缺失和单核巨噬细胞浸润[2]。PCV2不仅引起严重的免疫抑制[3],降低宿主免疫功能,导致其他细菌或病毒继发感染,同时也可以导致宿主免疫细胞凋亡,T.Shibahara等发现PCV2可以直接导致B淋巴细胞的凋亡,引起明显的B淋巴细胞损耗和免疫系统的抑制[4];L.Darwich等发现在PMWS仔猪中PCV2会引起T淋巴细胞(主要是CD8+和CD4+/CD8+细胞)和B淋巴细胞极显著降低[5]。体内淋巴细胞是处在一个不断损耗和增殖补充的动态平衡中,仅仅是淋巴细胞的凋亡是不会造成仔猪体内大量淋巴细胞损耗的,L.Mandrioli等研究了PMWS病例中淋巴细胞的增殖和凋亡比率,结果发现导致淋巴细胞损耗最重要的原因应该是细胞分化增殖的减少,而不是淋巴细胞的凋亡[6]。
因此,推测PCV2可能通过抑制淋巴细胞在骨髓等免疫器官中的发育和成熟导致淋巴细胞减少,本试验采用间接免疫荧光法对CD3(T淋巴细胞表面的标志蛋白)、CD19(B淋巴细胞表面标志蛋白)阳性细胞计数,统计T淋巴细胞、B淋巴细胞在骨髓、胸腺、脾中的比例,并用qPCR法研究病毒对淋巴细胞发育、凋亡相关基因转录量的影响,以探讨PCV2对淋巴细胞发育成熟的影响,为解析PCV2的致病机制提供参考。
1 材料与方法
1.1 PCV2与实验动物
PCV2-WH株(PCV2-HBwh,GenBank No.FJ870967)由农业微生物学国家重点实验室提供,效价TCID50为105·mL-1,每只小鼠腹腔注射0.2 mL,7周龄SPF级昆明雌鼠购自湖北省实验动物研究中心。
1.2 主要试剂与仪器
PCR所需dNTP、Taq酶、Buffer、Marker等购自北京全式金生物技术有限公司。Trizol reagent 购自Invitrogen公司,反转录试剂盒购自Thermo Scientific公司。SYBR Supermix为BIO-RAD公司产品。MTT试剂盒购自谷歌生物科技有限公司。CD3、CD19兔抗小鼠抗体购自BIOSS公司。CY3和FITC标记羊抗兔二抗为博士德产品。病毒DNA提取试剂盒购自北京天根生物有限公司。淋巴细胞培养所用胎牛血清、PHA、双抗均购自Sigma公司。1640培养液为Thermo公司产品,小鼠淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司,小鼠IL-2购自PeperoTech公司。引物为武汉擎科生物技术有限公司合成。抗体稀释液、封闭血清、荧光抗淬灭封闭液和Triton-100PBS均购自碧云天生物技术有限公司。
BIO-RAD CFX96定量PCR仪。日本Nikon公司倒置荧光显微镜。NanoDrop2000分光光度计。美国BIO-RAD公司凝胶成像系统,血液生化自动分析仪。
1.3 动物分组及材料处理
将7周龄的SPF昆明雌鼠随机分为两组:感染组30只,对照组20只。感染组腹腔注射PCV2,分别在感染后第0、3、7、14、21、28天摘眼球采血,抗凝剂为Na2EDTA;对照组注射相同剂量的生理盐水,采集与感染组同期的血液(每个时间点感染组采血5只小鼠,对照组采血3只),采血后送华中农业大学兽医院用血液生化自动分析仪检测血常规。
病毒感染第14天分离感染组和对照组小鼠骨髓、胸腺、脾细胞。分离方法如下:骨髓细胞的分离采用1 mL注射器加生理盐水冲骨髓;胸腺和脾细胞分离,利用刀片将胸腺和脾彻底切碎后加入生理盐水混匀。
PCV2 DNA检测方法参考文献[7]。
1.4 免疫荧光计数法对胸腺脾骨髓CD3、CD19阳性细胞计数
各器官得到的细胞悬液取上清过80目筛网,用红细胞裂解液裂解红细胞后生理盐水洗一遍,2 000 r·min-1离心5 min 加入PBS重悬,调整细胞密度为105个·mL-1用于免疫荧光计数。间接免疫荧光步骤:取100 μL制好的细胞悬液滴在含有多聚赖氨酸的载玻片上,室温静置20 min,用4%多聚甲醛4 ℃固定10 min;加入0.2%Triton-100 PBS室温透膜15 min,PBS洗3遍,加入封闭血清封闭30 min;分别加入一抗(兔抗小鼠CD3或兔抗小鼠CD19,均1∶200稀释)4 ℃过夜,PBS洗3遍后分别加入CY3和FITC标记的二抗(羊抗兔IgG,均1∶200稀释),37 ℃避光孵育30 min,PBS洗3次洗去未结合的二抗;加入荧光抗淬灭封闭液封片,荧光显微镜下观察拍照。对CD3、CD19阳性细胞数量进行统计(手动排除部分弱阳性细胞),以DAPI染核标记总细胞数,感染组和对照组各选取6个视野,每个视野细胞数100~500,每组统计总细胞数大于1 000个,采用Image pro plus进行统计分析,计算CD3和CD19阳性细胞比例。
1.5 PCV2对体外培养淋巴细胞的抑制作用
SPF级昆明雌鼠断颈处死后在75%酒精中浸泡10 min,在无菌条件下取脾,利用灭菌的刀片彻底切碎脾组织后加入生理盐水,混匀后取上清加入到3 mL小鼠淋巴细胞分离液中,1 800 r·min-1离心15 min,吸取中间白色细胞层至另一离心管,加入10 mL细胞洗涤液洗一次后2 000 r·min-1离心5 min,白色沉淀即为淋巴细胞。将细胞沉淀加入到淋巴细胞培养基中,调整细胞密度为105个·mL-1左右,六孔板中每孔加入0.2 mL病毒液,对照组加入等量培养基,培养12、24、36 h后每孔加入50 μL MTT,孵育6 h后将所有液体和沉淀取出,离心后去除上清,加入溶液A(DMSO)100 μL,37 ℃放置20 min,等紫色结晶全部溶解后用分光光度计570 nm检测各孔吸光度。
吸光度值△OD=实测OD值—未加MTT的OD值
小鼠淋巴细胞培养基:1640培养基42 mL,胎牛血清5 mL,肝素1 mL,PHA终质量浓度50 μg·mL-1,双抗0.5 mL,IL-2终质量浓度20 ng·mL-1。
表1 定量PCR引物列表
Table 1 Primer list for qPCR
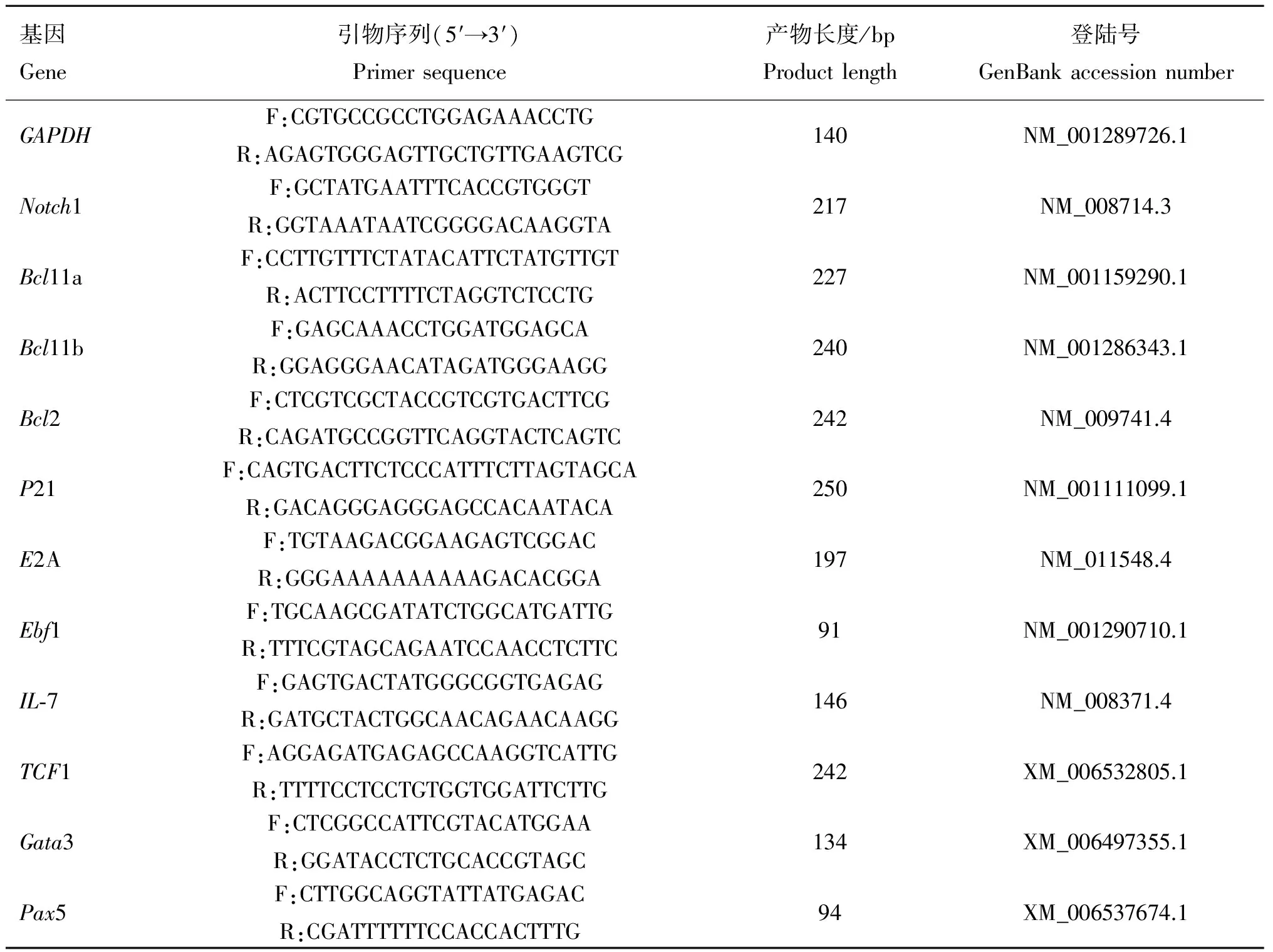
基因Gene引物序列(5′→3′)Primersequence产物长度/bpProductlength登陆号GenBankaccessionnumberGAPDHF:CGTGCCGCCTGGAGAAACCTGR:AGAGTGGGAGTTGCTGTTGAAGTCG140NM_001289726.1Notch1F:GCTATGAATTTCACCGTGGGTR:GGTAAATAATCGGGGACAAGGTA217NM_008714.3Bcl11aF:CCTTGTTTCTATACATTCTATGTTGTR:ACTTCCTTTTCTAGGTCTCCTG227NM_001159290.1Bcl11bF:GAGCAAACCTGGATGGAGCAR:GGAGGGAACATAGATGGGAAGG240NM_001286343.1Bcl2F:CTCGTCGCTACCGTCGTGACTTCGR:CAGATGCCGGTTCAGGTACTCAGTC242NM_009741.4P21F:CAGTGACTTCTCCCATTTCTTAGTAGCAR:GACAGGGAGGGAGCCACAATACA250NM_001111099.1E2AF:TGTAAGACGGAAGAGTCGGACR:GGGAAAAAAAAAAGACACGGA197NM_011548.4Ebf1F:TGCAAGCGATATCTGGCATGATTGR:TTTCGTAGCAGAATCCAACCTCTTC91NM_001290710.1IL⁃7F:GAGTGACTATGGGCGGTGAGAGR:GATGCTACTGGCAACAGAACAAGG146NM_008371.4TCF1F:AGGAGATGAGAGCCAAGGTCATTGR:TTTTCCTCCTGTGGTGGATTCTTG242XM_006532805.1Gata3F:CTCGGCCATTCGTACATGGAAR:GGATACCTCTGCACCGTAGC134XM_006497355.1Pax5F:CTTGGCAGGTATTATGAGACR:CGATTTTTTCCACCACTTTG94XM_006537674.1
1.6 PCV2对淋巴细胞发育相关基因的影响
昆明小鼠感染第14天分别取感染组和对照组小鼠的骨髓、胸腺、脾细胞(方法见1.4),加入0.8 mL TRIzol后混匀室温静置5 min,加入0.2 mL氯仿,振荡混匀室温放置5 min,4 ℃离心机中12 000 r·min-1离心15 min,吸取上层水相转入另一无RNA酶的管子中,在上层水相中加入0.5 mL异丙醇,混匀室温静置10 min后12 000 r·min-1离心10 min,弃掉上清,加入1 mL 无RNA酶的75%乙醇漂洗一次,4 ℃离心机中12 000 r·min-1离心5 min,弃掉上清,室温风干10 min,加入80 μL DEPC水溶解RNA。所得RNA 用1%琼脂糖凝胶跑胶检测后检测浓度,利用Thermo Scientific公司的反转录试剂盒合成cDNA后用于定量PCR,数据采用2-△△t方法进行分析处理,以GAPDH为内参基因进行校正。Primer5.0设计引物。
1.7 统计分析和数据处理
2 结 果
2.1PCV2对体外培养淋巴细胞增殖的影响
体外培养从脾分离的淋巴细胞,在PHA刺激下可以激活淋巴细胞形成细胞集落,结果显示加入0.2mLPCV2病毒液后可以显著抑制淋巴细胞集落的形成,没有形成细胞集落的迅速死亡(图1)。
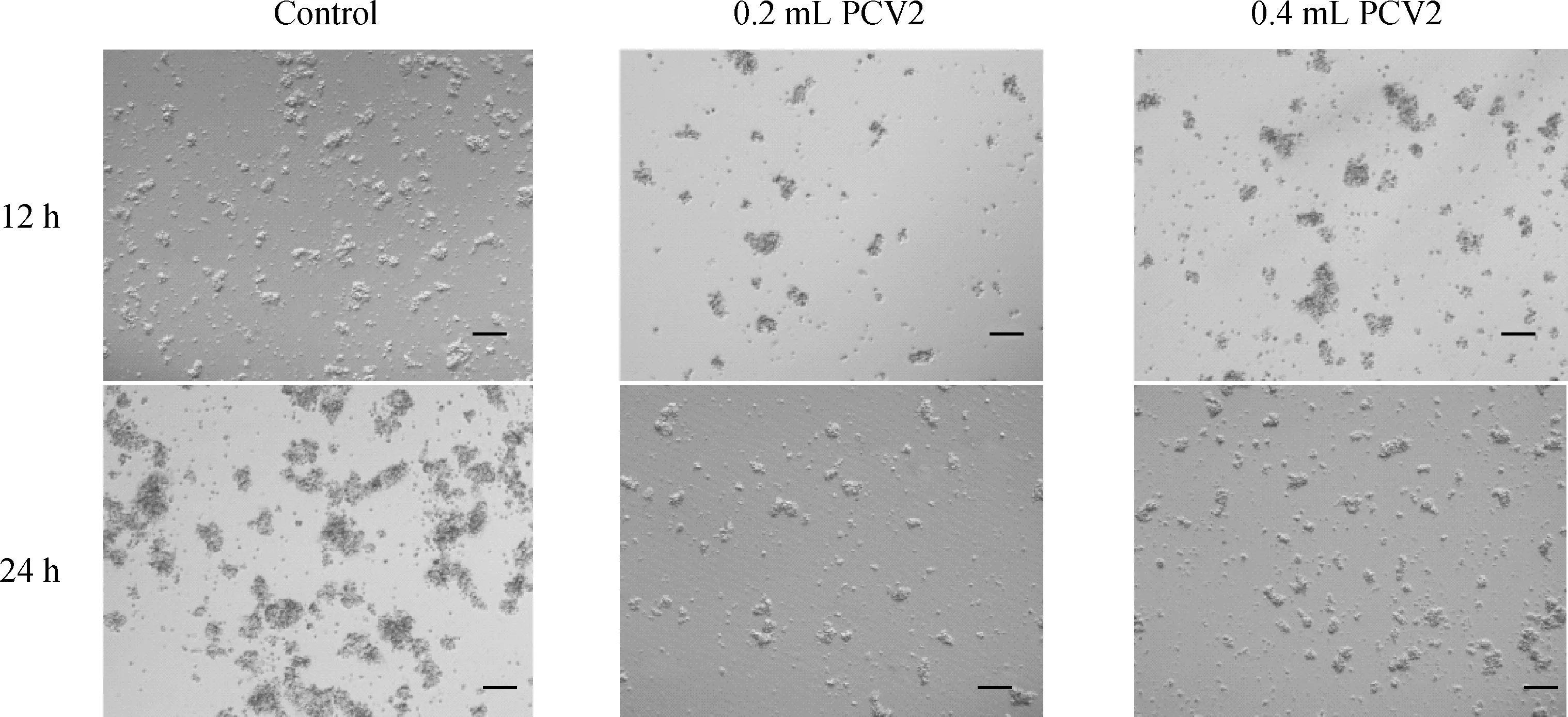
感染组淋巴细胞集落形成能力明显降低,未形成细胞集落的迅速死亡。Bar=100 μmPCV2 treated group,cell colony formation ability decrease significantly,lymphocyte did not form colony died quickly.Bar=100 μm图1 PCV2对体外培养淋巴细胞集落形成的抑制作用(200×)Fig.1 PCV2 inhibits formation of the lymphocyte colony in vitro (200×)
利用MTT法分析PCV2对体外培养淋巴细胞增殖的影响。MTT法检测表明感染PCV2后24、36 h感染组淋巴细胞增殖能力明显降低,PCV2抑制细胞增殖程度随着病毒量增加而有增加的趋势,且与对照组差异极显著(P<0.01),说明PCV2可以明显抑制体外培养淋巴细胞的增殖(图2)。
2.2 PCV2对外周血淋巴细胞及胸腺、脾、骨髓T淋巴细胞、B淋巴细胞细胞数量和比例的影响
在小鼠个体水平,分析PCV2对外周血淋巴细胞及胸腺、脾、骨髓CD3阳性T淋巴细胞、CD19阳性B淋巴细胞细胞数量和比例的影响。病毒感染后第14、28天在骨髓、胸腺、脾、淋巴结和外周血中都可以检测到病毒DNA(图3),说明小鼠已经成功感染PCV2,并且病毒在免疫器官中是广泛存在的,在第0天的未感染组没有检测到病毒。
对感染后不同时间点小鼠外周血淋巴细胞计数进行统计分析(图4),在感染后第3天和第14天试验组淋巴细胞数显著低于对照组(P<0.05),第14天以后淋巴细胞数有明显的回升,该现象说明PCV2可以引起小鼠淋巴细胞的损耗,但伤害不是持续性的,可能的原因是PCV2对小鼠的毒力较低,感染的后期小鼠可以逐渐恢复。
CD3是T淋巴细胞表面特异的分子标记,CD19是B淋巴细胞特异的分子标记,在淋巴细胞不断成熟过程中逐渐表达。B淋巴细胞主要是在骨髓中发育,在脾中逐渐成熟,T淋巴细胞主要是在胸腺的微环境中发育成熟[8]。用CY3标记的二抗检测CD3,FITC标记的二抗检测CD19,以DAPI染核标记总细胞数(图5)。结果显示感染第14天后骨髓和脾中的CD19阳性B淋巴细胞比例极显著降低(P<0.01),推测骨髓中的早期B淋巴细胞和脾中逐渐成熟的B淋巴细胞都受PCV2影响,病毒可能显著抑制B淋巴细胞的发育和成熟。
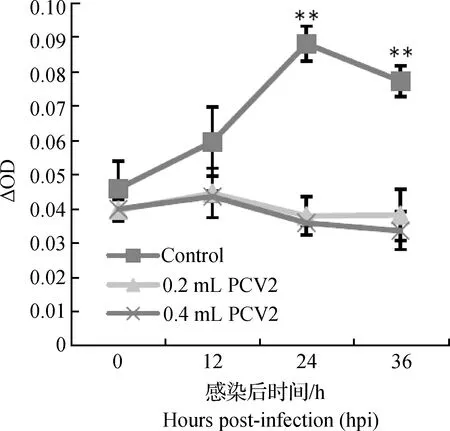
*表示对照组和感染组间差异显著(P<0.05)**表示组间差异极显著(P<0.01),误差线代表三次独立重复试验的标准差,以下图同“*” means significant difference between the PCV2 group and control group (P<0.05),“**” means extremely significant difference (P<0.01),error bars indicate standard deviation (s) for triplicate experiments,the following figures are the same图2 MTT法检测体外培养脾淋巴细胞增殖能力(n=3)Fig.2 MTT assay test the splenic lymphocyte proliferation ability in vitro (n=3)
然而,感染组小鼠骨髓中CD3阳性细胞数极显著上升(P<0.01),而对照组小鼠骨髓中的CD3阳性细胞数含量非常低(小于5%)。根据文献,早期发育的T淋巴细胞是不表达CD3分子的,在胸腺中逐渐成熟的T淋巴细胞才表达CD3分子[8]。感染病毒后骨髓中的CD3阳性T淋巴细胞比例显著上升可能是病毒进入骨髓后引起激活的T淋巴细胞在骨髓中大量聚集的结果。胸腺中的CD3阳性细胞比例没有显著变化,说明胸腺中的T淋巴数量没有受到病毒明显影响。
总之,PCV2可以造成早期B淋巴细胞极大损耗,严重影响B淋巴细胞的发育和成熟,对胸腺中成熟的T淋巴细胞数量没有明显影响。
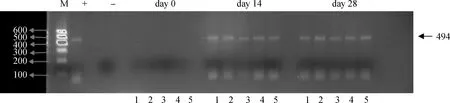
+.阳性对照;-.阴性对照;M.DNA相对分子质量标准;1.骨髓;2.胸腺;3.脾;4.淋巴结;5.外周血+.Positive control;-.Negative control;M.DNA ladder;1.Bone marrow;2.Thymus;3.Spleen;4.Lymph node;5.Peripheral blood图3 小鼠免疫器官中PCV2 DNA检测Fig.3 PCR detect the PCV2 DNA in immune organ
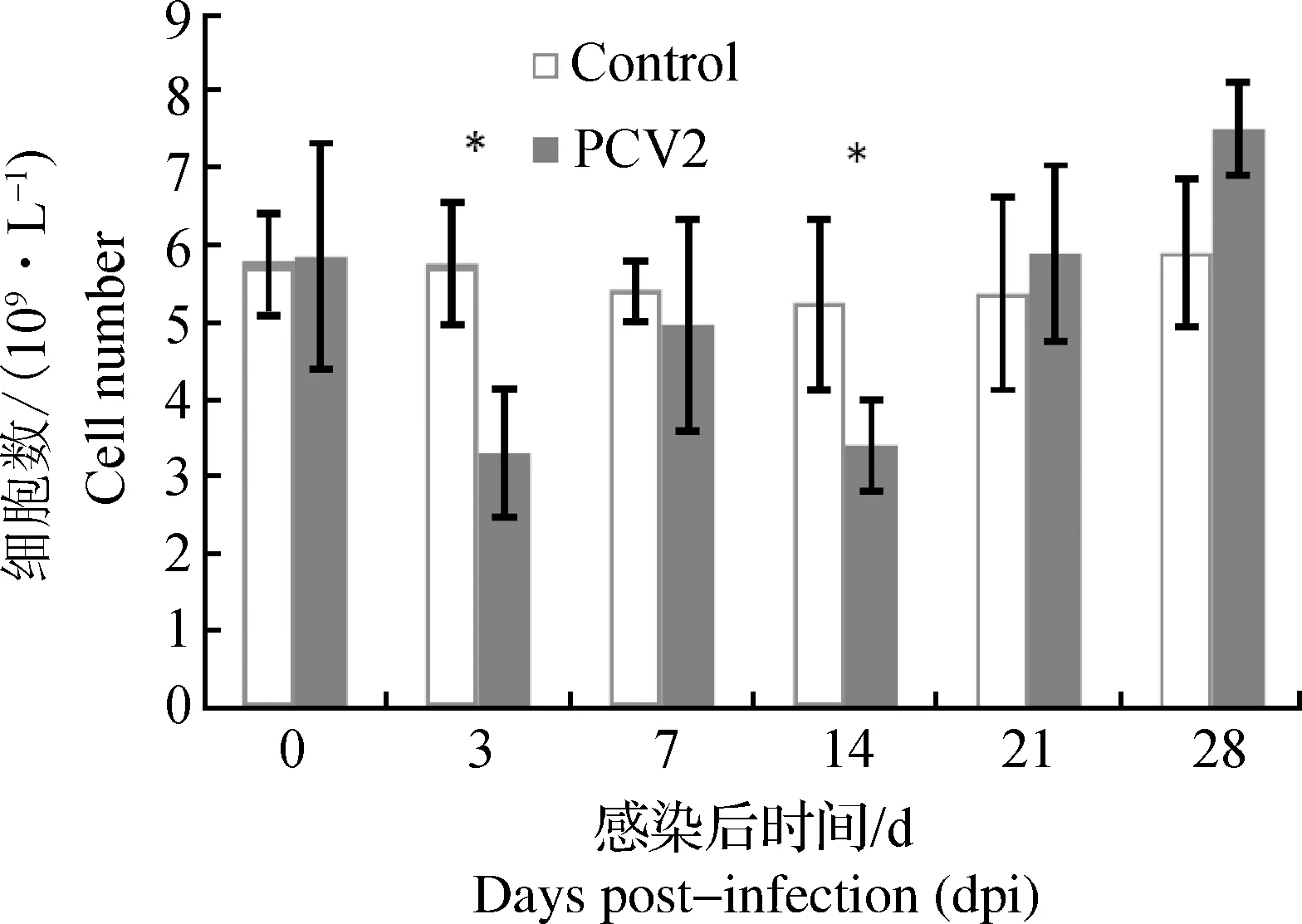
图4 昆明小鼠感染PCV2后外周血淋巴细胞计数(n≥3)Fig .4 The number of peripheral lymphocyte in Kunming mice after treated with PCV2 (n≥3)
2.3 PCV2对淋巴细胞发育和凋亡相关基因的影响
根据淋巴细胞在不同免疫器官的发育和成熟情况,对淋巴细胞发育、凋亡相关的重要基因转录水平进行定量分析(图6),从基因转录水平探讨PCV2对淋巴细胞发育、凋亡和增殖影响的作用机制。
结果显示,骨髓中大多数淋巴细胞发育相关基因都有显著变化,其中Notch1、Ebf1、E2A和Pax5基因转录量极显著降低(P<0.01),这些重要基因的转录量降低是对早期T淋巴细胞和B淋巴细胞的发育是非常不利的,而抗凋亡因子Bcl2转录量显著增加(P<0.05,图6)。
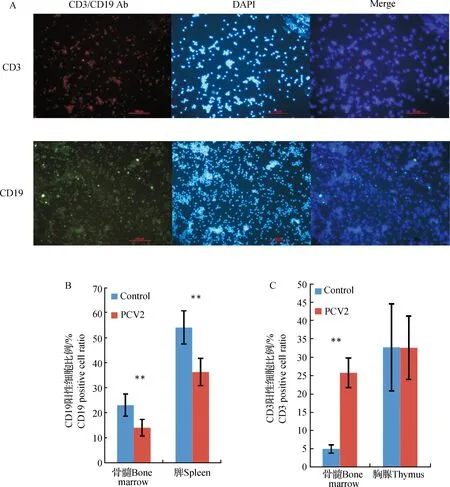
A.CD3、CD19免疫荧光结果(200×),兔抗小鼠CD3的一抗与CY3标记的羊抗兔二抗孵育,使CD3标记成红色,兔抗小鼠CD19的一抗与FITC标记的羊抗兔二抗孵育,使CD19标记成绿色,DAPI染核成蓝色,代表总细胞数,Bar=100 μm;B.PCV2对骨髓和脾中CD19阳性细胞比例的影响;C.PCV2对骨髓和胸腺中CD3阳性细胞比例的影响A.The result of CD3,CD19 immunofluorescence assay (200×).Rabbit anti-mouse CD3 IgG incubates with CY3-conjugated goat anti-rabbit IgG,CD3 appears to be red,Rabbit anti-mouse CD19 IgG incubates with FITC-conjugated goat anti-rabbit IgG,CD19 appears to be green,and Nucleus stained with DAPI appears to be blue,represent the total cell number.Bar=100 μm;B.The influence of PCV2 on the CD19 positive cell ratio in bone marrow and spleen;C.The influence of PCV2 on the CD3 positive cell ratio in bone marrow and thymus图5 间接免疫荧光法分析骨髓、胸腺和脾中CD3阳性T淋巴细胞、CD19阳性B淋巴细胞比例(n=3)Fig.5 Indirect immunofluorescence analyse CD3 positive T lymphocyte and CD19 positive B lymphocyte ratio in bone marrow,thymus and spleen (n=3)
胸腺中T淋巴细胞发育相关基因Tcf1、IL-7和Gata3的转录量都没有明显变化,周期蛋白P21转录量也没有变化。然而T淋巴细胞发育相关的两个关键因子Bcl11b和Notch1转录量显著降低(P<0.05或P<0.01,图6),这对T淋巴细胞在胸腺中成熟有负作用,说明PCV2对胸腺中逐渐成熟的T淋巴细胞有一定抑制作用。此外,胸腺中Bcl2转录量显著降低(P<0.05),这与很多文献报道PCV2引起外周免疫器官淋巴细胞凋亡相符合。
脾淋巴细胞发育相关基因Bcl11a和抗凋亡因子Bcl2转录量都极显著降低(P<0.01),周期蛋白P21转录量显著上升(P<0.05,参见图6),说明PCV2对脾中淋巴细胞有明显影响。
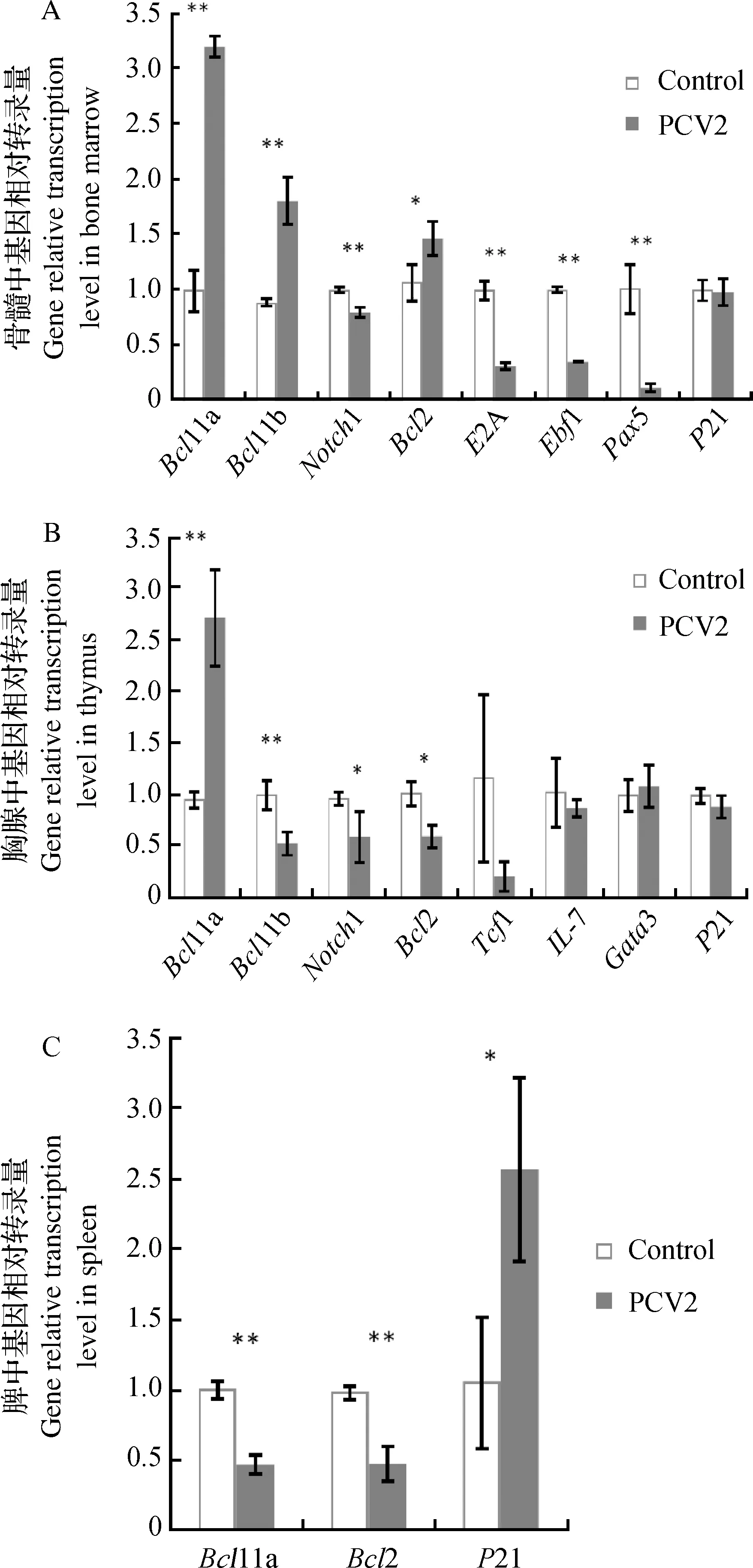
A.PCV2感染后骨髓中淋巴细胞发育相关基因转录量变化;B.PCV2感染后胸腺中淋巴细胞发育相关基因转录量变化;C.PCV2感染后脾中淋巴细胞发育相关基因转录量变化A The gene transcription level related with lymphocyte development after been treated with PCV2 in bone marrow;B The gene transcription level related with lymphocyte development after been treated with PCV2 in thymus;C The gene transcription level related with lymphocyte development after been treated with PCV2 in spleen图6 PCV2对淋巴细胞发育相关基因的影响(n=3)Fig.6 The influence of PCV2 on the gene expression involved in lymphocyte development (n=3)
3 讨 论
猪圆环病毒2型(PCV2)是仔猪断奶多系统衰竭综合征的主要病原,导致仔猪产生严重的免疫抑制,造成体内淋巴细胞的耗竭,严重影响仔猪健康。该病毒具体的致病机制还不十分清楚,对单核巨噬细胞的亲嗜性和引起淋巴细胞大量凋亡是导致宿主免疫力低下的重要原因。PCV2感染淋巴结中淋巴细胞导致淋巴细胞凋亡,并通过促进细胞凋亡和抑制细胞增殖导致淋巴小结中淋巴细胞的严重缺失[9],因此PCV2通过抑制细胞增殖和促进细胞凋亡引起淋巴细胞的损耗。然而L.Mandrioli等[6]研究了PMWS案例中的细胞凋亡和增殖情况,认为低下的细胞增殖能力是引起淋巴细胞耗竭的主要原因,而不是细胞的大量凋亡,因此有必要进一步探讨PCV2对早期淋巴细胞发育、成熟及凋亡的影响,为研究PCV2造成大量淋巴细胞耗竭的机制提供参考。
本研究证实PCV2能显著抑制淋巴细胞增殖,尤其对骨髓和脾中B淋巴细胞发育和增殖的抑制作用十分明显,在骨髓和脾中都可以明显降低CD19阳性B淋巴细胞比例,对早期B淋巴细胞发育、分化和增殖起重要作用的基因也有明显抑制作用。骨髓和脾中Notch1、Ebf1、E2A和Pax5等淋巴细胞发育相关基因转录量极显著降低(P<0.01),这些重要基因转录量降低对早期T淋巴细胞和B淋巴细胞发育都非常不利,其中E2A对早期B淋巴细胞发育是非常重要的[10],Ebf1是B淋巴细胞发育的一个决定性转录因子,具备激活B淋巴细胞发育程序和抑制其他种系细胞发育的功能[8,11],Pax5是维持B淋巴细胞属性和功能的关键基因[12],这些基因转录量显著降低说明早期B淋巴细胞发育受到显著抑制。此外,脾中抗凋亡因子Bcl2转录量显著降低,说明PCV2对B淋巴细胞凋亡也有一定促进作用。由此推测PCV2可能通过抑制早期B淋巴细胞发育、促进脾中B淋巴细胞凋亡而导致B淋巴细胞大量损耗。
本研究结果还表明,PCV2对胸腺中T淋巴细胞数量没有显著影响,但对T淋巴细胞发育成熟还是有一定抑制作用。骨髓和胸腺中的Notch1转录量都显著降低(P<0.05或P<0.01),而Notch信号是T细胞发育所必需的,Notch信号通过上调转录因子TCF-1的转录来启动T淋巴细胞发育程序[13],此外,Notch信号对保持T淋巴细胞特性也是非常重要的[14],骨髓和胸腺中Notch1转录量都显著降低说明PCV2对早期T淋巴细胞发育还是有很大影响。部分基因如Bcl11a、Bcl11b在骨髓和胸腺中转录量变化不一致,骨髓中的这两个基因转录量极显著上升(P<0.01),这与该基因的功能相关,这两个基因不只与淋巴细胞发育相关[15],同时也发挥一定抗病性[16]和周期调控作用。而骨髓中抗凋亡因子Bcl2转录量上升(P<0.05),推测PCV2并没有造成骨髓中细胞大量凋亡,胸腺中Bcl2转录量显著降低(P<0.05),说明PCV2对胸腺中淋巴细胞凋亡有促进作用。因此,PCV2对T淋巴细胞的发育和成熟还是有一定抑制作用。
此外,G.Sarli等认为造成淋巴组织的耗竭与低下的增殖活动有关,造成这种细胞增殖的降低是长期缺乏淋巴细胞正向生长因子的结果(主要是细胞因子)[17],很多文献也证实了PCV2可以改变干扰素和白细胞介素2等细胞因子的转录量,段滇宁等[18]的研究就发现PCV2可以通过激活NF-κB信号途径调节体外培养淋巴细胞IL-4和IL-12的分泌,细胞因子分泌异常必然会影响淋巴细胞的增殖、激活状况,因此,PCV2对淋巴细胞发育和增殖的抑制是通过很多不同途径发挥作用的。
4 结 论
PCV2引起免疫抑制,造成淋巴细胞损耗的机制复杂,一方面导致淋巴细胞大量凋亡,另一方面也抑制淋巴细胞的发育和增殖,降低免疫力。本文初步证实PCV2可能抑制淋巴细胞发育、促进淋巴细胞凋亡,尤其是对早期B淋巴细胞发育的抑制作用十分明显,这可能是PCV2导致淋巴细胞耗竭的原因之一。
[1] ALLAN G,MEEHAN B,TODD D,et al.Novel porcine circoviruses from pigs with wasting disease syndronmes[J].VetRec,1998,142(17):467-468.
[2] SEGALÉS J,DOMINGO M,CHIANINI F,et al.Immunosuppression in postweaning multisystemic wasting syndrome affected pigs[J].VetMicrobiol,2004,98(2):151-158.
[3] SEGALÉS J,MATEU E.Immunosuppression as a feature of postweaning multisystemic wasting syndrome[J].VetJ,2006,171(3):396-397.
[4] SHIBAHARA T,SATO K,ISHIKAWA Y,et al.Porcine circovirus induces B lymphocyte depletion in pigs with wasting disease syndrome[J].JVetMedSci, 2000,62(11):1125-1131.
[5] DARWICH L,SEGALÉS J,DOMINGO M,et al.Changes in CD4+,CD8+,CD4+,CD8+,and immunoglobulin M-positive peripheral blood mononuclear cells of postweaning multisystemic wasting syndrome-affected pigs and age-matched uninfected wasted and healthy pigs correlate with lesions and porcine circovirus type 2 load in lymphoid tissues[J].ClinDiagnLabImmunol,2002,9(2):236-242.
[6] MANDRIOLI L,SARLI G,PANARESE S,et al.Apoptosis and proliferative activity in lymph node reaction in postweaning multisystemic wasting syndrome (PMWS)[J].VetImmunolImmunopathol,2004,97(1-2):25-37.
[7] 李文涛,陈 品,郭海兵,等.猪圆环病毒2型的PCR检测[C].大连:中国畜牧兽医学会,2009. LI W T,CHEN P,GUO H B,et al.The PCR detection of porcine circovirus type2[C].Dalian:Chinese Association of Animal Science and Veterinary Medicine,2009.(in Chinese)
[8] 余 勇.转录因子Bcl11a调控早期淋巴细胞的发育与增殖[D].武汉:华中浓业大学,2012. YU Y.Transcription factor Bcl11a regulates Lymphocyte development and proliferation[D].Wuhan:Huazhong Agricultural University,2012.(in Chinese)
[9] 施旅娟,韩惠利,张书霞.PCV-2感染仔猪淋巴结中的病毒定位与细胞凋亡[J].中国农业科学,2008,41(1):237-242. SHI L J,HAN H L,ZHANG S X.Virus location and apoptosis in lymph nodes of piglets infected with PCV-2[J].ScientiaAgriculturaSinica,2008,41(1):237-242.(in Chinese)
[10] BAIN G,MAANDAG E C,IZON D J,et al.E2A proteins are required for proper B cell development and initiation of immunoglobulin gene rearrangements[J].Cell, 1994,79(5):885-892.
[11] ZHANG Z,COTTA C V,STEPHAN R P,et al.Enforced expression of EBF in hematopoietic stem cells restricts lymphopoiesis to the B cell lineage[J].EMBOJ, 2003,22(18):4759-4769.
[12] COBALEDA C,SCHEBESTA A,DELOGU A,et al.Pax5:the guardian of B cell identity and function[J].NatImmunol,2007,8(5):463-470.
[13] WEBER B N,CHI A W,CHAVEZ A,et al.A critical role for TCF-1 in T-lineage specification and differentiation[J].Nature,2011,476(7358):63-68.
[14] SCHMITT T M,CIOFANI M,PETRIE H T,et al.Maintenance of T cell specification and differentiation requires recurrent notch receptor-ligand interactions[J].JExpMed,2004,200(4):469-479.
[15] DURUM S K.Bcl11:sibling rivalry in lymphoid development[J].NatImmunol,2003,4(6):512-514.
[16] LE DOUCE V,COLIN L,REDEL L,et al.LSD1 cooperates with CTIP2 to promote HIV-1 transcriptional silencing[J].NucleicAcidsRes,2012,40(5):1904-1915.
[17] SARLI G,MANDRIOLI L,LAURENTI M,et al.Immunohistochemical characterisation of the lymph node reaction in pig post-weaning multisystemic wasting syndrome (PMWS)[J].VetImmunolImmunopathol,2001,83(1-2):53-67.
[18] 段滇宁,郭 华,李晓琳,等.PCV2通过激活NF-κB信号途径调节体外培养仔猪淋巴细胞IL-4和IL-12的分泌[J].南京农业大学学报,2014,37(3):93-99. DUAN D N,GUO H,LI X L,et al,Activation of NF-κB pathway is involved in secretion of IL-4and IL-12 in PCV2-infected piglet lymphocytesinvitro[J].JournalofNanjingAgriculturalUniversity,2014,37(3):93-99.(in Chinese)
(编辑 白永平)
The Study on the Inhibition of Mouse Lymphocyte Development Caused by Porcine Circovirus Type 2
WU Bin1,XIAO Hui1,HU Lin1,YANG Liao-han1,YE Shi-yi2,HE Qi-gai2, CAI Shuang-shuang3,ZHANG Shu-jun1*
(1.TheKeyLaboratoryofAnimalGenetics,BreedingandReproductionofEducationMinistry,CollegeofAnimalScienceandTechnology,HuazhongAgriculturalUniversity,Wuhan430070,China; 2.StateKeyLaboratoryofAgriculturalMicrobiology,CollegeofVeterinaryMedicine,HuazhongAgriculturalUniversity,Wuhan430070,China;3.HubeiThreeGorgesPolytechnic,Yichang443000,China)
Porcine circovirus type 2 (PCV2) is the pathogen of postweaning multisystemic wasting syndrome (PMWS),and can reduce immune reaction and cause serious immunosupression by causing the apoptosis and depletion of lymphocyte directly.To investigate the influence of PCV2 on the early development of lymphocyte,we used mice as experiment model,then selected immunofluorescence assay to detece the CD3,CD19 positive cell number in bone marrow,thymus and spleen,selected qPCR to quantify the gene expression involved in lymphocyte development,and selected MTT assay to test the lymphocyte proliferation abilityinvitro.The result showed that:1) PCV2 decreased of lymphocyte in peripheral blood during the early infection stage and inhibited the proliferation abilityinvitro;2) PCV2 decreased the number of CD19 positive cell significantly (P<0.01) in bone marrow and spleen,some important gene which are involved in the development of lymphocyte were inhibited significantly;and 3) PCV2 promoted the apoptosis of lymphocyte in development stage.Taken together,the results presented here demonstrate that PCV2 inhibits the development of lymphocyte and induces lymphocyte apoptosis may be one of the reasons causing lymphocyte depletion in PMWS case.
porcine circovirus type 2;T lymphocyte;B lymphocyte;cell development
10.11843/j.issn.0366-6964.2015.08.016
2014-10-31
国家自然科学基金(31272427);欧盟第七框架FP7项目(PIIF-GA-2012-328205)
吴 斌(1988- ),男,四川遂宁人,硕士生,主要从事动物抗病遗传育种研究,E-mail:wubinghao510902@163.com
*通信作者:张淑君,教授,E-mail:sjxiaogzhang@mail.hzau.edu.cn
S852.659.2
A
0366-6964(2015)08-1400-09

