山羊y+L碱性氨基酸转运系统转录水平表达的研究
周英昊,高 晔,刘林丽,曾 洁,杨雨鑫,张恩平*,陈玉林*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.榆林学院生命科学研究中心,榆林 719000; 3.西北农林科技大学生命科学学院,杨凌 712100)
山羊y+L碱性氨基酸转运系统转录水平表达的研究
周英昊1,高 晔2,刘林丽3,曾 洁1,杨雨鑫1,张恩平1*,陈玉林1*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.榆林学院生命科学研究中心,榆林 719000; 3.西北农林科技大学生命科学学院,杨凌 712100)
旨在研究山羊y+L碱性氨基酸转运系统中4F2hc、y+LAT1和y+LAT2 mRNA表达的组织特异性及其在不同年龄山羊小肠中的发育性表达规律。试验选取健康、体重相近的1日龄、6月龄、8月龄、10月龄、12月龄陕北白绒山羊各3只,共15只,屠宰后采集心、肝、肾、大脑、背最长肌、体侧皮肤、瘤胃、十二指肠、空肠、回肠和结肠组织,利用实时荧光定量PCR技术检测4F2hc、y+LAT1和y+LAT2 mRNA在1日龄山羊上述组织和全部山羊十二指肠、空肠和回肠的表达情况。结果表明,(1)4F2hc、y+LAT1和y+LAT2 mRNA在1日龄山羊多种组织中均有表达,且有一定的组织特异性。其中,4F2hcmRNA在皮肤表达量最高,y+LAT1 mRNA在回肠表达量最高,y+LAT2 mRNA在大脑和回肠表达量最高。(2)4F2hcmRNA在山羊十二指肠、空肠和回肠表达量均以1日龄山羊为最高,其他月龄山羊相同肠段之间表达量无显著差异(P>0.05);y+LAT1 mRNA在十二指肠、空肠和回肠表达量随山羊年龄的增加均呈现逐渐降低的趋势;y+LAT2 mRNA在十二指肠、空肠和回肠表达量随山羊年龄的增加呈现先升高后降低的趋势,其在10月龄山羊表达量最高;y+LAT2 mRNA在回肠表达量以1日龄山羊为最低,其他月龄山羊之间差异不显著(P>0.05)。结果说明,山羊y+L碱性氨基酸转运系统的主要转运部位为小肠;该系统中轻链y+LAT1和重链4F2hc构成的异二聚体转运蛋白可能发挥更为主要的转运作用;4F2hc和y+LAT2基因可能分别在山羊皮肤和大脑中发挥重要的生理功能;4F2hc、y+LAT1和y+LAT2基因在山羊小肠中受肠段和发育阶段的影响,具有不同的发育性表达规律。
山羊;y+L碱性氨基酸转运系统;实时荧光定量PCR;mRNA表达
动物对氨基酸的吸收和转运过程,是在多种氨基酸转运系统的参与下完成的。氨基酸转运系统按照其底物的不同,可以分为碱性、酸性和中性氨基酸转运系统,这些氨基酸转运系统共同担负着氨基酸在细胞膜上的跨膜运输功能[1]。y+L碱性氨基酸转运系统主要位于肠细胞和肾小管的基底,包含由y+L-型氨基酸转运载体1(y+L-type amino acid transporter 1,y+LAT1)和y+L-型氨基酸转运载体2(y+L-type amino acid transporter 2,y+LAT2)分别和细胞表面抗原4F2重链(4F2 heavy chain,4F2hc)共价结合构成的两个不同的异二聚体转运蛋白。y+L系统主要负责碱性氨基酸(赖氨酸、精氨酸、组氨酸等)的转运,其转运机制属于反向交换转运,即在Na+的协同作用下,在向细胞内转入中性氨基酸的同时,按1︰1的比例转出细胞中的碱性氨基酸[2]。除行使碱性氨基酸的转运功能外,4F2hc基因还可参与调控皮肤稳态[3];y+LAT1基因的多态性可能与神经胶质瘤以及赖氨酸尿性蛋白不耐症的发生相关[4-6];y+LAT2 基因的其他生理功能还未见报道。目前对氨基酸转运载体的研究主要集中在人、小鼠、猪、鸡和鱼类中,主要对其相应的氨基酸转运载体基因在mRNA水平上进行表达调控的研究,但是对反刍动物y+L碱性氨基酸转运系统的研究还相对较少,特别是山羊上的研究几乎未见报道。
山羊羊毛、羊绒、肌肉的生长和脂肪的沉积源于胃肠道对营养物质的消化和吸收过程。董晓玲等[7]研究表明,精氨酸和组氨酸是山羊生长发育常见的限制性氨基酸,说明碱性氨基酸的消化和吸收同山羊的生长性能密切相关。张年[8]研究表明,相同日粮组成下,麻城黑山羊及其杂交后代在0~12月龄体重变化呈“S”曲线,山羊体重拐点均在3.5~5 月龄,即各组山羊在达到拐点日龄前,体重呈现较快速度增加,6~12月龄山羊体重增加趋于平缓。由此可见,山羊的体重、器官的功能、营养物质的消化和利用率等在其体成熟前随生长发育都可能发生很大的变化,其中包括对氨基酸需求和利用率的差异,而y+L系统作为重要的碱性氨基酸转运系统,其转运能力因此可能存在时间和空间上的双重差异。有研究表明,小鼠b0,+AT和y+LAT1基因mRNA和蛋白质水平上的表达是一致的[9]。谭会泽等[10]认为,测定转运载体基因mRNA的表达丰度基本可以反映出其单个细胞转运载体蛋白的表达量,进一步可反映出其转运氨基酸的能力。因此,本试验选择y+L碱性氨基酸转运系统的4F2hc、y+LAT1和y+LAT2基因为研究对象,研究其在1日龄山羊多种组织和不同年龄山羊十二指肠、空肠和回肠中的mRNA表达情况,以探讨山羊y+L碱性氨基酸转运系统的主要转运成分、转运部位和相关基因的发育性表达规律,为进一步研究反刍动物肠道氨基酸吸收和转运机制以及根据山羊的生理特点,科学配制日粮提供一定的理论支持。
1 材料与方法
1.1 试验动物及样品采集
本试验所用山羊品种为陕北白绒山羊,选自榆林市陕北白绒山羊试验基地。选取健康、体重相近的1日龄(已吮奶)、6月龄、8月龄、10月龄、12月龄陕北白绒山羊各3只,共15只,颈动脉放血至死(宰前不禁食),采集其心、肝、肾、大脑、背最长肌、体侧皮肤、瘤胃、十二指肠、空肠、回肠、结肠相对固定位置的组织,用PBS 缓冲液冲洗干净,滤纸吸干,迅速放入 1.5 mL冻存管中,置液氮速冻,-80 ℃冷冻保存备用。
1.2 主要试剂和仪器
超纯RNA提取试剂盒Ultrapure RNA Kit(康为世纪公司),反转录试剂盒PrimeScriptTMRT Master Mix(TaKaRa公司),荧光染料SYBR®Premix Ex TaqTM Ⅱ(TaKaRa公司),实时荧光定量PCR仪(Bio-Rad IQ5),核酸浓度测定仪,高通量组织研磨仪,冷冻离心机。
1.3 样品总RNA的提取
采用超纯RNA提取试剂盒Ultrapure RNA Kit,按照操作手册提取所有组织样品总RNA。用核酸浓度测定仪测定RNA浓度及纯度,用1%的琼脂糖凝胶电泳检测RNA质量,-80 ℃保存备用。
1.4 cDNA第一条链的合成
取500 ng经检测的质量良好的山羊各组织总RNA,采用反转录试剂盒PrimeScriptTMRT Master Mix,按照操作说明进行反转录反应,产物于-20 ℃保存备用。
1.5 引物设计
以山羊β-actin管家基因为内参基因,从GenBank检索山羊4F2hc、y+LAT1、y+LAT2和β-actin基因的mRNA序列,用Primer Premier 5.0软件设计跨内含子的特异性引物(表1),由南京金斯瑞生物科技有限公司合成。
表1 实时荧光定量PCR引物序列
Table 1 Primer sequences for Real-time quantitative PCR

基因Gene基因登录号GenBankID引物序列(5′→3′)Primersequence产物长度/bpProductlengthβ⁃actin(ACTB)XM_005694067.1S:TGCGTGACATCAAGGAGAAGCA:GGATGCCACAGGACTCCATACCC1984F2hc(SLC3A2)XM_005699799.1S:TGGATGGGTTTCAGGTTCGGA:CAACAACAGGTCCTTGGTGGGT176y+LAT1(SLC7A7)XM_005685276.1S:TCATGGCGTTGATCTACTTGTGA:GAAGAACAGGCTGAGCTTGAGA161y+LAT2(SLC7A6)XM_005692175.1S:CAGTGATGCTGTGGCTGTGACA:TGAAGCGAAGATAGATGCGTTG118
S.上游引物;A.下游引物 S.Sense primer;A.Antisense primer
1.6 实时荧光定量PCR
采用荧光染料SYBR®Premix Ex TaqTMⅡ,以β-actin为内参基因,利用Bio-Rad iQ5实时荧光定量PCR仪对各待测cDNA样品中4F2hc、y+LAT1和y+LAT2基因mRNA的表达量进行测定,每个样品3个重复。实时荧光定量PCR反应体系为25 μL:2×SYBR®Premix Ex Taq II(内含TaKaRa Ex TaqHS,dNTP Mixture,Mg2+,Tli RNaseH,SYBR®Green I)12.5 μL,上下游引物(10 μmol·L-1)各1 μL,10倍稀释的cDNA模板2 μL,灭菌水8.5 μL。反应条件:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸45 s,45个循环;每个循环结束后采集荧光。全部反应结束后,进行熔解曲线分析,反应条件:55~95 ℃,每30 s升温0.5 ℃,循环数81,每个循环结束后采集荧光。
1.7 数据统计分析
所有样品用内参基因β-actin进行标准化校正后,采用2-△△Ct法计算4F2hcmRNA、y+LAT1 mRNA和y+LAT2 mRNA相对于β-actinmRNA的表达量。数据以“平均值±标准误(Mean±SE)”表示,n=3,用SPSS17.0统计软件进行单因子方差分析(one-way ANOVA),以Duncan法进行多重比较,P<0.05表示差异显著。
2 结 果
2.1 4F2hcmRNA在1日龄山羊的组织表达差异
图1显示,4F2hcmRNA在1日龄山羊多种组织中均有表达。其在皮肤表达量显著高于其他组织(P<0.05);除皮肤外,空肠表达量最高;肝、肾和回肠次之,相互之间差异不显著(P>0.05);其次为十二指肠、大脑和瘤胃,相互之间差异不显著(P>0.05);再次为肌肉和结肠,二者差异不显著(P>0.05);心表达量显著低于其他组织(P<0.05)。
2.2y+LAT1 mRNA在1日龄山羊的组织表达差异
图2显示,y+LAT1 mRNA在1日龄山羊多种组织中均有表达。其在小肠的表达量显著高于其他组织(P<0.05),小肠中回肠表达量最高,十二指肠和空肠次之,二者差异不显著(P>0.05);除小肠外,肝中表达量最高;肾、结肠、大脑、瘤胃和皮肤中表达量依次降低,相互之间差异不显著(P>0.05);所有组织中,心和肌肉表达量最低,二者差异不显著(P>0.05)。

各目的基因相对于β-actin基因表达量的统计结果,数据用“平均数±标准误”表示。图上标注字母不同者表示差异显著(P<0.05),Duncan法比较。n=3,下同Statistical results of mRNA relative abundance in target gene and β-actin gene.The datum are shown as “Mean±SE”.With different letters indicate significant difference (P<0.05,Duncan test).n=3.The below figures are same图1 山羊4F2hc mRNA在不同组织的表达Fig.1 The expression of 4F2hc mRNA in different tissues of goats

图2 山羊y+LAT1 mRNA在不同组织的表达Fig.2 The expression of y+LAT1 mRNA in different tissues of goats
2.3y+LAT2 mRNA在1日龄山羊的组织表达差异
图3显示,y+LAT2 mRNA在山羊多种组织中均有表达。其在大脑和回肠中表达量显著高于其他组织(P<0.05),二者差异不显著(P>0.05);皮肤和肾次之,二者差异不显著(P>0.05);其他组织表达量从高到低依次为结肠、空肠、十二指肠、瘤胃、心、肝和肌肉,相互之间差异不显著(P>0.05)。

图3 山羊y+LAT2 mRNA在不同组织的表达Fig.3 The expression of y+LAT2 mRNA in different tissues of goats
2.4 山羊4F2hcmRNA在小肠的发育性表达
图4显示,4F2hcmRNA在山羊十二指肠、空肠和回肠的发育性表达规律相似,4F2hcmRNA在各肠段表达量均以1日龄山羊为最高(P<0.05),其他月龄山羊相同肠段之间表达量无显著差异(P>0.05)。
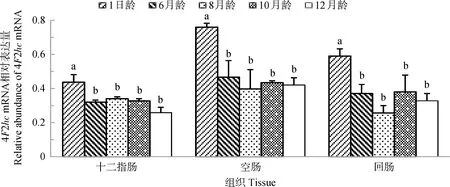
图4 4F2hc mRNA在不同年龄山羊小肠的表达Fig.4 The expression of 4F2hc mRNA in small intestine of goats at different ages
2.5 山羊y+LAT1 mRNA在小肠的发育性表达
图5显示,y+LAT1 mRNA在山羊十二指肠、空肠和回肠的发育性表达规律相似。y+LAT1 mRNA在各肠段表达量随着山羊年龄的增加均呈现逐渐降低的趋势。y+LAT1 mRNA在1日龄山羊十二指肠、空肠、回肠中表达量均为最高,在12月龄山羊十二指肠、空肠和回肠表达量均为最低。
2.6 山羊y+LAT2 mRNA在小肠的发育性表达
图6显示,y+LAT2 mRNA在山羊十二指肠、空肠和回肠发育性表达规律相似。y+LAT2 mRNA在小肠随着山羊年龄的增加均呈现先升高后降低的趋势,均以1日龄山羊的表达量最低,10月龄山羊的表达量最高,在十二指肠和空肠12月龄山羊表达量显著低于10月龄(P<0.05)。回肠y+LAT2 mRNA在1日龄山羊表达量最低,其他各月龄山羊表达量差异不显著(P>0.05)。
3 讨 论
3.1 山羊4F2hcmRNA的组织分布
有关山羊y+L碱性氨基酸转运系统内各基因表达的组织特异性研究至今未见报道。职爱民[11]研究发现,仔猪4F2hcmRNA在大脑、肝、肾、肌肉、肠道和心都有表达,而肠道表达最高,这与本研究的结果基本一致。本研究还发现,4F2hcmRNA在1日龄山羊皮肤组织中表达量显著高于其他组织(P<0.05),由此推测,4F2hc基因可能在幼龄动物皮肤组织中发挥重要的生理功能。E.Boulter等[3]研究称,4F2hc基因可参与调控皮肤内稳态、修复表皮创伤以及延缓皮肤衰老,其生理作用随动物年龄的增长而逐步减弱。S.Estrach等[12]发现,4F2hc基因的过表达可能导致皮肤癌症的发生,敲除该基因后可使已发生的肿瘤退化。M.S.Parmacek等[13]发现,成年鼠4F2hcmRNA在睾丸、大脑和肾中表达较高,在肌肉和肝等组织中表达较低,这与本研究的结果稍有出入,是否是由于物种差异导致的还不清楚。综合以上研究结果,推测4F2hc基因除主要在山羊小肠行使碱性氨基酸转运功能外,可能还在皮肤组织中发挥其他重要的生理功能。
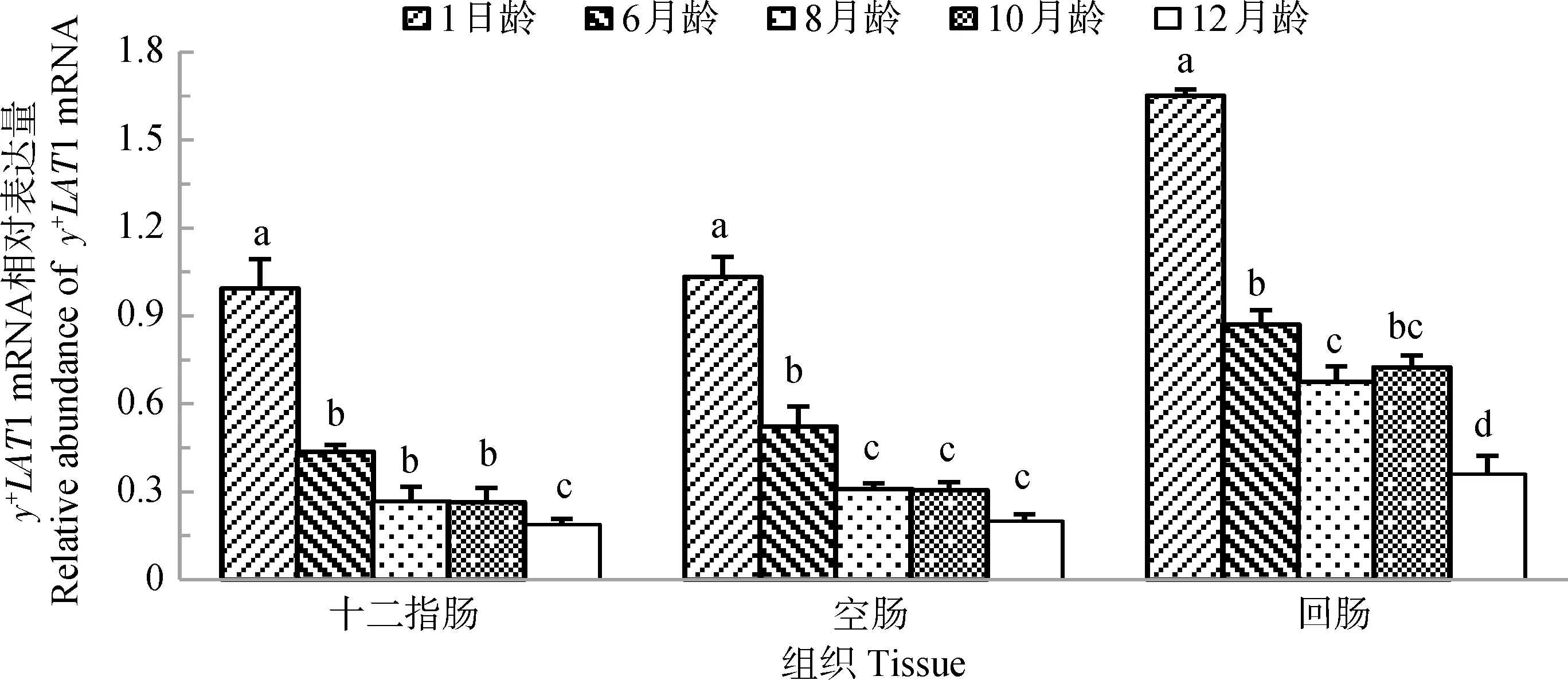
图5 y+LAT1 mRNA在不同年龄山羊小肠的表达Fig.5 The expression of y+LAT1 mRNA in small intestine of goats at different ages

图6 y+LAT2 mRNA在不同年龄山羊小肠的表达Fig.6 The expression of y+LAT2 mRNA in small intestine of goats at different ages
3.2 山羊y+LAT1 mRNA的组织分布
R.Pfeiffer等[14]发现,y+LAT1 mRNA在人的肾中有较高表达,D.Torrents等[15]进一步发现其在人的胎盘、血小板、外周血白细胞、肺、脾和小肠中均有表达;其在小鼠小肠和肾表达量很高,在其他组织中表达量很低,这些同本研究的结果基本一致。职爱民[11]发现,仔猪y+LAT1 mRNA在肠道表达量最高,在大脑、肌肉和肝中没有表达,这与本研究稍有出入。杨吉轩[16]研究发现,草鱼y+LAT1在所有组织中均有表达,中肠和前肠比其他组织的表达量高,这和本研究的结果完全一致。综合以上研究,发现人、小鼠、猪和山羊y+LAT1 mRNA的组织分布存在一定的相似性,即y+LAT1 mRNA均在小肠表达量很高,推测山羊y+LAT1基因主要表达部位在小肠。
3.3 山羊y+LAT2 mRNA的组织分布
M.H.Dave等[9]研究表明,小鼠y+LAT2 mRNA在所有肠段、肝、大脑、肾中表达量均较低,这和本研究的结果一致。谭会泽等[10]发现,黄羽肉鸡y+LAT2 mRNA在回肠表达量最高,但回肠、空肠和十二指肠表达量差异不显著(P>0.05)。杨吉轩[16]发现,草鱼y+LAT2 mRNA在前肠和中肠表达量比其它组织高。这些与本研究的结果稍有出入。本研究发现y+LAT2 mRNA在1日龄山羊小肠(回肠)、大脑等组织中有相对较高的表达。M.Zielinska等[17]研究发现,上调y+LAT2基因的表达可以促进大鼠大脑皮质星形胶质细胞对精氨酸的吸收。综合以上研究结果,推测山羊y+LAT2 基因主要表达部位在小肠(回肠)和大脑,其可能对大脑中碱性氨基酸的转运发挥重要作用。
1日龄山羊y+LAT2 mRNA的相对表达量同4F2hcmRNA 和y+LAT1 mRNA未在同一数量级,前者较后两者低。由此推测4F2hc 和y+LAT1构成的异二聚体蛋白可能较4F2hc和y+LAT2构成的异二聚体蛋白发挥更为主要的氨基酸转运作用。根据4F2hcmRNA、y+LAT1 mRNA和y+LAT2 mRNA在各组织的相对表达量,推测山羊y+L碱性氨基酸转运系统主要的转运部位为小肠。
3.4 山羊小肠4F2hcmRNA的发育性表达规律
关于小肠碱性氨基酸转运载体基因在动物发育的不同阶段表达量变化的研究报道较少。职爱民[11]研究发现,蓝塘猪十二指肠和空肠4F2hcmRNA 的表达丰度在7 d 时显著高于其他各日龄(P<0.05),在26、30、60、90和150 d间表达量无显著差异(P>0.05),这与本研究的结果相似。本研究发现,4F2hcmRNA在各肠段表达量均以1日龄山羊为最高,其他月龄山羊相同肠段之间表达量无显著差异(P>0.05)。B.D.Humphrey等[18]认为,日粮的化学组成可以直接或间接影响基因的表达,饲料内营养物质转运载体类型和数量的变化是动物组织对于饲料成分以及营养水平变化适应性的一种表现。1日龄山羊4F2hcmRNA高表达的原因可能是由于本研究中1日龄山羊在屠宰前已吮奶,蛋白质品质及进入肠道的氨基酸种类和含量可能较以采食饲料为主的6~12月龄山羊高和丰富,使4F2hcmRNA在1日龄山羊各肠段均有较高表达。本研究中,6~12月龄山羊之间相同肠段4F2hcmRNA表达量无显著差异(P>0.05),一定程度上说明4F2hc基因可能在日粮成分稳定的条件下,在山羊小肠内稳定表达。N.Reig等[19]研究认为,轻链在没有重链存在的情况下,就可以发挥氨基酸转运作用,重链可能更多起引导定位的作用。还有研究表明,4F2hc除了作为转运载体蛋白成分外,还是一种细胞表面分化抗原[20],这些都可能是4F2hc基因表达保守的原因。
3.5 山羊小肠y+LAT1 mRNA的发育性表达规律
E.R.Gilbert等[21]研究了肉鸡小肠中多种氨基酸转运载体,发现y+LAT1 mRNA的表达量随时间线性降低,这和本研究的结果相一致。1日龄山羊小肠y+LAT1 mRNA表达量很高,可能与日粮中氨基酸的成分和含量有关。本研究发现,在日粮成分稳定的情况下,山羊y+LAT1 mRNA的表达量随年龄的增加而进一步降低。J.Pacha[22]认为,随着肠道组织总质量的增加,肠道中氨基酸转运载体总体转运能力增强,但单位面积上肠道组织对部分氨基酸转运能力会下降,可能是由于氨基酸转运蛋白密度的下降、不同型的氨基酸转运载体之间的替换和氨基酸转运载体周转速率的变化等一系列原因导致的,在一定程度上可以用来解释本研究y+LAT1 mRNA的发育性表达规律。
3.6 山羊小肠y+LAT2 mRNA的发育性表达规律
谭会泽等[10]发现,岭南黄肉鸡与ArborAcre肉鸡十二指肠、空肠y+LAT2 mRNA具有相似的发育性表达规律,即y+LAT2 mRNA的表达均随日龄的增加呈现先升高后降低的趋势;岭南黄肉鸡与ArborAcre肉鸡回肠y+LAT2 mRNA表达存在明显不同,且分别不同于十二指肠和空肠,这和本研究的结果相似。1日龄山羊采食初乳,但是y+LAT2 mRNA在1日龄山羊小肠中的表达量却较其他月龄山羊低,其表达量随山羊年龄的增加呈现先升高后降低的趋势,这同本研究发现的y+LAT1 mRNA的表达情况明显不同,可能是由于所有年龄山羊小肠y+LAT2 mRNA表达量均较y+LAT1 mRNA低,所以在y+LAT1 mRNA表达量较高的情况下,其受肠道氨基酸调控的作用并不明显,进一步推测y+LAT2可能不是山羊y+L系统中主要的氨基酸转运载体,而是y+LAT1发挥主要的转运作用。y+LAT2 mRNA表达量随山羊年龄的增加呈现先升高后降低的趋势,一定程度上也说明y+LAT2对碱性氨基酸的吸收转运可能随山羊年龄的增加在有限的范围内得到提升。y+LAT2 mRNA在山羊回肠中的发育性表达规律与十二指肠和空肠存在一定的差异,一定程度上说明肠道近端和远端对碱性氨基酸的吸收可能存在差异。
4 结 论
山羊y+L碱性氨基酸转运系统的主要转运部位在小肠;轻链y+LAT1和重链4F2hc构成的异二聚体转运蛋白可能在该系统中发挥主要的转运作用;4F2hc和y+LAT2基因可能分别在山羊皮肤和大脑中发挥重要的生理功能;4F2hc、y+LAT1和y+LAT2基因在小肠中受肠段和山羊发育阶段的影响,具有不同的发育性表达规律。
[1] DEVES R,BOYD C A.Transporters for cationic amino acids in animal cells:discovery,structure,and function[J].PhysiolRev,1998,78(2):487-545.
[2] BRÖER S.Amino acid transport across mammalian intestinal and renal epithelia[J].PhysiolRev,2008,88(1):249-286.
[3] BOULTER E,ESTRACH S,ERRANTE A,et al.CD98hc (SLC3A2) regulation of skin homeostasis wanes with age[J].JExpMed,2013,210(1):173-190.[4] FAN S,ZHAO Y,LI X,et al.Genetic variants in SLC7A7 are associated with risk of glioma in a Chinese population[J].ExpBiolMed,2013,238(9):1075-1081.
[5] FAN S,MENG D,XU T,et al.Overexpression of SLC7A7 predicts poor progression-free and overall survival in patients with glioblastoma[J].MedOncol,2013,30(1):1-7.
[6] SPERANDEO M P,ANNUNZIATA P,BOZZATO A,et al.Slc7a7 disruption causes fetal growth retardation by downregulating Igf1 in the mouse model of lysinuric protein intolerance[J].AmJPhysiolCellPhysiol,2007,293(1):C191-C198.
[7] 董晓玲,王洪荣,卢德勋.内蒙古白绒山羊的限制性氨基酸研究[J].动物营养学报,2006,18(1):26-31. DONG X L,WANG H R,LU D X.Study on limiting amino acids in Inner Mongolian White Cashmere goats[J].ChineseJournalofAnimalNutrition,2006,18(1):26-31.(in Chinese)
[8] 张 年.麻城黑山羊及其杂交后代肥育性能及肉品质研究[D].北京:中国农业科学院,2012. ZHANG N.Study on fattening performance and meat quality in Macheng Black goats and its crossbred progenies[D].Beijing:Chinese Academy of Agricultural Sciences,2012.(in Chinese)
[9] DAVE M H,SCHULZ N,ZECEVIC M,et al.Expression of heteromeric amino acid transporters along the murine intestine[J].JPhysiol,2004,558(2):597-610.
[10] 谭会泽,王修启,苏海林,等.鸡不同肠段碱性氨基酸转运载体mRNA表达的差异性研究[J].畜牧兽医学报,2007,38(3):247-252. TAN H Z,WANG X Q,SU H L,et al.Difference of cationic amino acid transporters mRNA expression in different intestinal segments of chicken[J].ActaVeterinariaetZootechnicaSinica,2007,38(3):247-252.(in Chinese)
[11] 职爱民.猪碱性氨基酸转运载体cDNA克隆及其mRNA表达与调控[D].广州:华南农业大学,2008. ZHI A M.Cloning of porcine cationic amino acid transporters cDNA and its mRNA expression and regulation[D].Guangzhou:South China Agricultural University,2008.(in Chinese)
[12] ESTRACH S,LEE S A,BOULTER E,et al.CD98hc (SLC3A2) loss protects against ras-driven tumorigenesis by modulating integrin-mediated mechanotransduction[J].CancerRes,2014,74(23):6878-6889.[13] PARMACEK M S,KARPINSKI B A,GOTTESDIENER K M,et al.Structure,expression and regulation of the murine 4F2 heavy chain[J].NucleicAcidsRes,1989,17(5):1915-1931.
[14] PFEIFFER R,ROSSIER G,SPINDLER B,et al.Amino acid transport of y+L-type by heterodimers of 4F2hc/CD98 and members of the glycoprotein-associated amino acid transporter family[J].EMBOJ,1999,18(1):49-57.
[15] TORRENTS D,ESTÉVEZ R,PINEDA M,et al.Identification and characterization of a membrane protein (y+L amino acid transporter-1) that associates with 4F2hc to encode the amino acid transport activity y+LA candidate gene for lysinuric protein intolerance[J].JBiolChem,1998,273(49):32437-32445.
[16] 杨吉轩.草鱼碱性氨基酸转运载体y+LAT1和y+LAT2的基因克隆及其mRNA表达研究[D].武汉:华中农业大学,2013. YANG J X.Molecular cloning and expression analysis of cationic amino acid transporters y+LAT1 and y+LAT2 in Ctenopharyngodon idellus[D].Wuhan:Huazhong Agricultural University,2013.(in Chinese)
[17] ZIELINSKA M,SKOWRONSKA M,FRESKO I,et al.Upregulation of the heteromeric y(+)LAT2 transporter contributes to ammonia-induced increase of arginine uptake in rat cerebral cortical astrocytes[J].NeurochemInt,2012,61(4):531-535.
[18] HUMPHREY B D,STEPHENSEN C B,CALVERT C C,et al.Glucose and cationic amino acid transporter expression in growing chickens (Gallusgallusdomesticus)[J].CompBiochemPhysiolAMolIntegrPhysiol,2004,138(4):515-525.
[19] REIG N,CHILLARON J,BARTOCCIONI P,et al.The light subunit of system b(o,+) is fully functional in the absence of the heavy subunit[J].EMBOJ,2002,21(18):4906-4914.
[20] DEVES R,BOYD C A.Surface antigen CD98(4F2):not a single membrane protein,but a family of proteins with multiple functions[J].JMembrBiol,2000,173(3):165-177.
[21] GILBERT E R,LI H,EMMERSON D A,et al.Developmental regulation of nutrient transporter and enzyme mRNA abundance in the small intestine of broilers[J].PoultSci,2007,86(8):1739-1753.
(编辑 郭云雁)
Study on Transcriptional Level of y+L Cationic Amino Acid Transporter System in Goat
ZHOU Ying-hao1,GAO Ye2,LIU Lin-li3,ZENG Jie1,YANG Yu-xin1,ZHANG En-ping1*,CHEN Yu-lin1*
(1.CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling712100,China; 2.TheCenterofLifeScience,YulinCollege,Yulin719000,China; 3.CollegeofLifeSciences,NorthwestA&FUniversity,Yangling712100,China)
The objective of this study was to research the mRNA expression of goat 4F2hc,y+LAT1 andy+LAT2 (y+L cationic amino acid transporter system) in various tissues and their developmental expression in small intestine of goats at different ages.A total of 15 Shanbei White Cashmere goats at the ages of day 1,month 6,8,10 and 12 (3 goats at each age) were slaughtered to collect heart,liver,kidney,brain,muscle,skin,rumen,duodenum,jejunum,ileum and colon tissues.Then 4F2hc,y+LAT1 andy+LAT2 mRNA were quantified by Real-time quantitative PCR in all collected tissues of 1-day-old goats and in duodenum,jejunum,ileum of all goats.The results indicated that,(1) 4F2hc,y+LAT1 andy+LAT2 mRNA were widely expressed in all collected tissues of 1-day-old goats and the expression level varied from tissues.Specifically,4F2hcmRNA in skin,y+LAT1 mRNA in ileum andy+LAT2 mRNA in brain and ileum had the highest abundance.(2) 4F2hcmRNA of duodenum,jejunum and ileum on 1-day-old goats had higher abundance than that in goats on the other month-old,and there was no significant difference in the same segment of small intestine in goats on the other month-old (P>0.05);y+LAT1 mRNA abundance in small intestine of goats decreased with age;y+LAT2 mRNA abundance in small intestine peaked in 10-month-old goats and then dropped with age,while it in ileum of 1-day-old goats had lower abundance than that in goats on the other month-old,and there was no significant difference in ileum between goats on the other month-old (P>0.05).In conclusion,y+L cationic amino acid transporter system played a main role in transferring amino acid in small intestine of goats and the heterodimer consisting of y+LAT1 and 4F2hc might be the main transporter protein in y+L system.4F2hcandy+LAT2 might perform important physiological functions in skin and brain of goats,respectively.4F2hc,y+LAT1 andy+LAT2 were differentially regulated and distributed with the differences of developmental stages and segments of small intestine in goat.
goat;y+L cationic amino acid transporter system;Real-time quantitative PCR;mRNA expression
10.11843/j.issn.0366-6964.2015.08.005
2014-10-30
国家绒毛用羊产业技术体系(CARS-40-13);公益性行业(农业)科研专项(201303059);陕西省科学技术研究发展计划项目(2014K01-17-03);陕西省农业科技攻关项目(2014K01-17-04)
周英昊(1989-),男,满族,河北隆化人,硕士生,主要从事动物营养原理与方法研究,E-mail: mymyinghao@163.com
*通信作者:张恩平,教授,E-mail:zhangenping@nwsuaf.edu.cn;陈玉林,教授,E-mail:chenyulin@nwsuaf.edu.cn
S827.2
A
0366-6964(2015)08-1308-09

