DHEA诱导雌性大鼠PCOS模型早期性器官及其相关激素变化的研究
郭保平,徐明龙,胡 进,徐银学
(南京农业大学动物科学技术学院,南京 210095)
DHEA诱导雌性大鼠PCOS模型早期性器官及其相关激素变化的研究
郭保平,徐明龙,胡 进,徐银学*
(南京农业大学动物科学技术学院,南京 210095)
本研究旨在探讨大鼠卵巢囊肿形成过程中,大鼠性腺等器官增重、性激素水平以及卵巢组织抗苗勒管激素AMHmRNA变化关系。选取性未成熟的雌性SD大鼠80只(21 d),随机分为两组:试验组和对照组各40只。试验组大鼠颈部皮下注射0.2 mL·d-1芝麻油+DHEA(每100 g体重注射6 mg DHEA);对照组注射等量注射用油,预试期2 d,正试期20 d。分别在试验开始第5、10、15和20天称取大鼠的体重、卵巢、子宫、肝、肾和脾的重量,计算脏器指数,采集血液备用。结果显示,第15和20天试验组大鼠的体重高于对照组(P<0.01);试验组大鼠子宫重量显著高于对照组(P<0.01),第5和10 天卵巢重量显著高于对照组(P<0.01);试验组血清AMH和雄激素(T)均显著高于对照组(P<0.01或P<0.05),第15和20 天血清P以及第20天血清LH和E2试验组均显著高于对照组(P<0.01或P<0.05);试验组卵巢AMHmRNA表达量高于对照组,第5和10天表达量差异显著(P<0.05)。结果提示,试验组大鼠性器官在性发育早期得到优先发育;抗苗勒管激素异常分泌可能是大鼠PCOS发病机理和发展的标志;卵巢AMHmRNA表达与血清AMH分泌变化规律并不完全一致,可能为深入研究多囊卵巢综合征的发生机制提供依据。
PCOS模型;脱氢表雄酮(DHEA);抗苗勒管激素(AMH);血清激素
多囊卵巢综合征(Polycystic ovarian syndrome,PCOS)是一种发病多因性、临床表现高度异质性的育龄妇女常见的生殖障碍和代谢异常并存的内分泌紊乱综合征,持续性无排卵、雄激素过高和胰岛素抵抗是其重要特征,一直以来PCOS困扰着广大女性患者,其病因及发病机理至今尚不明确[1]。有研究者认为PCOS是多基因遗传参与和环境因素的共同作用[2-3],提示基因因素在PCOS病因学中起到非常重要的作用。近年来,随着研究的深入,对PCOS发病机制的研究重心逐渐转移到分子生物学层面,发现包括抗苗勒管激素、胰岛素样生长因子、肿瘤坏死因子、脂联素、瘦素和内脂素等许多细胞因子在内,都参与了PCOS的发病过程,尤其抗苗勒管激素,除了参与性别分化,同时参与卵子的发育、成熟、排卵、受精等过程,研究表明,血清中AMH不仅可以预测卵巢储备能力,还是体外受精-胚胎移植结果的独立预测因子[4-5],AMH同时还是卵巢颗粒细胞肿瘤的重要标志物,作为诊断多囊卵巢综合征的有利工具[6]。
本研究根据经典多囊卵巢综合征造模方法[7],经过鉴定造模成功后,采用相同的方法,采集不同时间样品,结合检测卵巢AMHmRNA和血清激素水平,观察DHEA对器官及血清激素的影响。
1 材料与方法
1.1 试验动物
试验用21 d雌性Sprague-Dawley (SD) 大鼠80只,购自南京青龙山实验动物场。大鼠随机分为试验组和对照组各40只。要求通风良好,饲养温度(20±2)℃,每日光照时间12 h,提供充足饮水和饲料,每2 d更换垫料。
1.2 PCOS大鼠模型构建与验证
参照皮下注射DHEA建立PCOS模型方法[7],试验组大鼠每天每100 g体重颈部皮下注射DHEA 6 mg+0.2 mL芝麻油,同时对照组注射等量的油剂,连续注射20 d。各组随机挑选10只大鼠,记录大鼠阴道开口时间到试验结束。采用吉姆萨染色法,连续每天做阴道涂片。试验组大鼠发情周期出现严重紊乱,同时,通过卵巢组织切片HE染色发现,试验组卵巢存在囊性病变、卵泡膜增生和间质增生等症状,初步确定PCOS模型建立成功。
1.3 标本收集及病理检测
分别在第5、10、15和20天进行采样,称重后颈椎脱臼处死,采用心采血约2 mL,3 000 r·min-1离心15 min,取血清-80 ℃储存。分别取卵巢、子宫、肝、肾和脾,称其湿重。取称重后一侧卵巢(体右侧)组织做常规石蜡切片,HE进行染色观察,另一侧卵巢(体左侧)-80 ℃保存,用于RNA提取。测定指标:脏器指数=器官湿重/体重,计算各脏器指数。
1.4 卵巢AMH转录水平检测
根据NCBI中提交的大鼠AMH基因mRNA序列(GenBank No.:NM_012902.1)和β-actin基因mRNA序列(GenBank No.:NM_031144.3),利用Primer Premier 5.0软件设计引物,并送上海英骏生物技术工程有限公司合成,引物序列见表1。
根据Trizol试剂盒说明书提取大鼠卵巢组织总RNA,经琼脂糖凝胶电泳和紫外分光光度计检测后,参照TaKaRa反转录试剂盒说明书合成第1链cDNA,-20 ℃保存备用。Real time PCR及结果分析,反应体系:模板cDNA 2 μL,2×SYBR Premix Ex Taq 10 μL,上下游引物各0.4 μL,ROX 0.4 μL,灭菌蒸馏水6.8 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,40个循环;熔解曲线:95 ℃ 15 s,60 ℃上升至95 ℃。采用2-ΔΔCt法[8],计算公式:相对基因表达量=2-(ΔCt样品-ΔCt对照)。
1.5 血清中生殖激素浓度测定
采用放射免疫分析法(RIA)测定血清FSH、LH、T、E2及P(北京北方生物技术研究所,批号:20130820);采用酶联免疫法(ELISA)测定血清苗勒管抑制物质/抗苗勒管激素(MIS/AMH)(南京朴诚生物科技有限公司,MFD:2014.02),分别按照试剂盒说明书进行操作测定。
表1 目的基因AMH和内参基因β-actin的PCR引物序列
Table 1 The primer sequences of target geneAMHand internal control geneβ-actin
1.6 数据统计
数据经Excel 2003初步处理之后,用SPSS19.0软件进行统计分析。组间采用独立样本t检验方法分析,组内比较采用LSD方法分析不同时间点之间的结果。数据以“平均值±标准误(Mean±SEM)”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 脱氢表雄酮对大鼠发情周期的影响
试验组大鼠100%(10/10)出现发情周期紊乱,处于发情后期或发情间期;而对照组可观察到完整发情周期。试验组阴道开口时间均早于对照组,但无统计学意义(P>0.05)。
2.2 脏器指数
试验组和对照组雌性大鼠发育过程中主要脏器指数变化情况见表2。由组间比较可知,随着大鼠生长发育,试验组与对照组大鼠比较,第15和20天体重增加((179.00±4.00)g和(207.33±0.33)g)显著高于对照组((147.67±6.74)g和(175.67±3.84)g)(P<0.01)。与对照组大鼠不同日龄脏器指数比较,卵巢指数与子宫指数早期增长较快,其中卵巢指数(5和10 d)和子宫指数(5、10和15 d)显著高于对照组(P<0.01),试验组雌性大鼠子宫指数高于对照组,试验组第15和20天肝脏指数存在差异显著和极显著(P<0.05和P<0.01);试验组第20 天脾脏指数存在差异极显著(P<0.01);而相同日龄试验组与对照组大鼠组间肾脏指数和脾脏指数均差异不显著(P>0.05)。
试验组不同日龄比较分析可知,大鼠体重随日龄增加而显著增加(P<0.01),第20 天体重最重,第5 天体重最轻;第5天肾脏指数显著高于其他日龄(P<0.01);其他脏器指数不同日龄组比较均差异不显著(P>0.05)。对照组不同日龄分析可知,从第5~10 天大鼠体重显著增加(P<0.01),第15 天体重分别与第10 和20 天体重比较差异不显著(P>0.05),但第20 天体重显著高于第5和10 天体重(P<0.01);第20天子宫指数最高,与第10 和15天差异不显著(P>0.05),但显著高于第5天;其他脏器指数不同日龄组内之间比较均差异不显著(P>0.05)。
2.3 不同日龄SD雌性大鼠卵巢HE染色观察
不同处理组雌性大鼠卵巢HE染色见图1,各种类型卵泡的组织学诊断参照J.R.Brawer等的标准[9]。由图1可知,与对照组比较,试验组第5天(图1A)可见不同发育时期卵泡和黄体,但间质细胞发现增生,且个别发育卵母细胞的颗粒细胞层减少或放射冠消失;第10天(图1B)可见卵泡发生囊性扩张,卵泡膜增厚,颗粒细胞层减少,卵泡消失,发育期卵泡减少;第15天 (图1C)同样可见囊性扩张卵泡,发现异常的多卵母细胞卵泡(Multioocyte follicle,MOF)或多卵子卵泡(Polyovuluar follicle,POF),没有卵丘颗粒细胞包裹、透明带解体;第20天试验组卵巢间质增生面积增加明显,且膜细胞增厚,出现“项链症”(图1D)。对照组(图1E~H)不同日龄各个时期卵泡和黄体、颗粒细胞形态完整,排列整齐,多为8~9层,卵泡膜细胞、间质细胞未见增生。
2.4 血清AMH检测结果
不同日龄雌性大鼠血清AMH水平比较见表3。由组内比较可知,试验组大鼠血清AMH,第5 天 激素水平最高,极显著高于其他日龄(P<0.01),在第10 天时降到最低,第15和20天血清AMH均显著上升(P<0.01),高于第10 天。对照组大鼠血清AMH第5和20 天激素水平没有差异(P>0.05),但高于第10 和15 天(P<0.01),不同日龄试验组大鼠血清AMH水平均显著高于对照组,差异极显著(P<0.01)。

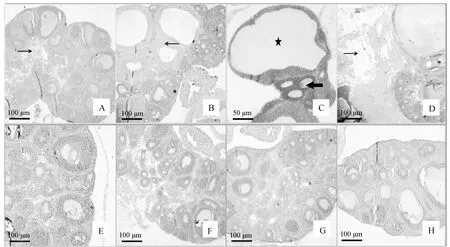
试验组.A(5 d)、B(10 d)、C(15 d)、D(20 d);DHEA处理引起大鼠卵巢发育异常。→.间质增生;←.卵泡膜增生;.多卵母细胞卵泡或多卵子卵泡;★.囊性卵泡;对照组.E(5 d)、F(10 d)、G(15 d)、H(20 d)Experimental group.A(5 d),B(10 d),C(15 d),D(20 d);Treatment with DHEA results in the abnormal development of ovary.→.Hyperplasia of ovarian stroma;←.Ovarian hyperthecosis;.MOF or POF;★.Cystic follicles;Control group.E(5 d),F(10 d),G(15 d),H(20 d)图1 大鼠卵巢组织切片HE染色Fig.1 HE staining of tissue section for rat ovary
2.5 不同日龄雌性大鼠血清FSH、LH、E2、T和P的变化
表3结果表明,组内比较:不同日龄试验组大鼠血清FSH水平差异均不显著(P>0.05);血清LH呈现波动性变化,第20天血清LH水平最高,显著高于其他日龄(P<0.05);与LH变化趋势相反,血清T含量从第5 天开始先上升后下降,第10天血清T显著上升,高于其他日龄(P<0.01),而第5天含量最低(P<0.05);试验组血清E2随着日龄增加呈现上升趋势,第20天血清E2水平最高,显著高于其他日龄(P<0.01);血清P变化也呈现上升趋势,第20 天血清P水平最高(P<0.01)。对照组大鼠不同日龄血清FSH、LH、T、E2和P含量组内比较,差异均不显著(P>0.05)。
组间比较可知,试验组与对照组比较,不同日龄大鼠血清FSH和LH变化趋势相同,只有第20天试验组大鼠血清LH水平显著高于对照组(P<0.05);不同日龄试验组大鼠血清T水平均显著或极显著高于对照组(P<0.05或P<0.01);第20 天试验组大鼠血清E2含量,极显著高于对照组(P<0.01);第15天试验组血清P水平均显著低于对照组,第20天试验组血清P水平显著高于对照组(P<0.05),其他日龄均差异不显著。
2.6 大鼠卵巢组织AMHmRNA表达水平分析
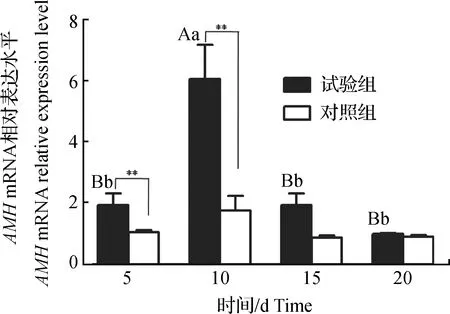
图2 大鼠卵巢组织AMH mRNA表达变化Fig.2 Changes of AMH mRNA expression in ovarian tissues of rats
不同处理AMH基因随日龄增加的变化情况(图2)。由组内比较可知,试验组卵巢AMHmRNA第10天表达量最高(P<0.01),其他日龄表达量差异不显著(P>0.05);对照组AMHmRNA 不同日龄表达量差异均不显著(P>0.05)。由组间比较可知,试验组卵巢AMHmRNA表达量在第5和10天极显著高于对照组(P<0.01),第15和20天差异均不显著(P>0.05)。
3 讨 论
大量研究证实,PCOS患者卵巢内的卵泡并非完全凋亡或闭锁,而是处于生长停滞阶段[10]。目前,国内外针对PCOS已建立了多种造模方法,本试验选择脱氢表雄酮(Dehydroepiandrosterone,DHEA),通过构建SD大鼠PCOS模型,研究大鼠卵巢囊肿形成过程中,大鼠性腺等器官增重、性激素水平以及卵巢组织AMHmRNA和血清AMH水平变化的关系。
脏器指数是试验动物的重要生物学指标之一,其大小在一定程度上能够反映动物器官功能强弱及受损情况。而肝和脾是动物体内重要的代谢和免疫中心,其功能的完整性与血液中的代谢酶和免疫细胞具有密切关系[11]。本研究发现,DHEA诱导建立的PCOS大鼠体重(15、20 d)显著高于正常大鼠(P<0.01),推测这可能与大鼠肝脂质代谢紊乱有关[12];同时也发现试验组第15和20天肝脏指数显著高于对照组(P<0.05,P<0.01),试验组第20天脾脏指数显著低于对照组(P<0.01),暗示PCOS形成的复杂性,可能伴随着其他系统器官的变化。试验早期,试验组大鼠卵巢系数和子宫系数均显著高于对照组(P<0.05),随着日龄增加,显著性降低,提示可能是由于注射DHEA导致大鼠体内激素分泌紊乱,下丘脑-垂体-性腺轴(HPGA)提前启动,相应的性腺器官得到优先发育。
血液指标是反应机体健康状况的重要指标,为动物的健康状况和治疗提供依据[13]。从血清激素水平变化(表3)可知,在试验处理第10天时,所有组血清激素FSH、LH、E2含量都有上升,结合脏器系数变化,说明雌性大鼠在32日龄(注射第10天)时出现一次性器官发育高峰;而与对照组比较,试验组第10天组T水平显著升高(P<0.01),推测可能是试验组部分脏器指数高于对照组的原因。随着大鼠日龄增加,卵巢和子宫脏器系数差异性减小(P>0.05);结合卵巢HE染色可知,试验组大鼠在第5天时,卵巢已经发生卵巢间质增生,少量卵泡囊性扩张,第10天时,卵泡膜细胞明显增厚,推测外源性DHEA对卵巢生长发育已经发生抑制作用;组间比较可知,试验组子宫系数始终高于对照组(P<0.01),但第20天差异不显著(P>0.05),分析原因一方面是外源性DHEA促进雄烯二酮或睾酮形成进而促进更多的雌二醇或雌酮合成,同时在孕激素的共同作用下,导致子宫容受性降低[14],子宫内膜继续增厚、充血、腺体增生并分支,为胚泡植入和支持胚胎着床、促进内膜基底细胞分化为蜕膜瘤进行准备,最终导致子宫瘤等并发症[15-16];另一方面,随着日龄增长,大鼠自身体内激素分泌功能开始启动,试验组大鼠体重增加抵消了子宫系数升高的效果。FSH和LH对卵泡的生长发育发挥重要作用[17]。在本试验中,不同日龄试验组与对照组血清FSH、LH含量变化差异不明显,仅在第20 天时LH差异极显著(P<0.01)。而通过卵巢组织切片,笔者发现在试验早期试验组大鼠卵巢已发生病变,说明在早期发现和诊断PCOS中,血清FSH和LH还是有一定的滞后性。因此专家认为[18-19],内分泌LH增高只是PCOS的临床表现,可能并不适合作为PCOS的诊断标准。
抗苗勒管激素(AMH)是为数不多的抑制卵泡发育的卵巢局部调控因子之一。研究表明,血清AMH可以作为诊断PCOS的一项指标,或者直接纳入PCOS的诊断标准[6]。试验中ELISA检测血清AMH显示,试验组大鼠血清AMH显著高于对照组,第5 天组AMH水平最高,第10 天组有所下降之后平缓上升,趋于平稳。分析原因,可能是性成熟早期,注射外源性DHEA,促进卵巢提前发育,AMH水平显著增加,随着注射时间增加产生负反馈,抑制AMH的合成。试验组第10天T显著增加,AMH显著降低,之后T和AMH水平都趋于平稳。结合卵巢组织HE染色可知,试验组第5天卵巢已经发生卵巢间质增生,出现“项链症”[20]。同时有研究指出[21],PCOS患者血清AMH高出正常妇女2~3倍,AMH的作用可能来自自分泌或旁分泌,因此卵巢局部的AMH变化更能反应AMH 的功能。推测AMH的异常变化,可能是导致次级卵泡生长功能降低、颗粒细胞对FSH敏感性下降的原因。而AMH特殊的分泌方式,经典信号通路并不能解释为什么血清AMH同时拥有旁分泌和自分泌两种分泌方式。mRNA前体的选择性剪切可以改变编码区序列,产生多种蛋白质,从而改变基因功能[22]。最新研究发现[23],AMHⅡ型受体 mRNA存在两种可变剪切体,与血清AMH合成、运输和分泌等密切相关,这可能解释试验中卵巢AMHmRNA表达量与血清AMH水平变化趋势不一致的原因。同时,徐燕颖[24]研究指出,外源性DHEA影响AMH启动子表达活性,可以明显增强卵巢颗粒细胞AMHmRNA和蛋白表达,同样提示了AMH可能参与PCOS的发病,PCOS中存在颗粒细胞AMH分泌的异常,从而造成卵巢局部的病理改变。而P.Xu等[25]研究指出AMH及其Ⅱ型受体多态性可能是导致卵巢对外源性激素敏感性增强、OHSS发病的因素之一。关于PCOS的病因学、诊断标准和最佳治疗方案都还存在很多争论和悬而未决的问题。越来越多的研究表明,PCOS是由遗传和环境两方面共同作用产生的[26-28],且在临床表现具有多样性和高度异质性以及明显的种族差异性,DHEA诱导的PCOS模型也并不能完全重现PCOS动物病理状态。因此,阐明PCOS的发病原因,可以为临床诊断、预防、治疗和研究PCOS提供更多的理论依据和思路。
4 结 论
大鼠PCOS形成早期,试验组与对照组血清AMH水平存在显著差异,可以作为早期诊断PCOS的检测指标。
[1] RUTKOWSKA A,RACHON D.Bisphenol A (BPA) and its potential role in the pathogenesis of the polycystic ovary syndrome (PCOS)[J].GynecolEndocrinol,2014,30(4):260-265.
[2] ERIKSEN M B,NIELSEN M F,BRUSGAARD K,et al.Genetic alterations within the DENND1A gene in patients with polycystic ovary syndrome (PCOS)[J].PLoSONE,2013,8(9):e77186.
[3] DIAMANTI-KANDARAKIS E,CHRISTAKOU C,MARINAKIS E.Phenotypes and enviromental factors:their influence in PCOS[J].CurrPharmDes,2012,18(3):270-282.
[4] KEDEM A,HOURVITZ A,YUNG Y,et al.Anti-Mullerian hormone (AMH) downregulation in late antral stages is impaired in PCOS patients.A study in normo-ovulatory and PCOS patients undergoinginvitromaturation (IVM) treatments[J].GynecolEndocrinol,2013,29(7):651-656.
[5] KOTANIDIS L,ASIMAKOPOULOS B,NIKOLETTOS N.Association between AMH,oocyte number and availability of embryos for cryopreservation in IVF[J].Invivo,2013,27(6):877-880.
[6] PEIGNE M,DECANTER C.Serum AMH level as a marker of acute and long-term effects of chemotherapy on the ovarian follicular content:a systematic review[J].ReprodBiolEndocrinol,2014,12:26.
[7] LEE M T,ANDERSON E,LEE G Y.Changes in ovarian morphology and serum hormones in the rat after treatment with dehydroepiandrosterone[J].AnatRec,1991,231(2):185-192.
[8] KONG J S,YOO S A,KIM J W,et al.Anti-neuropilin-1 peptide inhibition of synoviocyte survival,angiogenesis,and experimental arthritis[J].ArthritisRheum,2010,62(1):179-190.
[9] BRAWER J R,MUNOZ M,FAROOKHI R.Development of the polycystic ovarian condition (PCO) in the estradiol valerate-treated rat[J].BiolReprod,1986,35(3):647-655.
[10] HOMBURG R,CRAWFORD G.The role of AMH in anovulation associated with PCOS:a hypothesis[J].HumReprod,2014,29(6):1117-1121.
[11] 周 宁,张海华,吕智超,等.饲粮锌水平对冬毛期水貂血清生化指标和脏器指数的影响[J].畜牧兽医学报,2014,45(12):1988-1994. ZHOU N,ZHANG H H,LÜ Z C,et al.Effects of diets with different zinc levels on the selected serum biochemical indexes and organ indexes of minks during the winter hair period[J].ActaVeterinariaetZootechnicaSinica,2014,45(12):1988-1994.(in Chinese)
[12] ANDERSON A D,SOLORZANO C M,MCCARTNEY C R.Childhood obesity and its impact on the development of adolescent PCOS[J].SeminReprodMed,2014,32(3):202-213.
[13] 王 波,姜成钢,纪守坤,等.日粮尿素水平对肉羊血液学、血清学指标和消化器官的影响[J].畜牧兽医学报,2014,45(9):1449-1456. WANG B,JIANG C G,JI S K,et al.Effect of different levels of urea in diets on haematological indices,serological parameters and tissue lesions in Mutton sheep[J].ActaVeterinariaetZootechnicaSinica,2014,45(9):1449-1456.(in Chinese)
[14] 韩 芸,参芪胶囊改善PCOS子宫内膜容受性的临床与试验研究[D].广州:广州中医药大学,2013. HAN Y.The clinical and experimental study on improvement endometrial receptivity effects of Shen-Qi capsule in polycystic ovary syndrome[D].Guangzhou:Guangzhou University of Chinese Medicine,2013.(in Chinese)
[15] SHAFIEE M N,KHAN G,ARIFFIN R,et al.Preventing endometrial cancer risk in polycystic ovarian syndrome (PCOS) women:could metformin help?[J].GynecolOncol,2014,132(1):248-253.
[16] GIUDICE L C.Endometrium in PCOS:Implantation and predisposition to endocrine CA[J].BestPractResClinEndocrinolMetab,2006,20(2):235-244.
[17] 张宝乐.猪GPR3基因特征、表达及其对卵泡颗粒细胞的影响[D].南京:南京农业大学,2012. ZHANG B L.Characterization,expression of porcineGPR3 gene and its effects on porcine follicular granulosa cells[D].Nanjing: Nanjing Agricultural University,2012.(in Chinese)
[18] 汤 娟.多囊卵巢综合征(PCOS)的诊断及中医对其病理生理认识的研究[D].长沙:湖南中医药大学,2014. TANG J.Study on the clinical diagnosis of PCOS and the understanding of the pathophysiology of its in TCM[D].Changsha:Hunan University of Chinese Medicine,2014.(in Chinese)
[19] TAYLOR A E,MCCOURT B,MARTIN K A,et al.Determinants of abnormal gonadotropin secretion in clinically defined women with polycystic ovary syndrome[J].JClinEndocrinolMetab,1997,82(7):2248-2256.
[20] BATTAGLIA C,NAPPI R E,MANCINI F,et al.PCOS and urethrovaginal space:3-D volumetric and vascular analysis[J].JSexMed,2010,7(8):2755-2764.
[21] 沈宗奇.多囊卵巢综合征卵泡发育异常的相关因素及机制研究[D].上海:复旦大学,2009. SHEN Z Q.Correlation factors and mechanism involved in the developmental anomaly of follieles in polyeystic ovary syndrome[D].Shanghai:Fudan University,2009.(in Chinese)
[22] 郭 芳,罗国静,鞠志花,等.SPEF2基因可变剪切体和功能性SNP鉴定及其与公牛精液性状的相关性研究[J].南京农业大学学报,2014,37(3):119-125. GUO F,LUO G J,JU Z H,et al.Association of SPEF2 gene splices variant and functional SNP with semen quality traits in Chinese Holstein bulls[J].JournalofNanjingAgriculturalUniversity,2014,37(3):119-125.(in Chinese)
[23] IMHOFF F M,YANG D,MATHEW S F,et al.The type 2 anti-Müllerian hormone receptor has splice variants that are dominant-negative inhibitors[J].FEBSLett,2013,587(12):1749-1753.
[24] 徐燕颖.抗苗勒氏管激素在多囊卵巢综合征中的表达及相关机制研究[D].天津:天津医科大学,2013. XU Y Y,The expression and related mechanism of anti-Müllerian hormone in polycystic ovary syndrome[D].Tianjin:Tianjin Medical University,2013.(in Chinese)
[25] XU P,SHEN S M,ZHANG X L,et al.Haplotype analysis of single nucleotide polymorphisms in anti-Müllerian hormone gene in Chinese PCOS women[J].ArchGynecolObstet,2013,288(1):125-130.
[26] ESSAH P A,NESTLER J E,CARMINA E.Differences in dyslipidemia between American and Italian women with polycystic ovary syndrome[J].JEndocrinolInvest,2008,31(1):35-41.
[27] YU N E,HO P C.Polycystic ovary syndrome in Asian women[J].SeminReprodMed,2008,26(1):14-21.[28] SHI Y,GUO M,YAN J,et al.Analysis of clinical characteristics in large-scale Chinese women with polycystic ovary syndrome[J].NeuroEndocrinolLett,2007,28(6):807-810.
(编辑 程金华)
Studies on Changes of Sexual Organs and Their Related Hormones during the Early Phase in Dehydroepiandrosterone-induced Female Rat Polycystic Ovarian Syndrome Model
GUO Bao-ping,XU Ming-long,HU Jin,XU Yin-xue*
(CollegeofAnimalScienceandTechnology,NanjingAgriculturalUniversity,Nanjing210095,China)
This experiment was designed to study the effects of dehydroeplandrosterone (DHEA) on reproductive organs development,hormones level in serum andAMHmRNA expression with the development of rat polycystic ovarian syndrome (PCOS).Eighty immature female SD rats(21 d) were randomly divided into 2 groups:control group with no DHEA(n=40) and treatment group with DHEA(6 mg·(100 g body weight)-1,n=40).Rats were injected daily with 0.2 mL seame oil for up to 20 days.Ten rats of each groups were killed at 5,10,15 and 20 days.The blood samples were obtained,and organ indexes were calculated by weights of body,ovary,uterus,livers,kidney,and spleen.The detection results showed that the weights of body (15,20 days),uterus (5,10,15,20 days) and ovarian (5,10 days)of treatment groups were significantly higher than the control groups (P<0.01);Serum AMH and T of treatment groups (5,10,15,20 days) were significantly higher than control groups(P<0.01 orP<0.05),while the serum P (15,20 days),LH and E2(20 days) were higher (P<0.01 orP<0.05);The levels ofAMHmRNA of treatment groups(5,10 days) were obvious different significantly higher (P<0.05).These results indicated that the sexual organs were given priority to development during early stage of prepuberty in treated group.The abnormal AMH production could be cause of pathogenesis and development marker of PCOS in rats.The expression ofAMHmRNA in ovary and serum AMH level were not exactly the same,the results may supply the reference data for further research on PCOS in female rats.
polycystic ovarian syndrome model (PCOS);dehydroepiandrosterone (DHEA);anti-müllerian hormone (AMH);serum hormone
10.11843/j.issn.0366-6964.2015.08.010
2014-11-26
南京农业大学科技发展基金项目(0606F0025)
郭保平(1988-),男,山西太原人,硕士,主要从事动物分子遗传与育种研究,E-mail:2012105038@njau.edu.cn
*通信作者:徐银学,教授,博士生导师,E-mail:xuyinxue@njau.edu.cn
S852.23
A
0366-6964(2015)08-1348-08

