茶多酚对大肠杆菌抑菌机理的研究
董 璐, 代增英, 韩 晴, 李迎秋
(齐鲁工业大学 食品与生物工程学院,济南 250353)
茶多酚对大肠杆菌抑菌机理的研究
董 璐, 代增英, 韩 晴, 李迎秋
(齐鲁工业大学 食品与生物工程学院,济南 250353)
茶多酚(tea polyphenols, TP)是一种具有广谱抗菌作用的活性质,以大肠杆菌(Escherichiacoli,E.coli)为研究对象,采用牛津杯实验研究茶多酚的最小抑菌浓度,并采用结晶紫实验、电导率测定、离子泄漏测定来分析TP对E.coli细胞膜通透性的影响。通过琼脂糖凝胶电泳分析TP对E.coliDNA的影响。结果显示,TP对E.coli的最小抑菌浓度为40 μg /mL;结晶紫实验中,随着浓度的增大,OD590也随之增大;随着处理时间的增长,电导率随之增大,离子泄漏随之增多,说明TP可以作用于E.coli的细胞膜,能够改变其通透性。通过琼脂糖凝胶电泳分析可知TP处理后和空白对照组相比较,DNA条带出现变暗、拖尾现象,说明TP能够作用于E.coli的遗传物质DNA。
茶多酚;抑菌活性;抑菌机理;大肠杆菌
绿茶是世界上最受欢迎的饮品之一,由于其中富含许多营养物质,如茶多酚(tea polyphenols,TP)、维生素和氨基酸等物质[1],并且TP具有抑菌、抗氧化、抗癌和抗龋齿等生理功能[2-5],同时还具有减肥降血脂的功效[6]。中国已经明确把TP作为食品抗氧化剂列入到《GB2760-2011食品添加剂使用标准》中,对TP的抗氧化能力的研究已经十分成熟。近年来,对TP抑菌活性的研究也日趋成熟。TP具有广谱抗菌作用,它对病毒[7]、肠道致病菌[8]、口腔微生物[9-11]和孢子[1]均有不同程度的抑制作用。TP占茶叶干重达15%[12],主要由儿茶酸(catechin, C),表儿茶素(epicatechin, EC),没食子儿茶素(gallocatechin, GC),表没食子儿茶素(epigallocatechin, EGC),表儿茶素没食子酸酯(epicatechin gallate, ECG)和表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)组成[13],其中EGCG和ECG是TP中两种主要成分,含量分别为36%和24%,同时也是使TP具有抑菌作用的主要成分[14]。Yanagawa 等人研究EGCG对临床分离的对抗生素有抗性的幽门螺旋菌的抑菌活性,结果显示MIC90为100 μg/mL[13]。Cho等人研究茶多酚对抗药性金黄色葡萄球菌(MSRA)作用结果为,TP对13株MSRA的MIC为8~512 μg/mL,而当采用Oxacillin与≤0.5倍MIC复配时,Oxacillin的MIC 降低8~128倍[15]。Gordon 等人研究了EGCG对嗜麦芽寡养单胞菌的抑菌效果,当EGCG浓度为256 μg/mL 时,可杀死50%的嗜麦芽寡养单胞菌[16]。目前,已有研究者将其应用于水果、海鲜及肉制品的防腐保鲜方面[17-19]。但是对TP的抑菌机理还不清楚,有研究报道TP可作用于细菌微生物的磷脂双分子层[20]。本文实验通过结晶紫实验,电导率测定,离子泄漏实验研究TP对E.coli细胞膜通透性的影响,并研究TP对DNA的作用情况。
1 材料与方法
1.1 材料
茶多酚(≥98%)湖南金农生物股份有限公司;供试菌种(E.coli)由作者实验室保藏;菌种用LB培养基培养。
1.2 仪器与设备
AL204电子天平,瑞士梅特勒-托利多仪器有限公司;MApADA V-1100可见光分光光度计,上海美谱达仪器有限公司;京立/LG10-2.4A型高速离心机,北京京立离心机有限公司; 雷磁电导率仪ODS-307,上海精密科学仪器有限公司;DYY-6C型电泳仪,北京六一仪器厂。
1.3 方法
1.3.1 菌液制备
将E.coli活化后,接种于LB液体培养基,37 °C摇床培养过夜,使其活菌数达约108cfu/mL备用。
供试药剂:200 g/L草铵膦水剂,购自永农生物科学有限公司;农博士低容量施药专用助剂,购自广西田园生化股份有限公司。
1.3.2 最小抑菌浓度(MIC)测定
采用牛津杯法,用无菌移液器取上述各种菌悬液0.5 mL于平板上,然后用无菌涂布棒涂布均匀,待凝固后将直径为9 mm、已杀菌的牛津杯呈正三角形放置在每个平板上。采用二倍稀释法将TP配成质量浓度为10、20、40、80、160、320和640 μg/mL的水溶液。每个平板其中2个牛津杯内加入TP溶液,另一个加入无菌水作为空白对照。每个浓度TP重复3个平板,于37℃培养24 h,用透明直尺测量抑菌圈的直径。抑菌圈直径≥10 mm时认为有抑菌作用。
1.3.3 结晶紫试验
供试菌E.coli在37 °C下于LB液体培养基中培养至菌液浓度约为108cfu/mL。取3 mL菌液4500 r/min离心15 min,得菌体,用蒸馏水冲洗3次后重悬于3 mL含有不同浓度TP(40、80、160、320和640 μg /mL)的PBS缓冲液(0.05 M,pH值7.0)中,置于37℃下培养30 min。培养结束后8000 r/min离心5 min,得菌体重悬于含有10 μg/mL结晶紫的PBS缓冲液(pH值7.0)中37 °C下培养10 min,之后12000 r/min下离心15 min,收集上清液在OD590处使用紫外可见分光光度计测量吸光度(用0 μg/mL TP处理的作为对照组调零)。
1.3.4 电导率测定
通过测定TP与E.coli作用后电导率的变化研究TP对细菌细胞膜通透性的影响。将待测E.coli在37℃下于LB液体培养基中培养,使其菌落浓度约为108cfu/mL,取此菌悬液在转速为6000 r/min条件下离心15 min。将得到的菌体重悬于磷酸盐缓冲液(pH值7.0)缓缓的洗剂3次。加入不同浓度(40、80和160 μg/mL)相同体积的TP的液体,用无菌水代替TP作为对照组。然后放在37 °C的摇床振荡(150 r/min)培养,每隔20 min取出5 mL,在6000 r/min下离心5 min,用电导率仪分别测定菌液在0、20、40、60、80、100和120 min的电导率值。
1.3.5 离子泄漏的测定
将培养至菌液浓度约108cfu/mL的E.coli菌悬液离心,用无菌水洗涤3次,实验组加入TP至终浓度为4倍的MIC,以加入相同体积的无菌水作为对照组,在37℃、150 r/min的恒温摇床振荡培养,每隔20 min取出5 mL菌液,在6000 r/min下离心5 min,取上清液进行消化处理,然后用原子吸收光谱仪分别检测上清液中K+、Ca2+和Mg2+的浓度变化,并绘制曲线。
分别将培养至对数期E.coli在3000 r/min下离心15 min,收集沉淀进行分组实验。对照组A:取10 mgE.coli菌体悬浮于 PBS 缓冲液,37 °C保温 6 h后,提取DNA;实验组B1:取10 mgE.coli菌体沉淀物悬浮于80 μg/mL TP溶液,37 °C保温6 h后提取DNA;实验组B2:取10 mgE.coli菌体沉淀物悬浮于160 μg/mL TP溶液,37 °C保温6 h后提取DNA。DNA的提取按试剂盒提取步骤进行。根据DNA的分离范围选择1%的琼脂糖凝胶进行恒压70 V电泳,电泳完成后用凝胶成像系统进行观察。
2 结果与分析
2.1 TP对E.coli的最小抑菌浓度(MIC)

表1 TP对E. coli 的抑菌圈直径
由表1可知,随着TP浓度的增大,抑菌圈直径也随之增大;当TP浓度为40 μg/mL时,抑菌圈直径为(11±0.2) mm,此浓度即为TP的MIC。说明TP 对E.coli具有良好的抑菌活性。
2.2 结晶紫试验结果分析
通过测定E.coli对结晶紫的吸收,测定TP对E.coli细菌细胞膜通透性的影响。如图1所示:随着TP浓度的增加,OD590值逐渐增大;当TP的浓度为0~160 μg/mL的时候,OD590值从0增加到0.377,变化显著;当TP的浓度大于160 μg/mL的时候,OD590值从0.377增加到0.3835,可见变化不明显。结果表明TP 能够改变E.coli细胞膜的通透性,并且在TP浓度为160 μg/mL 时,作用效果最佳。
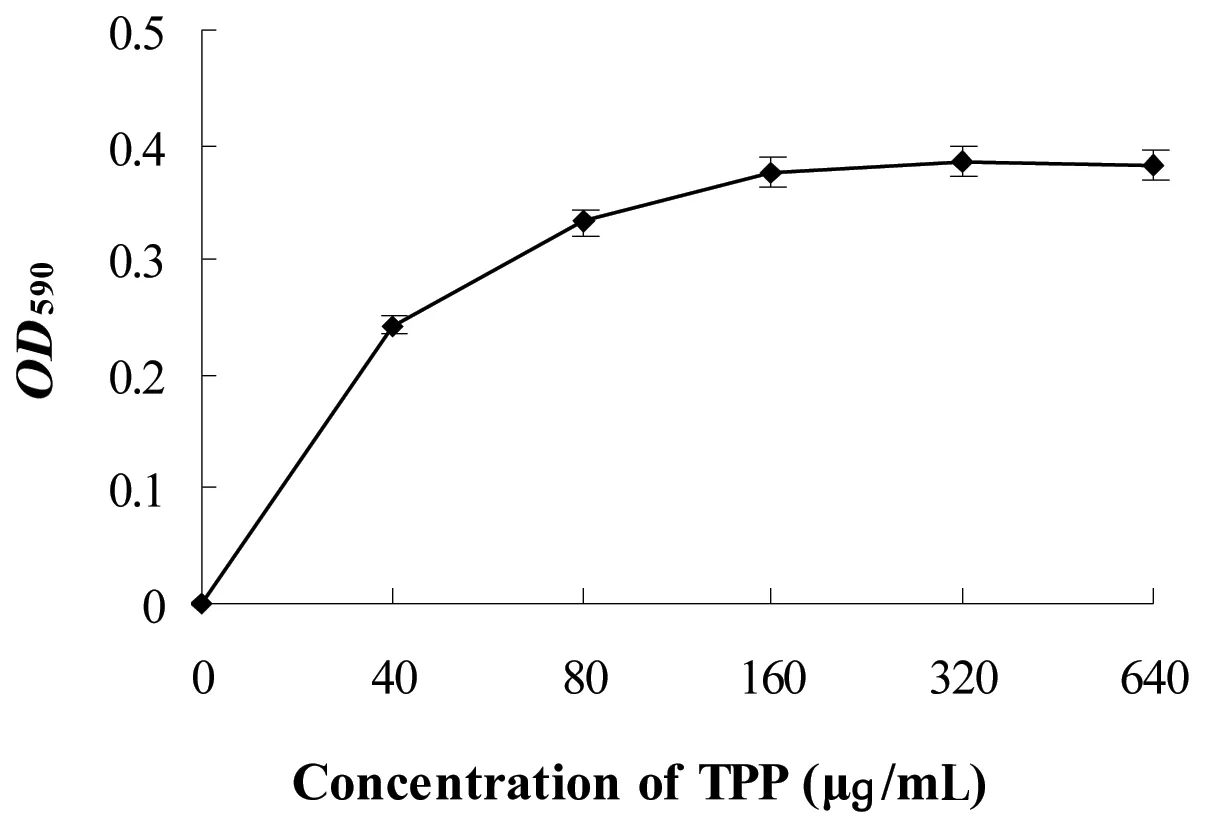
图1 不同TP浓度处理E. coli OD590的变化
2.3 电导率的变化
通过测定E.coli电导率的变化,研究TP对细菌细胞膜通透性的影响,电导率增加说明菌液的导电性增加,细胞内有带电离子等溶出,进而得出细胞膜的通透性增加。如果加入TP作用后,电导率发生变化说明了TP对细胞膜的通透性有影响。
◆—空白对照组;■—40 μɡ/mL TP;▲—80 μɡ/mL TP;●—160 μɡ/mL TP。
如图2所示,加入TP处理E.coli后电导率的变化趋势为:空白对照组随着时间的增加,电导率基本上没有变化;用TP处理的E.coli的电导率随着时间的增加逐渐升高;在相同的时间,随着TP浓度的增加,各组的电导率逐渐增加;用40 μg/mL TP 处理的E.coli的电导率与空白对照组相比变化较小,用80 μg/mL和160 μg/mL TP 处理的E.coli的电导率与空白对照组相比变化显著。由此可见,TP对E.coli细胞膜的通透性有影响,随着TP浓度的增大,TP对膜的通透性的影响效果有增加的趋势;在相同浓度条件下,随着时间的增加,TP对细胞膜通透性的影响也增加。
2.4 离子泄露的结果分析
用原子吸收光谱仪分别检测上清液中K+的实验结果如图3所示:随着处理时间的增加,空白对照组上清液中K+的浓度变化不大,呈现平稳的趋势,然而经过4倍MIC浓度的TP处理的E.coli的上清液中K+的浓度变化比较明显,处理30 min后变成17.02 μg/mL(此时空白对照组的值为4.68 μg/mL)。说明TP处理后能够引起E.coli内K+的泄露。
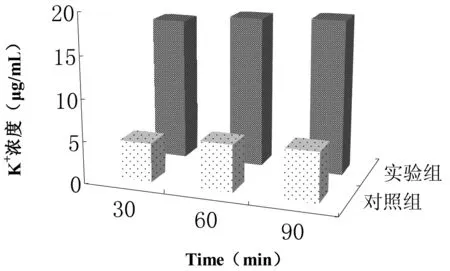
图3 不同处理时间K+的泄露程度

图4 不同处理时间Ca2+的泄露程度
图4为用原子吸收光谱仪分别检测的上清液中Ca2+浓度实验结果,可见用无菌纯净水处理的对照组的Ca2+浓度随着时间的增加基本上保持不变,在相同的时间段,用TP处理的菌体上清液中的Ca2+浓度比空白明显要大。用4倍MIC浓度的TP处理的Ca2+浓度在30 min时达到9.23 μg/mL(空白对照组为3.58 μg/mL),在60 min时为12.03 μg/mL(空白为4.32 μg/mL)。60 min以后随着TP作用时间的增加,上清液中Ca2+浓度基本上保持不变,说明可能此时细菌细胞膜的钙离子通道已经被破坏了,不再起作用,从而Ca2+浓度基本上达到平衡。

图5 不同处理时间Mg2+的泄露程度
用原子吸收光谱仪分别检测上清液中Mg2+的实验结果如图5所示:在30 min时,TP处理组的上清液的Mg2+浓度为1.53 μg/mL,空白对照组为1.036 μg/mL;60 min时,TP处理组的上清液的Mg2+浓度为2.32 μg/mL,而空白对照组为1.17 μg/mL;90 min时,TP处理后Mg2+浓度为2.76 μg/mL,而空白对照组为1.197 μg/mL。可见在相同的处理时间TP处理的E.coli上清液中的Mg2+浓度比空白对照组大,且随着时间的增加空白对照组的上清液中Mg2+浓度基本上保持不变,随着时间的增加TP处理的E.coli上清液中的Mg2+浓度逐渐增大。
由图3、4、5可知TP能够引起细胞内K+、Ca2+和Mg2+的泄露,证明了TP能够作用于E.coli的细胞膜,使细胞膜的通透性增加。
2.5 TP对细菌DNA的影响

图6 TP处理E. coli DNA的影响
对照组A—PBS 缓冲液;实验组B1—80 μg/mL TP溶液;实验组B2—160 μg/mL TP溶液。
用配制不同浓度的TP 处理E.coli6 h,然后利用试剂盒提取E.coli的DNA,并进行琼脂糖凝胶电泳,结果如图6。与空白对照组A相比,实验组B1和实验组B2变化比较明显,实验组B2与空白对照组A相比条带亮度变浅,并且实验组B2的条带出现了拖尾现象。结果证明,TP能够作用于E.coli的DNA。
3 结论
本文研究了TP对E.coli最小抑菌浓度,以及对细胞膜和DNA的作用。结果表明:TP对E.coli的MIC为40 μg/mL。通过测定结晶紫的吸收、电导率的变化、离子的泄露说明TP可以作用于E.coli的细胞膜,能够改变其通透性,能使细胞外的小分子容易进入以及引起细胞内的小分子物质泄漏;TP与E.coli作用后提取其DNA,进行琼脂糖凝胶电泳可观察到处理后菌体的DNA条带变暗甚至拖尾,说明TP能够作用于E.coli的遗传物质DNA。
[1]Hara-Kudo Y, Yamasaki A, Sasaki M, et al. Antibacterial action on pathogenic bacterial spore by green tea catechins[J]. Journal of the Science of Food and Agriculture, 2005, 85(14): 2354-2361.
[2]Hirasawa M, Takada K, Otake S. Inhibition of acid production in dental plaque bacteria by green tea catechins[J]. Caries Research, 2006, 40(3): 265-270.
[3]Yang C S, Hong J, Hou Z, et al. Green tea polyphenols: antioxidative and prooxidative effects[J]. The Journal of Nutrition, 2004, 134(11): 3181S-3181S.
[4]Yang C S, Jin H, Guan F, et al. Cancer precentive activities of tea polyphenols[J]. Journal of Food and Drug Analysis, 2012, 20(1): 318-322.
[5]Cho Y S, Oh J J. Antimicrobial activity and biofilm formation inhibition of green tea polyphenols on human teeth[J]. Biotechnology and Bioprocess Engineering, 2010, 15: 359-364.
[6]Yang D J, Chang Y Y, Hsu C L, et al. Antiobesity and hypolipidemic effects of polyphenol-rich longan (DimocarpuslongansLour.)flower water extract in hypercaloric-dietar rats[J]. Journal of Agriculture and Chemistry, 2010, 58: 2020-2027.
[7]Nakayama M, Suzuki K, Toda M, et al. Inhibition of the infectivity of influenza virus by tea polyphenols[J]. Antiviral Research, 1993, 21(4): 289-299.
[8]Okubo T, Ishihara N, Oura A, et al. In vivo effects of tea polyphenol intake on human intestinal microflora and metabolism[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(4): 588-591.
[9]Sakanaka S, Kim M, Taniguchi M, et al. Antibacterial substances in Japanese green tea extract againstStreptococcusmutans, a cariogenic bacterium[J]. Agricultural and Biological Chemistry, 1989, 53(9): 2307-2311.
[10]Sakanaka S, Aizawa M, Kim M et al. Inhibitory effects of green tea polyphenols on growth and cellular adherence of an oral bacterium,Porphyromonasgingivalis[J]. Bioscience Biotechnology and Biochemistry, 1996, 60:745 749.
[11]Sakanaka S, Sato T, Kim Met al. Inhibitory effects of green tea polyphenols on glucan synthesis and cellular adherence of cariogenic streptococci[J]. Agricultural and Biological Chemistry, 1990, 54:2925-2929.
[12]Hara Y. Antioxidants in tea and their physiological functions[M]. Springer: Food and Free Radicals, 1997: 49-65.
[13]Yanagawa Y, Yamamoto Y, Hara Y, et al. A combination effect of epigallocatechin gallate, a major compound of green tea catechins, with antibiotics onHelicobacterpylorigrowth in vitro[J]. Current Microbiology, 2003, 47(3): 0244-0249.
[14]Van Het Hof K H, Wiseman S A, Yang C S, et al. Plasma and lipoprotein levels of tea catechins following repeated tea consumption[J]. Experimental Biology and Medicine, 1999, 220(4): 203-209.
[15]Zhao W H, Hu Z Q, Okubo S, et al. Mechanism of synergy between epigallocatechin gallate and β-lactams against methicillin-resistantStaphylococcusaureus[J]. Antimicrobial Agents and Chemotherapy, 2001, 45(6): 1737-1742.
[16]Gordon N C, Wareham D W. Antimicrobial activity of the green tea polyphenol (-)-epigallocatechin-3-gallate (EGCG) against clinical isolates ofStenotrophomonasmaltophilia[J]. International Journal of Antimicrobial Agents, 2010, 36: 129-131.
[17]王玉婷, 邵秀芝, 冀国强. 大黄鱼冷藏过程中品质变化及腐败菌的分析及抑菌研究[J]. 肉类研究, 2010 (11): 11-15.
[18]刘开华, 豆成林. 涂膜保鲜剂中添加茶多酚对草莓贮藏品质的影响[J]. 中国食品添加剂, 2011 (4): 75-78.
[19]刘书亮, 夏静华, 叶劲松, 等. 三种天然保鲜剂对肉中腐败菌和致病菌的抑制效果[J]. 食品与发酵工业, 2010 (3): 46-50.
[20]Ikigai H, Nakae T, Hara Y, et al. Bactericidal catechins damage the lipid bilayer[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1993, 1147(1): 132-136.
Research on the antibacterial mechanism of tea polyphenols onEscherichiacoli
DONG Lu, DAI Zeng-ying, HAN Qing, LI Ying-qiu
(College of Food and Biological Engineering, Qilu University of Technology, Jinan 250353, China)
Tea polyphenols is an active material with broad-spectrum antibacterial action. In this paper, Oxford cup experiment was performed to study the minimal inhibitory concentration of TP onE.coli. Crystal violet assay, electrical conductivity test and ion leakage measurement were also performed to determine the effect of TP on cell membrane ofE.coli. Agarose gel electrophoresis was carried out to analyze the effect of TP onE.coliDNA. The results was the minimal inhibitory concentration of TP was 40 μg/mL. The value ofOD590increased with the increase of TP concentration. And the value of conductivity and ion leakage increased with the increase of time, which shown that TP could change cell membrane permeability. DNA ofE.colitreated with TP was extracted and compared with blank control group, the band of DNA of experiment group emerged dimmed and trailing, and this result indicated that TP can act on DNA ofE.coli.
tea polyphenols; antibacterial activity; antibacterial mechanism;Escherichiacoli
2014-08-05;
2014-09-01
董 璐,硕士,研究方向为食品生物技术;
李迎秋,博士,教授,研究方向为食品生物技术,E-mail:donglu1006@163.com。
TS201.3
A
2095-1736(2015)01-0072-04
doi∶10.3969/j.issn.2095-1736.2015.01.072

