接骨丹介导成骨细胞增殖促进骨折愈合的观察
翟献斌 吴方云
(山东省泰安市中医医院骨科,泰安,271000)
接骨丹介导成骨细胞增殖促进骨折愈合的观察
翟献斌 吴方云
(山东省泰安市中医医院骨科,泰安,271000)
目的:观察接骨丹对新西兰乳兔成骨细胞增殖的影响,探讨接骨丹促进骨折愈合的机制。方法:普通级新西兰大白乳兔,耳缘静脉空气栓塞处死,无菌条件下取颅盖骨,Ⅰ型胶原酶消化法获取成骨细胞并进行体外培养、鉴定及传代。将鉴定后的第二代成骨细胞随机分为正常对照组及实验组,正常对照组应用正常兔血清培养,实验组应用接骨丹含药血清培养,MTT法观测2组细胞的生长曲线;不同血清干预48 h后,倒置显微镜观测接骨丹对成骨细胞碱性磷酸酶及Ⅰ型胶原表达的影响,Elisa法观测接骨丹对成骨细胞培养上清液中骨钙素表达的影响。结果:Ⅰ型胶原酶消化法成功获取并建立成骨细胞体外培养体系,MTT观测显示实验组能够显著促进成骨细胞的增值,倒置显微镜观测实验组中碱性磷酸酶及Ⅰ型胶原的表达要优于正常对照组,并能够促进成骨细胞分泌骨钙素。结论:接骨丹能够促进骨折的愈合,其机制可能与促进成骨细胞中碱性磷酸酶、Ⅰ型胶原及骨钙素的表达进而促进成骨细胞增殖和分化有关。
接骨丹;含药血清;成骨细胞;骨折愈合
骨折是临床最常见的多发病,具有极其复杂的修复过程,受诸多因素的影响,包括患者本身因素,医源性因素等。从微观来看还受内分泌激素、生物化学和生物物理因子的调控和微量元素的影响。临床流行病学最新调查显示约5%~10%骨折可因各种原因发生骨折迟缓愈合和不愈合,因此临床针对如何促进骨折愈合、缩短愈合时间的研究方兴未艾。骨折属于中医学“血瘀证”的范畴,而骨科疾病首载于《黄帝内经》,认为骨折耗损气血,致其运行不畅,瘀积不散,因此“活血化瘀”是治疗骨折的核心治则。
接骨丹具有“祛瘀、生新、合骨”的作用,亦是治疗骨折的基本方剂,前期不乏研究证实接骨丹对骨折的治疗具有理想疗效,但关于接骨丹促折愈合的机理研究仍未明了,使得临床上应用接骨丹缺乏实验研究基础,因此本研究旨在观察接骨丹对体外培养的新西兰兔成骨细胞增殖分化的影响,从而为接骨丹治疗骨折提供基础数据。
1 材料与方法
1.1 材料
1.1.1 实验动物 10只普通级新西兰大白乳兔,雌雄各半,体重4.1~5.4 kg,平均(4.8±0.8)kg,购自军事医学科学院实验动物中心提供,动物合格证号为No.SCXK-(军)2007-004。
1.1.2 主要试剂 接骨丹(规格10 g/包,由山东省泰安市中医医院制剂室提供)并加工成每毫升含生药0.1 g的药液,密封4 ℃保存备用、DMEM培养基(美国Gibco公司);MTT(Sigma公司);山羊抗小鼠IgG标记二抗(Biosharp公司);DMSO(Sigma公司);ECL发光液(碧云天);β-acting(博奥森);胰酶(Biosharp公司);碱性磷酸酶、Ⅰ型胶原及BGP单克隆抗体(北京中杉)。
1.1.3 含药血清的制备 换算人与动物的药物等效剂量[1],人与新西兰兔的折算系数(W)为6.25,接骨丹等效给药剂量(g)=人体用药剂量(g/kg)×W×新西兰兔的体重(g)/1 000 g=(20 g/60 kg)×6.25×新西兰兔体重(g)/1 000 g。新西兰兔连续灌胃5 d,于最后一次灌胃后3 h腹主动脉采血,2 500 r/min离心25 min,于56 ℃水浴灭活30 min,过滤、分装,-20 ℃保存备用。
1.1.4 主要仪器 超净工作台(苏州安泰公司);CO2培养箱(日本SANYO公司);倒置显微镜(日本OLYMPUS);酶标定量测定仪(Thermo Multiskan AsCant公司);低温高速离心机(美国Sigma公司)。
1.2 方法
1.2.1 成骨细胞分离、培养、纯化、传代 普通级新西兰大白乳兔,耳缘静脉空气栓塞处死,无菌条件下取颅盖骨后立即置于预冷的0.01MPBS溶液中,将结缔组织剔除干净后再次使用0.01MPBS溶液清洗3次,随后将颅盖骨置于盛有DMEM培养基的培养皿中,用无菌剪刀将颅盖骨剪成大小约0.5 mm×0.5 mm的碎块,再加入5 mL 0.25%的胰酶消化20 min,随后加入5 mL完全培养基(10%胎牛血清)终止消化,摒弃上清液后加入10 mLⅠ型胶原酶,置于37 ℃、5%CO2孵箱中孵育90 min,随后离心1 000 r/min×3 min,弃去上清,再用0.01MPBS溶液清洗3次后利用200目滤网过滤颅盖骨碎片,加入5 mL完全培养基(10%胎牛血清),用巴士吸管轻轻吹大,使细胞悬浮,接种于培养瓶中,置于37 ℃、5%CO2孵箱中孵育,24 h换液,以后隔天换液1次,弃去没贴壁的细胞,继续培养,待细胞铺满瓶底80%以上时,以0.25%的胰酶消化传代,取第2代以后的细胞用于实验。
1.2.2 成骨细胞鉴定 细胞进入对数生长期后接种于干净无菌盖玻片上,正常培养,待细胞生长汇合率达到50%~80%时弃去培养液,PBS清洗1遍,丙酮:甲醇(1∶1)室温固定30 min,3%H2O2去离子水室温孵育10 min,封闭用山羊血清室温孵育30 min,滴加一抗4 ℃孵育过夜,滴加山羊抗小鼠IgG标记二抗37 ℃孵育30 min,避光,随后置于倒置显微镜下观察。每部操作之间均用PBS洗3×5 min。
1.2.3 MTT法测细胞增殖情况 将处于对数生长期的细胞密度调整为2×104个/ mL,接种于24孔板,37 ℃5%CO2培养箱培养,将实验分为正常组及实验组,各组6个复孔,24 h后用培养基进行同步消化24 h。正常对照组:给予不含药DMEM完全培养液;实验组:含体积分数为10%的接骨丹含药血清的DMEM完全培养液。分别于加药1、2、3、4、5、6、7、8、9、10 d后,每孔加入20 μL 5 g/L MTT,继续孵育4 h后,吸弃上清,每孔加入DMSO150 μL,振荡10 min,酶标仪在490 nm波长处读取OD值。
1.2.4 碱性磷酸酶及Ⅰ型胶原表达情况 将处于对数生长期的细胞密度调整为2×104个/ mL后制成细胞涂片,4%多聚甲醛40 ℃固定过夜,0.01M PBS充分冲洗、晾干,3%H2O2室温孵育20 min,0.01M PBS冲洗,滴加30 μL/片羊血清封闭液,室温30 min后倾去,滴加1∶100稀释的一抗30 μL/片(0.01M PBS稀释),置湿盒内4 ℃过夜,0.01M PBS洗(5 min×3),滴加1∶200稀释的生物素化二抗30 μL/片(0.01M PBS稀释),37 ℃湿盒内温育30 min,0.01M PBS洗(5 min×3),加辣根过氧化物酶标记的链霉卵白素30 μL/片,37 ℃孵育30 min,0.01M PBS洗(5 min×3),DAB显色,镜下观察显色后充分水洗,常规脱水、透明、中性树胶封片,随后置于倒置显微镜下观察。
1.2.5 骨钙素(BGP)的表达情况 干预成骨细胞48 h后,将收集的细胞在4 ℃条件下进行3 000 g离心5 min后用高压枪头吸取离心后的上清液,使用酶联免疫吸附试验(ELISA)进行检测,利用抗原、抗体的特异性反应与酶对底物的高效催化作用相结合原理进行相关因子浓度的检测,具体步骤如下:用0.05M pH9.6碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10 μg/mL。在每个聚苯乙烯板的反应孔中加0.1 mL,4 ℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3 min。加一定稀释的待检样品0.1 mL于上述已包被之反应孔中,置37 ℃孵育1 h。然后洗涤。同时做空白孔,阴性对照孔及阳性对照孔。随后在各反应孔中加入新鲜稀释的酶标抗体(经滴定后的稀释度)0.1 mL。37 ℃孵育0.5~1 h,洗涤。再于各反应孔中加入临时配制的TMB底物溶液0.1 mL,37 ℃10~30 min。于各反应孔中加入2M硫酸0.05 mL。试剂盒由广州达安基因股份有限公司提供,显色后采用492 nm波长,TMB反应产物检测需要450 nm波长。检测时一定要首先进行空白孔系统调零,用测定标本孔的吸收值与一组阴性标本测定孔平均值的比值(P/N)表示。以空白对照孔调零后测各孔OD值,若大于规定的阴性对照OD值的2.1倍,即为阳性。操作过程全部按照试剂盒说明书进行检测。
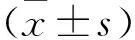
2 结果
2.1 成骨细胞的培养与鉴定 分离的成骨细胞在培养24 h后,活细胞贴壁生长,死细胞悬浮在培养液中。培养第5天,骨膜成骨细胞成放射状贴壁生长,形态多为梭形和多边形,核内可见两三个核仁,轮廓清晰,饱满透明,立体感强,培养10 d左右基本铺满整个瓶,见图1。
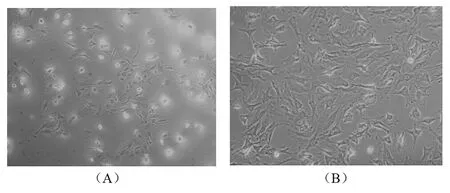
图1 第二代成骨细胞的镜下形态
注:A:第二代成骨细胞(100倍);B:第二代成骨细胞(200倍)
2.2 接骨丹含药血清对成骨细胞增殖的影响 MTT法检测发现:加入接骨丹含药血清培养后对成骨细胞具有明显的增殖作用,且呈现一定的时间依赖性,见图2。
2.3 接骨丹含药血清对成骨细胞中Ⅰ型胶原表达的影响 免疫组化染色显示,正常对照组及实验组中成骨细胞胞浆均呈棕黄色,其中可见黄褐色颗粒,细胞外也可见到棕黄色染色。与正常对照组比较,实验组中成骨细胞不仅数量增多,而且经免疫组化染色后其阳性表达颜色变深,见图3。
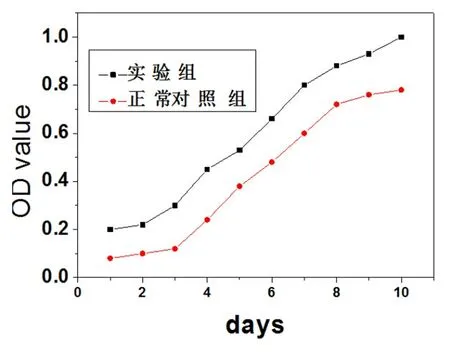
图2 接骨丹对成骨细胞增殖的影响

图3 Ⅰ型胶原免疫组化染色(200×)
注:(A)为实验组;(B)为正常对照组
2.4 接骨丹含药血清对成骨细胞中碱性磷酸酶表达的影响 免疫组化染色显示,正常对照组及实验组中成骨细胞中均有灰黑至深黑色的颗粒状或片状沉淀。与正常对照组比较,实验组中成骨细胞不仅数量增多,而且经免疫组化染色后其阳性表达颜色变深,见图4。

图4 碱性磷酸酶疫组化染色(200×)
注:(A)为实验组;(B)为正常对照组
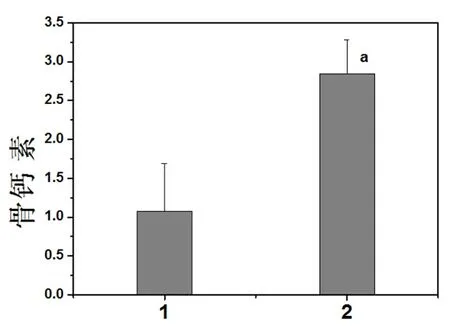
图5 48 h时各组成骨细胞培养上清液中骨钙素表达的比较
注:2为实验组成骨细胞培养上清液中骨钙素蛋白表达柱状图,与正常对照组比较aP<0.05。1:正常对照组;2:实验组
2.5 接骨丹含药血清对成骨细胞中BGP表达的影响 采用Elisa法检测成骨细胞培养上清液中骨钙素的表达,研究结果表明2组细胞上清液中均有骨钙素的表达,与正常对照组相比,实验组的骨钙素的表达明显增高(P<0.05),见图5。
3 讨论
自春秋战国时期起已有中医药治疗骨折的记载,中医角度认为骨折的愈合经历“瘀去、新生、骨合”三个环节,在整体观和辨证论治的指导下中医强调综合运用整复、外固定、练功及内外用药综合运用,此四大疗法随着现代医学进步而不断更新,其中内外用药已然成为各医家研究的重点[2-3]。中医理论认为肝主筋,肾主骨生髓,骨的生长愈合依赖精血的濡养,肝肾亏虚可导致骨生化无源,筋骨失养,而筋骨断损容易伤及肝肾,补肝益肾是促进骨折愈合的重点。接骨丹主要成分补碎骨、续断及杜仲均是补肝益肾之良药,共奏接骨续筋之功;龟甲、熟地黄滋阴降火,补肾健骨;自然铜接骨续筋;土鳖虫、乳香、没药活血祛瘀止痛合为臣药;云茯苓、白术、陈皮健脾和胃为佐使药。现代药理检测发现骨碎补具有促进蛋白多糖合成的效应,而蛋白多糖是促进钙化的主要因子,起通过加速钙磷沉积促进骨的生长发育[4];二氧化硫是自然铜的主要成分可加速骨痂形成及增强骨的抗撕力;有研究人员通过透射电镜发现土鳖虫提取物可以促进组织血管新生,促进骨周围组织的血供,促进肉芽组织的生长[5]。接骨丹全方实现活血养血、接骨连筋通络的功效。
近年来不少学者基于中医理论体系,以现代科学检测手段为媒介,从不同视角探讨中医药促进骨折愈合的机理[6-11]。以往不少报道从病理切片、影像学、血液流变学等宏观角度探讨干预手段促进骨折愈合的机理,近些年,随着分子生物学的日益发展,使从细胞水平探讨接骨丹作用机理成为可能。我们以成骨细胞为研究对象,成骨细胞是一类具有多向分化能力的充质干细胞,它的分化是骨形成的关键环节,因此促进成骨细胞的成骨功能是治疗骨折的基础。我们采用MTT法检测含有接骨丹血清对新西兰兔成骨细胞增殖的影响发现加入接骨丹含药血清培养后对成骨细胞具有明显的增殖作用,且呈现一定的时间依赖性。再进一步检测成骨细胞分化功能中我们检测了碱性磷酸酶在不同组别的表达,碱性磷酸酶是一种公认的鉴定成骨细胞分化的重要表型之一,成骨细胞分泌碱性磷酸酶可促使无机磷酸盐水解,从而减轻其对骨盐形成抑制效应,有利于骨形成。随着成骨细胞的不断分化碱性磷酸酶表达不断增加,碱性磷酸酶的活性越强预示着成骨细胞骨形成状况越理想[12-15]。研究中我们证实虽然不同组别均有碱性磷酸酶表达,但是经过含有接骨丹血清培养后的细胞碱性磷酸酶表达更明显,且Ⅰ型胶原表达越高,说明接骨丹可以通过促进碱性磷酸酶的合成、Ⅰ型胶原表达的增加而发挥诱导成骨细胞增殖分化。BGP是一种由成骨细胞合成和分泌的非胶原蛋白,其在调控软骨矿化发挥重要作用,研究中我们还发现含接骨丹血清可上调成骨细胞BGP的浓度,说明接骨丹提高了成骨细胞的矿化能力,促使胶原钙化,从而达到增加骨量的目的。
总之,接骨丹能够促进骨折的愈合,其机制可能与促进成骨细胞中碱性磷酸酶、Ⅰ型胶原及骨钙素的表达进而促进成骨细胞增殖和分化有关。
[1]李稻.医学功能学科实验原理与方法[M].北京:人民卫生出版社,2008,3:34.
[2]周正新,刘安平,王峰,等.接骨续筋胶囊促进骨折愈合作用的实验研究[J].中医药临床杂志,2008,20(2):124-126.
[3]周成刚.正骨丹促进骨折愈合疗效观察[J].中国中医骨伤科杂志,2003,11(1):19-21.
[4]宋渊.李盛华.何志军.骨碎补含药血清对成骨细胞增殖、成骨的影响[J].中国骨质疏松杂志,2014,3(2):45-47.
[5]许小志,徐志强,方耀忠,等.骨九方促进骨折愈合临床研究[J].新中医,2010,42(11):52-54.
[6]徐建平,郭文荣.骨折愈合影响因素及中医药治疗的研究进展[J].生物骨科材料与临床研究,2010,7(6):35-37.
[7]王力,郑甦,杨凤云,等.壮筋续骨汤对大鼠成骨细胞ALP比活性、BGP含量和Cbfl基因表达影响[J].中国中医骨伤科杂志,2008,16(12):24-26.
[8]王力,郑甦,杨凤云,等.壮筋续骨汤促进大鼠胫骨骨折愈合:RT-PCR法检测核心结合子a1基因表达的验证[J].中国组织工程研究与临床康复,2010,14(20):3678-3681.
[9]邹培.长骨液促进骨延长区骨矿化研究[J].中国骨伤,1998,11(5):15.
[10]陈伯仪.无名异冲剂促进去卵巢大鼠骨质疏松性骨折的机制研究[J].福建中医学院学报,2004,14(5):50-52.
[11]李红专.生骨再造散对家兔骨折愈合影响的实验研究[J].中国骨伤,2005,18(5):272-274.
[12]赖建章.补阳还五汤对兔骨折成份和生物力学性能的影响[J].中国中医骨伤科杂志,2001,9(4):32-33.
[13]张俐,杨宗宇.活血化瘀汤对大鼠骨折愈合过程中血清骨钙素和Ⅰ型胶原表达的影响[J].中国骨伤,2007,20(8):527-528.
[14]熊辉.桃红四物汤千预骨痴血管新生及VEGF表达的实验研究[J].中国医师杂志,2014,6(2):195-197.
[15]Yu,P.B.,Beppu,H.,Kawai,N.,Li,E.,and Bloch,K.D.(2005)Bone morphogenetic protein(BMP)type II receptor deletion reveals BMP ligand-specific gain of signaling in pulmonary artery smooth muscle cells[J].J.Biol.Chem,280,24443-24450.
(2015-05-12收稿 责任编辑:徐颖)
The Observation of Bone-Joining Elixir Mediated Osteoblast Proliferation to Promote Fracture Healing
Zhai Xianbin, Wu Fangyun
(DepartmentofOrthopedics,TaianChineseMedicineHospital,Tai'an271000,China)
Objective: To observe the effect of Bone-Joining Elixir on New Zealand newborn rabbit osteoblast proliferation, and explore the promoting fracture healing mechanism of Bone-Joining Elixir. Methods: Conventional grade New Zealand big and white newborn rabbits were put to death by ear venous air embolism, the craniums were taken down in aseptic conditions, and the osteoblasts were gained by collagenase type Ⅰ digestion method for in vitro culture, identification and passages. After identification, the second generation of osteoblasts was randomly divided into normal control group and experimental group. And the normal control group was cultured in normal rabbit serum, the experimental group was cultured in Bone-Joining Elixir medicated serum, MTT method was taken to observe the cell growth curves of the two groups. After the intervention for 48 h, the two serums were observed to achieve the influence of Bone-Joining Elixir on the expression of osteoblast alkaline phosphatase and collagen typeⅠ under the inverted microscope, and to achieve the influence of Bone-Joining Elixir on the expression of osteocalcin in the supernate in the osteoblast culture by Elisa method.Results: The osteoblast culture system in vitro has been successfully obtained and established by the collagenase type Ⅰ digestion method, MTT observation indicated the experimental group show significant promotion on the proliferation of osteoblasts, and the inverted microscope indicated the expression of alkaline phosphatase and collagen type Ⅰ in the experimental group was superior to the normal control group, and the osteoblast was promoted to secrete osteocalcin. Conclusion: The Bone-Joining Elixir can promote the healing of fracture, the mechanism may be related to the promotion of the expression of alkaline phosphatase, collagen type Ⅰ and osteocalcin in osteoblasts to help osteoblasts proliferate and differentiate.
Bone-Joining Elixir; Medicated Serum; Osteoblast; Fracture Healing
山东省中医药科技发展计划项目(编号:2011-284)
翟献斌(1970.2—),男,汉族,山东泰安人,副主任医师,本科学历,研究方向:中西医结合治疗脊柱病,E-mail:13853880212@163.com
R242
A
10.3969/j.issn.1673-7202.2015.10.033

