顺铂建立大鼠卵巢早衰模型的实验研究
张丽娟 陶仕英 赵丕文 冒湘琳
(北京中医药大学基础医学院,北京,100029)
实验研究
顺铂建立大鼠卵巢早衰模型的实验研究
张丽娟陶仕英赵丕文冒湘琳
(北京中医药大学基础医学院,北京,100029)
目的:探讨采用临床常用药物顺铂建立化疗性损伤卵巢早衰动物模型的方法。方法:通过观察阴道脱落细胞选取有正常动情周期的雌性SD大鼠60只随机分为正常组,低剂量组和高剂量组。按4 mg/kg和6 mg/kg分别给予低、高剂量组腹腔注射顺铂注射液,每周1次,连续2周。每天观察大鼠一般情况,体重,动情周期。取材后测定血清中E2、FSH、LH和Pro含量,光镜下观察卵巢病理组织形态变化。结果:体重下降,动情周期紊乱,动情间期延长。与正常比较,高、低剂量组E2水平不同程度降低,FSH、LH水平升高(P<0.05)。孕酮含量各组比较无统计学意义(P>0.05)。卵泡计数减少。结论:化疗药物顺铂可致大鼠卵巢功能明显衰退,卵泡发育障碍,生殖能力受损。为基础研究建立稳定的卵巢早衰动物模型提供一种操作简单,成功率高,结果可靠的实验方法。
顺铂;卵巢早衰;大鼠;动物模型
卵巢功能早衰(Premature Ovarian Failure,POF)是指妇女青春期发育后若在40岁前发生闭经、卵巢萎缩、体内雌激素水平低落、促性腺激素水平高达绝经期水平的现象。是常见的妇科内分泌疾病,近年来研究证实,由于卵巢早衰患者卵巢分泌的雌激素量减少,即可导致一些其他疾病,如骨质疏松、泌尿生殖道萎缩、脂质代谢紊乱、心血管类等疾病[1-4]。
顺铂是一种可以用来治疗多种肿瘤的化疗药物,但又有一定的不良反应,与卵巢的损害有直接关系[5-6]。有研究表明顺铂可诱导卵巢细胞凋亡,引起组织坏死,从而导致卵巢功能早衰[7-9]。本实验根据这一原理建立化疗性损伤卵巢早衰动物模型。
1 实验材料
1.1实验动物健康雌性SD大鼠60只,体重190~210 g,均为清洁动物,检疫合格,由北京维通利华实验技术有限公司提供。动物饲养在室温、自然光照的清洁级实验室内,食水充足。饲料为维通利华提供的普通大鼠饲料,饮水为去离子水。
1.2实验试剂注射用顺铂(CDDP),每支10 mg,由齐鲁制药有限公司生产,批号:H37021358。注射用顺铂用生理盐水配制成0.5 mg/mL,按4 mg/kg、6 mg/kg腹腔注射。FSH批号:2014120;LH批号:20140120;Pro批号:1220,厂家:北京北方生物技术研究所。E2批号:0120,厂家:深圳拉尔文。亚甲基蓝批号:A202031,国产。
2 实验方法
2.1实验对象筛选适应性喂养3 d后,对大鼠进行阴道脱落细胞学涂片,连续7 d光镜下观察,筛选出动情周期正常的60只健康雌性大鼠进入正式实验。随机分为正常组,低剂量组和高剂量组,每组20只。
2.2化疗性损伤卵巢模型的建立低剂量组和高剂量组分别按4 mg/kg、6 mg/kg腹腔注射顺铂注射液,正常组腹腔注射1 mL生理盐水。每周同一时间注射1次,连续2周。造模期间每天定时进行阴道涂片实验,观察动情周期的变化,以确定造模成功。
2.3观察大鼠情况每日观察并记录大鼠的进食进水情况,生命体征,行为活动及体毛变化。每日上午9点进行阴道涂片实验和体重测量。
2.4取材第2次注射7 d后,进行取材。大鼠腹主动脉取血,以3 000 r/min速度离心10 min,分离提取上层血清,存于-20 ℃冰箱待测。取大鼠双侧卵巢至于4%甲醛溶液中固定,经梯度酒精脱水、二甲苯透明、浸蜡、包埋,进行石蜡切片的制备。
2.5指标检测
2.5.1动情周期检测将棉签蘸取少量生理盐水徐徐插入大鼠阴道取少量分泌物,迅速在载玻片上朝单侧转动,滴少量亚甲基蓝溶液光镜下观察。
2.5.2激素水平检测采用放免检测FSH、E2、Pro和LH水平含量,实验步骤按照试剂说明进行试验。1)包被:用0.05 M PH9牰碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10 μg/mL。在每个聚苯乙烯板的反应孔中加0.1 mL,4 ℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,3 min/次。2)加样:加一定稀释的待检样品0.1 mL于上述已包被之反应孔中,置37 ℃孵育1 h。然后洗涤。(同时做空白孔对照)。3)加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体(经滴定后的稀释度)0.1 mL。37 ℃孵育0.5~1 h,洗涤。4)加底物液显色:于各反应孔中加入临时配制的TMB底物溶液0.1 mL,37 ℃10~30 min。5)终止反应:于各反应孔中加入2M硫酸0.05 mL。6)结果判定:在ELISA检测仪上,于450 nm处,以空白对照孔调零后测各孔值。
2.5.3HE染色观察各级卵泡1)脱蜡:将石蜡切片至于二甲苯I、II、III中各10 min进行脱蜡。2)复水:浸入梯度酒精和去离子水各3 min。3)染色:苏木素溶液中5~10 min冲洗,盐酸酒精分色3 s,冲水5~10 min反蓝。伊红溶液中1~3 min,蒸馏水洗2 s。4)脱水:95%乙醇I、II各5 s,无水乙醇I、II各5 min。5)固定:二甲苯I、II、III各5 min。6)封片:中性树胶封片,静置12 h。镜下观察各级卵泡。
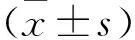
3 结果
3.1大鼠一般情况正常组大鼠活动、进食正常,体毛光滑有光泽,有正常的动情周期;不同剂量组大鼠给药后体重均有不同程度下降,行动缓慢,喜弓背、蜷缩,食欲下降,体毛晦暗无光泽,高剂量组更为明显。正常组大鼠注射生理盐水体重增加迅速且平稳,不同剂量组注射顺铂4 d后较正常组体重均有不同程度的下降,而高剂量组在注射顺铂8 d体重较低剂量组明显下降,各组大鼠体重变化(见图1)。

图1 各组大鼠体重变化对比柱状图
3.2不同剂量对大鼠动情周期的影响正常大鼠动情周期[10]4~5 d。分为四个阶段,动情前期:椭圆形有核上皮细胞占绝大多数,白细胞和角化上皮细胞很少。动情期:角化上皮细胞占多大多数,由散在增至集块,白细胞和有核上皮细胞很少。动情后期:片状角化上皮细胞,有核上皮细胞和白细胞3种都有,无太大差异。动情间期:白细胞占绝大多数,有核上皮细胞和角化上皮细胞很少(见图2)。低剂量组用药后动情周期紊乱,动情间期延长,动情缩短。但停用药1周后部分大鼠动情周期有所恢复。高剂量组大鼠动情周期延长,甚至长期停留在动情间期,不出现动情期。停药后1周动情周期没有恢复。
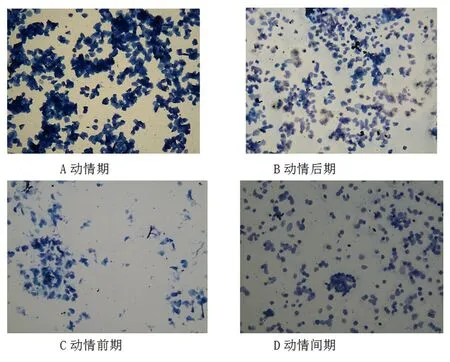
图2 光镜下40倍大鼠动情周期阴道涂片
3.3大鼠血清中LH、FSH、E2及孕酮含量的变化从表1可以看出,高剂量组与正常组比较大鼠血的FSH值升高有统计学意义(P<0.05),卵泡对FSH敏感度降低是卵巢功能衰退的早期征象[5]。低剂量组血清中FSH较正常组差异无统计学意义(P>0.05)。顺铂对大鼠血清中孕酮含量的影响,给药前后各组均无明显差异。E2水平在给药后2组差异均有统计学意义(P<0.05)。
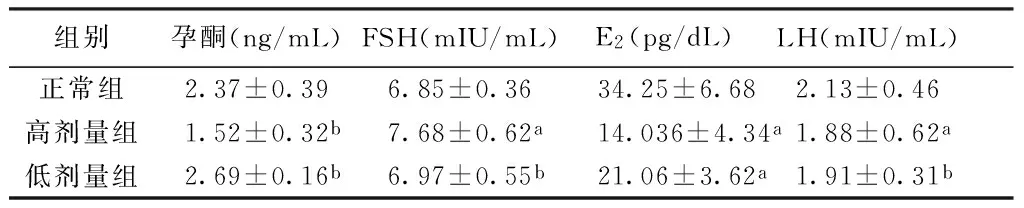
表1 大鼠血清LH、FSH、E2及孕酮含量
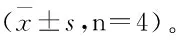
3.4各大鼠卵巢形态学影响正常组大鼠卵巢增大,各级卵泡生长活跃,可见各级卵泡,且大多数为原始卵泡、初级卵泡、次级卵泡和成熟卵泡,闭锁卵泡很少。且卵泡颗粒细胞层较多,卵泡液丰富,黄体发育较好。而低剂量组原始卵泡和初级卵泡减少,闭锁卵泡增加,黄体数量减少。高剂量组可见很少次级卵泡和成熟卵泡,大多数为闭锁卵泡,卵泡颗粒细胞层明显变薄,黄体明显减少。(见图3)
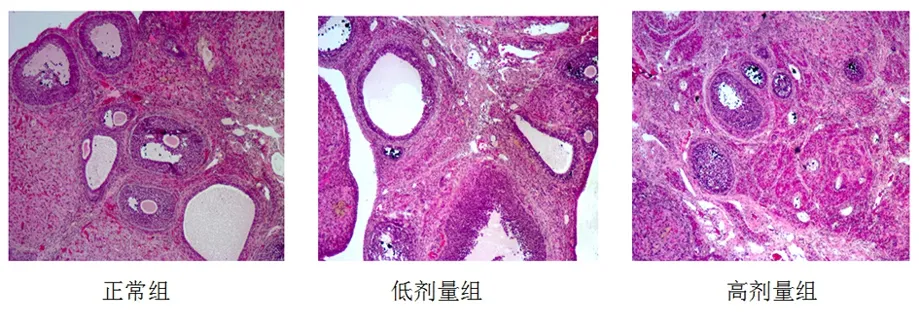
图3 光镜下40倍HE染色
4 讨论
卵巢早衰是一种多病因所致的卵巢功能衰竭,但其具体发病机理仍不清楚,所以模型研究是深入探讨疾病发生和发展的必要条件。有研究表明[11]顺铂对不同发育时期的卵泡有不同程度的损伤,并可导致血清中相应激素水平发生变化。因此本实验对化疗药物顺铂建立大鼠卵巢早衰模型方法及可行性进行探讨。
从实验结果可以看出:大鼠在给予顺铂造模后[12-13]表现为弓背、蜷缩,行动缓慢,食欲下降,体毛枯黄。阴道涂片显示:低剂量组用药后动情,动情周期延长,但停用药一周后部分大鼠动情周期有所恢复。高剂量组大鼠不仅长期停滞在动情间期,且行阴道涂片时可感到阴道松弛,偶见血性分泌物。以上表现与临床上妇女阴道成老年性改变相似。
FSH是检测卵巢早衰的常用指标,也用来判断损伤程度[14-15]。卵泡对FSH敏感度降低是卵巢功能衰退的早期征象[16-17],与临床上血虚型闭经相似[18]。本研究结果显示低剂量组大鼠血清中FSH水平较正常组有所升高,但无统计学意义(P>0.05);而高剂量组明显高于正常组,有统计学意义(P<0.05)。E2可促进卵泡生长,改善卵巢功能,造模后血清中E2水平都有所降低,高剂量组更为明显,自然导致卵泡发育,使卵巢受损。
卵巢功能完成的物质基础是初级卵泡的存在及发育,初级卵泡由原始卵泡发育而来,原始卵泡不能再生,他的破坏终将导致卵巢功能早衰[19-20]。实验结果高剂量组可见原始卵泡,次级卵泡和成熟卵泡显著减少,闭锁卵泡明显增加。提示:顺铂刺激了凋亡机制,导致大量卵泡停止发育继而凋亡。
综上所述,本实验研究给予大鼠不同剂量的顺铂注射后,卵巢功能出现不同程度的损伤,而高剂量组模型更为理想。本研究优势在于成功率高,模型稳定,资源易得,费用低廉,可作为探讨卵巢早衰发病机制的动物模型。
[1]马丽灵,阮祥燕.100例卵巢早衰相关因素的调查分析[J].实用妇产科杂志,2009,25(4):212-215.
[2]杨跃红,林建,易笑望.连续2-4年激素治疗卵巢早衰的疗效性和安全性观察[J].中国医师杂志,2005,7(7):997-998.
[3]金志春,黄晓桃,杨雅琴,等.补肾活血方联合雌激素治疗卵巢早衰的临床研究[J].中国中西医结合杂志,2013,33(5):0586-0589.
[4]腾秀香.卵巢早衰病因病机的中医学观点[J].北京中医医院院刊,2012,9(7):64-65.
[5]汪玉珍.导师王翠霞教授治疗卵巢早衰经验总结[J].辽宁中医药大学学报,2012,5(11):32-33.
[6]Yucebilgin MS,Terek MC,Ozsaran A,et al.Effect of chemotherapy on prinnorrlial follicular reserve of ral,an animal model of premature ovarian failure infertility[J].Aust NZJ Obstet Gynaecol,2004,44(1):6-9.
[7]柳友清,邢辉,韩晓兵,等.顺铂诱导宫颈癌Hela细胞凋亡及其作用机制的研究[J].中国肿瘤临床,2006,33(1):1-4.
[8]曲秀芬,王兵兵,张蕾,等.卵巢早衰的现代医学研究进展[J].中国妇幼保健,2009,24(7):1005-1007.
[9]周华,赵春梅.中西医治疗卵巢早衰临床研究述略[J].中医药学刊,2004,5(22):903-905.
[10]Shimoako T,Kamekura S,Chikuda H,et al.Impairment of bone healing by insulin receptor substrate-1 deficiency[J].J Biol Chem,2004,279(15):15314-15322.
[11]范燕燕,林守清,何仲,等.卵巢功能衰退过程中血清激素和卵巢大小的改变[J].中国妇幼保健研究,2012,23(2):9.
[12]曹金凤,郝红娟,王惠兰,等.顺铂、依托泊苷、长春新碱、博来霉素对人卵巢颗粒细胞影响及其机制[J].中国实用妇科与产科杂志,2012,28(11):835-838.
[13]Laura P,Suman R,Nafi D,et al.Anti-Müllerian hormone reduces follicle sensitivity to follicle-stimulating hormone in human granulosa cells[J].Fertil Steril,2011,96(5):1246-1251.
[14]王冰,蔡霞.抑制素B与卵巢早衰的研究进展[J].国际生殖健康/计划生育杂志,2009,28(3):184-186,193.
[15]Williams GT.Programmed cell death:apoptosis and oncogenesis[J].Cell,1991,65(7):1097-1098.
[16]Ray R,Chen G,Veide CV,et al.BNIP3 heterodimerizes with Bcl-2/Bax and induces cell death independent of a Bcl-2 homology 3(BH3)domain at both mitochondrial and nonmitochon-drial sites[J].Biol Chem,2000,275(2):1439-1448.
[17]Borovskaya TG,Goldberg VE,Fomina TI,et al.Morphologi-cal and functional state of rat varies in early and late periods[J].after administration of platinum cytostatics.Bull Exp Biol Med,2004,137(4):331-5.
[18]卢晓男,徐向荣,林丽君.补肾二仙汤治疗卵巢早衰的临床观察[J].中国中西医结合杂志,2008,28(7):594-596.
[19]王世阆.卵巢疾病[M].北京:人民卫生出版社,2004:3-16.
[20]李秀华,雷小敏.卵巢早衰与免疫[J].中国老年学杂志,2004,24(8):776-778.
(2014-09-28收稿责任编辑:张文婷)
Experimental study of Cisplatin in Establishment of Premature Ovarian Failure Model
Zhang Lijuan,Tao Shiying,Zhao Piwen,Mao Xianglin
(SchoolofBasicMedicalSciences,BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective:To explore the method of establishing animal model with premature ovarian failure due to chemotherapy damage by using cisplatin clinical medicine. Methods:According to the observation of vaginal exfoliated cells, we divided 60 female SD rats with normal estrous cycle into normal group, low dose group and high dose group randomly. Low dose group were given 4 mg·kg-1intraperitoneal injection of Cisplatin and high dose group 6 mg·kg-1respectively. The injection was given once a week and lasting for two weeks. The general conditions, weight, estrous cycle of the rats were observed every day. The serum levels of E2, FSH, LH and progesterone levels were detected after ovarian. The pathological and morphological changes were also observed under optical microscope. Results: Weight loss, estrous cycle disorder, anestrus prolongation were observed. Compared with normal status, the E2levels of both high and low dose group decreased in different degree, while FSH, LH levels elevated.(P<0.05). No significant difference of progesterone was observed in both groups(P>0.05). Follicle also decreased. Conclusion: The declination of ovarian function of rats with cisplatin chemotherapy drugs is obvious, follicle development and reproductive capacity are impaired, which provides a simple, high success rated, and reliable method for animal model with premature ovarian failure.
Cisplatin; Premature ovary failure; Rat; Animal model
国家自然科学基金项目(编号:81273887);教育部大学生创新性实验计划项目(编号:201310026056);北京中医药大学自主选题项目(编号:2013-JYBZZ-JS-006)
张丽娟(1987—),女,北京中医药大学2012级在读研究生,研究方向:中医妇科,E-mail:251197571@qq.com
陶仕英(1970—),女,博士,副教授,研究方向:从事中西医基础研究,E-mail:taoshiying1970@163.com
R285.5
A
10.3969/j.issn.1673-7202.2015.10.029

