miR—30d通过抑制自噬影响喉癌细胞的增殖和耐药性
汤俊照

摘要:研究miR-30d抑制喉癌细胞株人喉癌表皮细胞(Hep-2)的发展和耐药性的作用机制。方法收取手术后的患者样本,液氮法保存新鲜喉癌组织和正常喉组织,实时定量荧光PCR法检测喉癌组织和正常组织中miR-30d的表达量。在Hep-2细胞系中采用脂质体转染的方法转染miR-30d寡聚核苷酸、miR-NC无义序列以及BECN1质粒,生物信息学方法预测miR-30d潜在靶点,双荧光素酶报告基因法验证miR-30d的靶点,Western blot技术检测蛋白表达量,CCK-8法检测细胞增殖,流式细胞术检测细胞凋亡。结果喉癌组织组织与正常组织相比miR-30d表达量明显降低,并随着世界卫生组织规定(WHO)的临床分期级数增加而更加明显。转染miR-30d寡聚核苷酸序列后,miR-30d表达量较对照组明显上调,并且转染miR-30d后能明显抑制人喉癌细胞的增殖、自噬水平和耐药性。生物信息学预测发现BECN1是miR-30d的潜在靶点,并且双荧光素酶报告基因和Western blot进一步验证了BECN1是其靶点。此外,过表达BECN1能够逆转miR-30d对Hep-2增殖、自噬水平和耐药性的抑制作用。结论在喉癌组织中miR30d量表达明显下调;miR-30d能够抑制喉癌细胞Hep-2的增殖、自噬水平和耐药性;BECN1是miR-30d的靶基因;过表达BECN1能逆转miR-30d对喉癌细胞的影响;miR-30d是潜在的人喉癌细胞早期诊断和基因治疗的候选靶点。
关键词:MiR-30d;喉癌;自噬;BECN1
喉癌(LSCC)是头颈部最常见的恶性肿瘤之一,目前治疗喉癌的方式主要是手术和放疗,虽然近20年来喉癌的临床诊断和手术技术有了很大改进,但是由于喉癌临床用药的耐药性致使喉癌预后仍不甚理想[1-3]。MicroRNA(miR)是一种长度为18~25nt的单链非编码小分子RNA,miR的异常表达影响癌基因或者抑癌基因的表达从而影响肿瘤发生、发展和耐药等过程[4, 5]。自噬是细胞中普遍存在的生理机制,自噬在肿瘤发生、发展和肿瘤的耐药过程中起着重要的作用,目前许多研究表明miR能调节肿瘤自噬的水平来调节肿瘤的发生发展[6, 7]。BECN1 是形成自噬体的一个必需分子,它通过介导其它自噬蛋白定位于吞噬泡,来调控哺乳动物自噬体的形成与成熟,并且其通过调节自噬活性来影响肿瘤[8-10]。miR-30d在多种肿瘤里呈低表达并表现为抑癌作用[11],本研究探讨miR-30d对喉癌细胞株人喉癌表皮细胞(Hep-2)细胞增殖、自噬水平和耐药性的影响,并发掘其作用靶点,探究miR-30d抑制喉癌的分子机制。
1 资料与方法
1.1 一般资料 人喉癌细胞系Hep-2来源于美国ATCC细胞库。DMEM培养基购自Hyclone公司。胎牛血清(FBS)购自Clark公司。OPTI-MEM无血清培养基、胰酶和EDTA购自Gbico。miR-NC mimics、miR-30d mimics购自锐博生物有限公司。BECN1质粒购自addgene公司。转染试剂Lipofectamine 2000、Annexin V FITC凋亡检测试剂盒和TRIzol购自Invitrogen公司。CCK-8检测试剂盒购自日本同仁化学研究所。5-氟尿嘧啶( 5-fluorouracil,5-FU)购自sigma公司。M-MLV逆转录试剂盒、SYBR Premix Dimer EraserTM和Taq DNA 聚合酶购自TakaRa公司。TransStartFastPfu DNA Polymerase试剂盒购自北京全式金公司。胶回收试剂盒和质粒提取试剂盒购自Axygen公司。Dual-Luciferase Reporter Assay 试剂盒购自Promega公司。RIPA细胞裂解液和BCA蛋白检测试剂盒购自碧云天公司。PVDF膜购自whatman公司。ECL化学发光试剂购自Pierce公司。BECN1抗体和LC3抗体购自Sigma公司。GAPDH抗体购自Bioworld公司。
1.2方法
1.2.1细胞培养与转染 细胞按照推荐的培养方法,将细胞接种到六孔板。转染前细胞内加无血清细胞培养液,将所要转染的mimics或者质粒加入OPTI-MEM中轻轻混匀,同时将Lipofectamine 2000加入另一管OPTI-MEM中轻轻混匀,静置5min后,将上述两种溶液混合,室温孵育30min后吸去六孔板中的培养液,将上述混合液加入培养皿,随后轻轻混匀,细胞培养箱内培养3~6h后,吸除培养液,加入新鲜细胞培养液继续培养。
1.2.2 细胞增殖检测 将转染的Hep-2细胞消化,将细胞传代至96孔板,每隔24h检测细胞活性。用PBS十倍稀释CCK-8溶液,吸尽培养板中培养基,每孔加入1混匀的CCK-8稀释液。另取一孔加入CCK-8稀释液作为空白对照。将培养板放于培养箱内孵育1h后用酶标仪测定吸光度读值,波长设为450nm。
1.2.3 Real-time PCR 方法检测 Hep-2转染48h后加入足够的冷的PBS于在培养皿中,充分洗涤细胞,弃去PBS,重复以上操作2~3次。Trizol法提取RNA,测定浓度进行定量反转成cDNA。采用SYBR法进行Real-time PCR检测,采用2-△△Ct法分析实验结果。
1.2.4流式细胞仪检测细胞凋亡 细胞转染24h加入20μg /ml 5-氟尿嘧啶处理48h后消化并经PBS洗后收集细胞,1500r/min 离心5min,加入凋亡染料后送流式细胞检测。
1.2.5Western blot检测 细胞转染后48h将细胞消化后加入裂解液裂解,BCA法测定蛋白浓度制备1μg /ml的蛋白样品,20μl上样于质量分数为10% SDS-PAGE凝胶电泳分离蛋白,湿转于甲醇活化的聚偏二氟乙烯(PVDF)并用5%的脱脂奶粉室温封闭2~3h,一抗4℃过夜,PBST洗涤3次后二抗孵育2~3h,PBST洗涤三次后使用ECL显影,凝胶成像仪成像。
1.2.6荧光素酶报告基因质粒的构建和检测 设计荧光素酶报告基因质粒的引物为,用高保真酶FastPfu DNA Polymerase 进行PCR,PCR产物经胶回收、酶切、连接后转化进行菌落
鉴定和质粒提取,最后测序进行验证后得到目的质粒。将Hep-2细胞接种至24孔板,每孔8×104个细胞,将miR-30d mimics、miR-NC mimics、报告基因质粒和PGL4.74质粒转染至细胞内,24h后使用Dual-Luciferase Reporter Assay 试剂盒分析检测。
1.2.7统计学分析 数据经过至少3次独立实验取平均值进行分析,并进行t检验,采用方差分析,P<0.05为显著性差异。
2 结果
2.1 miR-30d在喉癌组织中低表达 使用实时荧光定量PCR法对38例喉癌组织和19例正常喉组织中miR-30d的表达量进行检测,发现与正常喉组织相比喉癌组织中miR-30d表达量明显下调(图1 A, P<0.05)。并且按照WHO临床分级标准对喉癌组织进行分级,发现随着临床分级水平提高miR-30d表达量下调越明显(图1 B, P<0.05)。
2.2miR-30d抑制喉癌细胞的增殖和自噬水平 将喉癌细胞株Hep-2脂质体转染的方式转染miR-30d mimics和miR-NC mimics,实时荧光定量PCR法检测转染效率,发现miR-30d表达量明显上调(图2 A, P<0.05)。将转染后的细胞消化接种至96孔板通过CCK-8检测增殖能力,发现miR-30d转染后明显抑制喉癌细胞的增殖能力(图2B, P<0.05)。同时对转染的细胞进行加5-Fu处理,流式细胞术检测发现miR-30d能够促进细胞凋亡从而增加喉癌细胞的化疗敏感性(图2 C, P<0.05)。并且通过Western Blot法检测发现miR-30d能抑制喉癌细胞的自噬水平,这提示miR-30d对喉癌细胞的抑制作用是通过其抑制其自噬水平来发挥作用的(图2 D)。
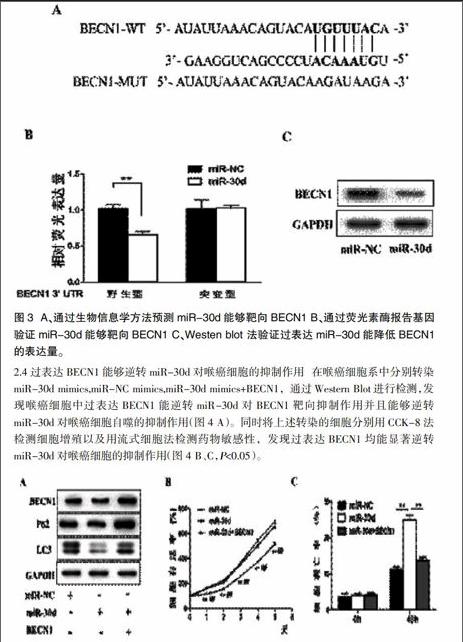
2.3miR-30d靶向抑制自噬相关蛋白BECN1的表达 通过生物信息学网站TatgetScan网站预测miR-30d能够靶向BECN13'UTR区域(图3 A),并且通过荧光素酶报告基因法验证miR-30d能够靶向抑制BECN1表达(图3 B,P<0.05)。同时Western Blot结果也表明在喉癌细胞系Hep-2中过表达miR-30d可明显下调BECN1的表达量(图3 C)。
2.4过表达BECN1能够逆转miR-30d对喉癌细胞的抑制作用 在喉癌细胞系中分别转染miR-30d mimics,miR-NC mimics,miR-30d mimics+BECN1,通过Western Blot进行检测,发现喉癌细胞中过表达BECN1能逆转miR-30d对BECN1靶向抑制作用并且能够逆转miR-30d对喉癌细胞自噬的抑制作用(图4 A)。同时将上述转染的细胞分别用CCK-8法检测细胞增殖以及用流式细胞法检测药物敏感性,发现过表达BECN1均能显著逆转miR-30d对喉癌细胞的抑制作用(图4 B、C,P<0.05)。
3 讨论
喉癌是喉部最常见的恶性肿瘤之一,在我国呈现一定区域性,临床治疗方法主要以手术为主化疗为辅,目前五年生存率仍然很低,需要发展更有效的治疗方案[12]。喉癌发病机制本质上是多基因异常表达,通过原癌基因的过表达,喉癌细胞异常增生和侵袭,并且对化疗药物产生耐药性[13, 14]。miR是近年来肿瘤研究领域较为热门的非编码RNA,它常通过靶向癌基因或者抑癌基因来调节癌细胞的发生发展,目前众多研究表明肿瘤的发生、发展与miR的异常表达有很大关联[15]。
自噬是细胞一种自我保护的机制,在肿瘤发生初期,自噬常表现为抑制肿瘤产生的作用,而当肿瘤形成后,肿瘤细胞中的自噬则表现为对其的保护作用,帮助肿瘤细胞抵御外界不良因素,表现为促进肿瘤增殖、增加药物耐受性等[16-18]。目前已有许多研究表明miR能通过调节肿瘤细胞的自噬水平来调控肿瘤细胞的发生、发展。肿瘤细胞中miR的异常表达导致肿瘤细胞自噬水平的紊乱,从而调控肿瘤的生物学功能[19-21]。
本研究发现miR-30d在喉癌组织中明显下调并且能通过靶向抑制自噬相关蛋白BECN1的表达来调节喉癌细胞的自噬水平从而抑制喉癌细胞的增殖和药物耐受性,过表达BECN1能够逆转这一过程。本研究部分揭示了miR-30d抑制喉癌细胞的部分机制,这为miR-30d成为临床早期诊断标记和研发治疗喉癌的分子靶向药物提供较好的提示作用。然而喉癌细胞的发生、发展机制是一个较为复杂的网络调控过程,未来仍然有许多问题需要我们去探讨。
参考文献:
[1] 曹影: miR-137对人喉癌细胞株Hep-2细胞增殖的影响. 硕士.南京医科大学; 2013.
[2] 王培蓓, 曹影, 马荧雪, 陈智斌: miR-193a-3p对人Hep-2喉癌细胞增殖、凋亡及侵袭的影响[J]. 江苏医药2014(08):875-878+864.
[3] 王友娟, 吴秋华, 杨娟, 罗松: miR-34c对人喉癌细胞株Hep-2细胞的影响[J]. 江苏医药2014(04):392-394.
[4] Tutar Y: miRNA and cancer; computational and experimental approaches[J].Current pharmaceutical biotechnology,2014, 15(5):429.
[5] 吴一波, 沈志森, 余星, 刘洋, 于雪林, 赵晓彦, 郭俊明: 喉癌相关miRNA的研究进展[J]. []基础医学与临床2012(05):583-586.
[6] 高雅, 邢皓, 于爱鸣: 自噬与肿瘤. 中国科技信息2012(14):115+136.
[7] 江龙洋, 白雪峰, 魏敏杰: microRNAs调控自噬研究进展[J]. 中国肿瘤临床2014(05):337-340.
[8] 陈圆圆, 刘宗亮, 颜峰平: 自噬基因Beclin1与肿瘤的研究进展[J]. 赣南医学院学报2014(03):485-487.
[9] 付俊, 尚海旭, 贾弘禔, 倪菊华: Beclin1与自噬及肿瘤的关系[J]. 生理科学进展2012(02):155-158.
[10] 李霞, 林瑶光: 自噬基因Beclin 1与肿瘤的关系. 中国癌症防治杂志2009(03):276-278.
[11] Li L, Wang B: Overexpression of MicroRNA-30b Improves Adenovirus-Mediated p53 Cancer Gene Therapy for Laryngeal Carcinoma[J].International journal of molecular sciences 2014, 15(11):19729-19740.
[12] 曹鹏宇: 喉鳞癌microRNA表达谱变化及miR-125b对喉癌Hep-2细胞增殖影响的研究. 博士.复旦大学; 2012.
[13] Tian L, Zhang J, Ge J, et al.MicroRNA-205 suppresses proliferation and promotes apoptosis in laryngeal squamous cell carcinoma[J].Medical oncology (Northwood, London, England) 2014, 31(1):785.
[14]Yu X, Wu Y, Liu Y, et al.miR-21, miR-106b and miR-375 as novel potential biomarkers for laryngeal squamous cell carcinoma[J].Current pharmaceutical biotechnology,2014, 15(5):503-508.
[15]Li W, Ma H, Sun J.MicroRNA34a/c function as tumor suppressors in Hep2 laryngeal carcinoma cells and may reduce GALNT7 expression[J].Molecular medicine reports,2014, 9(4):1293-1298.
[16] Huang L, Wang S, Li SS, et al.Prognostic significance of Beclin-1 expression in laryngeal squamous cell carcinoma[J].Pathology oncology research,2013, 19(4):771-777.
[17] Kang R, Wang ZH, Wang BQ, et al.Inhibition of autophagy-potentiated chemosensitivity to cisplatin in laryngeal cancer Hep-2 cells[J].American journal of otolaryngology,2012, 33(6):678-684.
[18] Pereira DL, Dos Santos Ferreira AC, de Faria GP,et alAutophagy Interplays with Apoptosis and Cell Cycle Regulation in the Growth Inhibiting Effect of Trisenox in HEP-2, a Laryngeal Squamous Cancer[J].Pathology oncology research,2014.
[19] Guo S, Bai R, Liu W, et al.miR-22 inhibits osteosarcoma cell proliferation and migration by targeting HMGB1 and inhibiting HMGB1-mediated autophagy[J].Tumour biology : the journal of the International Society for Oncodevelopmental Biology and Medicine 2014, 35(7):7025-7034.
[20] Lan SH, Wu SY, Zuchini R, et alAutophagy-preferential degradation of MIR224 participates in hepatocellular carcinoma tumorigenesis[J].Autophagy,2014, 10(9):1687-1689.
[21] Sun Q, Liu T, Yuan Y, G,et al.MiR-200c inhibits autophagy and enhances radiosensitivity in breast cancer cells by targeting UBQLN1[J].International journal of cancer Journal international du cancer,2014.编辑/康洁

