不同药剂处理对低夜温下番茄幼苗的影响
陈丽平,赵方贵,程 斐,杨延杰,陈 宁,李 敏*
(1.青岛农业大学园艺学院,山东青岛266109;2.青岛农业大学生命科学院,山东青岛266109)
随着蔬菜工厂化育苗的普及,降低低温期的加温成本成为非常突出的问题[1-4]。我国加温费用高,日光温室或大棚育苗在北方大部地区普遍存在昼温高、夜温低的现象[5-6]。为提高蔬菜幼苗夜间耐冷能力,笔者以育苗生产中重点蔬菜之一的番茄为研究对象,采用方便的药剂处理,旨在对比前人研究的几种提高耐冷性的药剂之间的差异[7-10],以及对番茄幼苗耐低夜温能力的影响,以期能为昼夜温差较大时生产高质量的番茄幼苗找到更简单易行的方法,从而降低蔬菜工厂化育苗的加温成本。
1 材料与方法
以草炭与珍珠岩(2∶1)为育苗基质,基质pH=6.5,常规温烫浸种催芽后播于72孔穴盘中。番茄在25~30℃条件下出苗,出苗7天后转入6~12℃的低夜温,两片真叶展平后对幼苗喷施浓度为50、100、200 mg/L的氯化钙(CaCl2)、水杨酸(SA)、硝普纳(SNP)和壳聚糖(CS),3 d 1次,共处理3次,清水为对照(CK),共13个处理,分别记为 CaCl250、CaCl2100、CaCl2200;SA50、SA100、SA200;SNP50、SNP100、SNP200;CS50、CS100、CS200及CK。处理7 d和15 d后测定幼苗的生长指标[干重、鲜重、相对生长率(RGR)],生理指标[叶绿素、丙二醛(MDA)、根系活力、细胞膜透性、超氧化物歧化酶(SOD)、可溶性蛋白和可溶性糖含量]。其中,相对生长率(RGR)=(ln w2-ln w1)/(t2-t1)。叶绿素采用SPAD-502 PLUS叶绿素测定仪,MDA含量采用TBA比色法测定,根系活力测定采用TTC法,细胞膜透性测定用电导仪法,SOD活性测定采用NBT法,可溶性蛋白含量测定采用考马斯亮蓝G-250法,可溶性糖含量测定采用蒽酮法[11]。数据采用DPS7.05数据处理软件进行处理。
2 结果与分析
2.1 不同药剂处理对低夜温下番茄幼苗生长量的影响 由表1可知,不同药剂处理都能在一定浓度范围内提高低夜温下番茄幼苗鲜干重的RGR,除SA、SNP外,促进作用都随药剂浓度升高而呈现先升后降趋势;其中,SNP200处理的鲜、干重的 RGR 最大,分别为105.18 mg/(g·d)和11.29 mg/(g·d),较CK增加31.98%和32.48%;CS100处理的鲜干重的RGR与之差异不显著;达到一定浓度(CaCl2200和SA100)后药剂处理有降低RGR的作用。SNP处理的RGR一直随浓度升高而增加;SA处理,随着浓度增加,鲜重相对变化量是下降的,干重稍有区别但大致也是下降的。

表1 低夜温下不同药剂处理的番茄幼苗鲜干重
2.2 不同药剂处理对低夜温下番茄幼苗叶绿素含量和根系活力的影响 由表2可知,不同药剂处理都能在一定浓度范围内增加低夜温下的番茄幼苗叶绿色含量,但是,各药剂作用效果随着浓度增加表现出不同的趋势。CaCl2逐渐下降,SNP逐渐增加,CS先升后降,SA低浓度效果较佳。其中,CS100和SNP200处理的叶绿色含量最高,分别为57.35和57.34,较 CK 增加8.33%和 8.31%;SA50 和 SNP100 处理的叶绿素含量差异不显著;达到一定浓度(CaCl2200和SA100)叶绿色含量下降。SNP处理的叶绿素含量一直随浓度升高而增加。

表2 不同药剂处理的番茄幼苗叶绿素含量和根系活力
不同药剂处理都能不同程度地增加低夜温下番茄幼苗的根系活力,增强了番茄幼苗根系活力;CaCl2和SA处理后番茄幼苗根系活力的增加都随药剂浓度升高呈先升后降趋势;其中SA100处理的根系活力最高,为89.25 mg/(g·h),较其他处理有显著差异,其次是CaCl2100、SNP50和SA50,这3个处理的根系活力无显著差异。而CS处理的根系活力一直随浓度升高而增加;SNP表现出低浓度效果较优。
2.3 不同药剂处理对低夜温下番茄幼苗SOD活性、可溶性蛋白和可溶性糖含量的影响 由表3可知,不同药剂处理对低夜温下番茄幼苗的SOD活性有显著的影响,均能在一定浓度范围内不同程度增加低夜温下番茄幼苗的SOD活性、可溶性蛋白和可溶性糖含量,SNP处理后SOD活性都随药剂浓度升高而呈先升后降趋势;其他药剂处理则逐渐下降,表现出低浓度促进效果明显。其中,CaCl250处理的SOD活性最高,为98.00 U/g,较CK 增加68.38%,其次是CaCl2100,但与之差异显著。浓度达到200 mg/L时,除SNP处理外,番茄幼苗的SOD活性都较CK显著下降。

表3 不同药剂处理的番茄幼苗SOD活性、可溶性蛋白和可溶性糖含量
药剂处理的可溶性蛋白含量都随药剂浓度的增加而呈先升后降趋势,SA逐渐降低,SNP逐渐升高。其中,CS100处理的可溶性蛋白含量最高,为15.43 mg/g,较 CK增加83.90%;其次是SNP200和SA50,且3者之间无显著差异。
SA和CS处理后番茄幼苗可溶性糖含量都随浓度升高而呈先升后降趋势,而CaCl2处理的可溶性糖含量随浓度升高而升高;SNP低浓度效果较佳。其中,SA100处理的可溶性糖含量最高,为27.73 mg/g,其次是CS100,二者之间差异不显著。
2.4 不同药剂处理对低夜温下番茄幼苗MDA含量和细胞膜透性的影响 由表4可知,不同药剂处理对低夜温下番茄幼苗MDA含量影响显著,其MDA含量都较CK有不同程度地下降。其中,CS100处理的 MDA含量最低,为24.00 μmol/g,较 CK 下降了 28.72%,其次是 SA50、SNP100 和SNP200,三者无显著差异。SNP处理的MDA含量随浓度升高而下降。

表4 不同药剂处理的番茄幼苗MDA的含量和细胞膜透性
SA50处理的细胞膜透性最低,为0.350,较CK下降24.41%;其次是SNP100、CaCl2200和CS200,且3个处理间无显著差异。
2.5 低夜温下番茄幼苗的相对生长率与各项生理指标的相关性分析 由表5可知,低夜温下,番茄幼苗鲜重的RGR与叶绿素、MDA含量呈极显著相关,与可溶性蛋白呈显著相关;干重的RGR与叶绿素、可溶性蛋白和MDA含量呈极显著相关,与SOD活性显著相关;干重的RGR与叶绿素含量、SOD活性和可溶性蛋白含量呈正相关,而与MDA含量呈负相关。综合考虑,可以确定叶绿素含量和MDA作为番茄幼苗在低温下的首要抗冷指标,其次为可溶性蛋白含量,最后是SOD活性。

表5 低夜温下的番茄幼苗RGR与各项生理指标的相关性
2.6 增强番茄幼苗耐冷性药剂种类和药剂浓度的筛选 由表6 可知,番茄幼苗的 RGR(鲜)和 RGR(干)都是 SNP200 和CS100处理最好。生理指标中,CS100、SNP200和SA50处理的叶绿素、MDA和可溶性蛋白含量表现最佳,且3者间无显著差异。SNP100的叶绿素和MDA含量较前3个处理无显著差异,但可溶性蛋白含量与CS100差异显著;SOD活性最高的是CaCl250,其他各处理差异不显著,综合考虑生长指标和生理指标及其相关性高低,SNP200和CS100两个处理对增强番茄幼苗耐冷性效果最好,其次是SA50和SNP100。
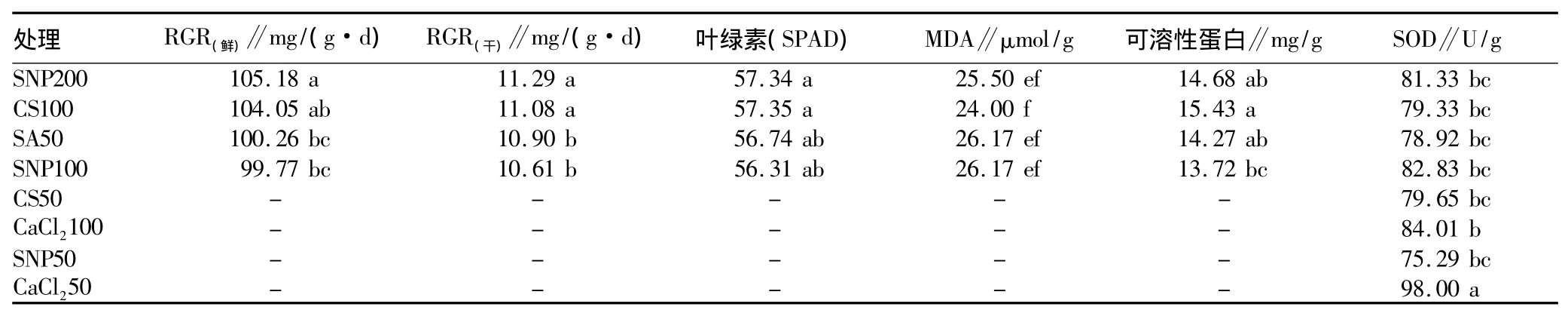
表6 药剂和浓度筛选
3 结论与讨论
番茄育苗生产中最普遍的问题就是低夜温造成的损害,增强番茄幼苗在低夜温下的耐冷性对节约番茄的育苗成本非常重要[1-4]。已有研究侧重药剂对蔬菜抗冷性的影响,但是对药剂之间的差异进行比较的不多[7-10]。笔者研究发现CaCl2、SA、SNP和CS都有促进番茄幼苗耐低温的作用,但促进效果有一定差异。
植物生长初期体量较小,取样造成的误差较大[12],鲜干重等指标不易体现其生长状况,而相对生长率则能较好地体现一段时间内植物生物量的增长快慢[13]。该研究的结果表明所采用的4种药剂都能不同程度地促进低夜温下番茄幼苗的相对生长率,与已有研究结果相似[7-10,14-15]。
药剂处理在一定程度上影响低温下番茄幼苗的一些生理指标[16-17]。该研究发现 CaCl2、SA、SNP 和 CS 4 种药剂在一定浓度范围内均能增加低夜温下番茄幼苗的叶绿素、可溶性蛋白和可溶性糖含量,提高番茄幼苗的根系活力和SOD活性,降低MDA含量和细胞膜透性,与已有的研究结果相似[9,16-18]。但不同的药剂种类及不同的浓度对众多的生理指标的影响表现各不相同,究竟如何选择生理指标做为耐低温的指标,在已有研究中所见较少[7,19]。该研究以能体现番茄幼苗生物量变化快慢的鲜干重的相对生长率为因变量,分析7个生理指标与相对生长率之间的相关性。结果表明,番茄幼苗的叶绿素含量、MDA含量与其鲜干重的相对生长率都呈极显著相关;可溶性蛋白含量则与干重的相对生长率呈极显著相关而与鲜重的相对生长率呈显著相关;SOD含量与干重的相对生长率呈显著相关而与鲜重的相对生长率无显著相关性;其他生理指标如根系活力、可溶性糖、细胞膜透性则与相对生长率无显著相关。这一结果与王之焕等[17]、刘晓宇等[17]、李俊等[20]的研究结果不同,可能与这几个生理指标的测定方法有关,在操作过程中易出现误差干扰。SOD也存在同样的问题,作为耐低温指标来说欠缺稳定性[19-20]。因此认为,叶绿素含量和MDA含量更适合于作耐冷指标,其次是可溶性蛋白。
该研究表明,SNP200和CS100处理的番茄幼苗在相对生长率、叶绿素含量及MDA含量等指标中都较CK有显著变化,明显表现出耐低温能力提高,其次是SA50和SNP100处理的结果。整体结果表明SNP200和CS100处理的番茄幼苗耐冷能力提高最大。但从各个指标随浓度变化的反应来看,SNP在50~200 mg/L范围内变化时,各个生长、生理指标(RGR、叶绿素、可溶性蛋白和MDA)出现先升后降的情况较少,并且先升后降的幅度也较其他药剂要小(根系活力、可溶性糖),说明SNP对促进番茄幼苗耐冷性的作用范围较宽泛,在很大浓度范围内都能促进番茄幼苗耐冷性的提高。由此可见,SNP不容易因浓度问题而产生药害,更适合在生产上应用、更易于操作。
[1]吴建军.设施蔬菜育苗存在的问题及其技术[J].现代农业科技,2011(1):145,147.
[2]郭孟报,杨明金,刘斌,等.我国蔬菜育苗产业现状及发展动态[J].农机化研究,2015(1):250-253.
[3]张昆.蔬菜工厂化育苗产业发展研究[J].农业科技与装备,2015(1):74-75.
[4]宗晓琴.山西省蔬菜集约化育苗生产现状及对策[J].农业技术与装备,2007(7):26-28.
[5]曹新荣,陈红.蔬菜育苗生产中常见的问题及预防对策[J].新疆农业科技,2008(3):49.
[6]尚庆茂.创新与发展——中国蔬菜集约化育苗[J].蔬菜,2011(9):1-3.
[7]李延军,王丽丽,蒋欣梅,等.外源水杨酸诱导对番茄幼苗抗冷性的影响[J].东北农业大学学报,2006,37(4):463 -467.
[8]薛国希,高辉远,李鹏民,等.低温下壳聚糖处理对黄瓜幼苗生理生化特性的影响[J].植物生理与分子生物学学报,2004,30(4):441 -448.
[9]唐宽强,刘守伟,吴凤芝,等.外源喷施CaCl2对低温逆境下番茄抗冷性及开花结果的影响[J].北方园艺,2013(11):10-14.
[10]肖春燕,邢潇晨,刘会芳,等.低温下NO对黄瓜光合荧光及抗氧化特性的影响[J].核农学报,2014,28(6):1083 -1091.
[11]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12]宗学凤,王三根.植物生理研究技术[M].重庆:西南师范大学出版社,2011.
[13]张振贤,程智慧.高级蔬菜生理学[M].北京:中国农业大学出版社,2008.
[14]ZHUGW,ZHOUT,YAOS.Effects of chitosan and Salicylic acid an cold resistance of litchi under low temperature[J].Agricultural science &technology,2011,12(1):26 -29.
[15]谢冬娣,石贵玉,岳君.壳聚糖对苦瓜种子萌发和幼苗生长的影响[J].广东农业科学,2006(6):33 -35.
[16]于秀针,张彩虹,姜鲁艳,等.外源NO对低温胁迫下番茄种子萌发和幼苗生长的影响[J].北方园艺,2014(22):5-8.
[17]王之焕,于英梅,张晓明.低温弱光下壳聚糖对番茄幼苗生理指标的影响[J].吉林农业大学学报,2011,33(1):42 -46.
[18]刘晓宇,明霞,杨威.壳聚糖混剂对番茄幼苗生理特性的影响[J].河南师范大学学报(自然科学版),2008,36(6):117 -119.
[19]廉洁,谷建田,张喜春.氯化钙对低温胁迫下番茄幼苗的影响[J].中国农学通报,2015,31(16):47 -51.
[20]李俊,李建明,胡晓辉,等.亚精胺浸种对番茄幼苗抗盐碱的生理特性研究[J].西北植物学报,2012,32(9):1788 -1791.

