钝顶节旋藻高产藻株的诱变选育*
刘 奇,臧晓南,张学成
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东 青岛 266003)
研究简报
钝顶节旋藻高产藻株的诱变选育*
刘 奇,臧晓南,张学成**
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东 青岛 266003)
本文运用亚硝基胍(Nitrosoguanidine,NTG)诱变,并结合乙酰辅酶A羧化酶抑制剂喹禾灵筛选,获得了2株能够稳定遗传的高产钝顶节旋藻突变株623-8和623-16。与钝顶节旋藻出发株623相比,突变株的藻丝更长,更易聚集成团。在pH=8.5、光照强度45μmol·m-2·s-1和培养温度28℃的条件下,突变株623-8和623-16的生物量分别比出发株提高67.86%和46.43%。蛋白含量分别比出发株623提高1.98%和0.84%;脂类含量提高8.54%和4.88%;乙酰辅酶A羧化酶活性提高31.82%和11.36%。研究结果表明,以亚硝基胍诱变结合喹禾灵筛选,可筛选出生长速度快、蛋白含量高等性状优良的钝顶节旋藻藻株,在工业生产中有实用意义。
钝顶节旋藻;亚硝基胍;诱变;喹禾灵
钝顶节旋藻(Arthrospiraplatensis)属于蓝藻门(Cyanophyta)、蓝藻纲(Cyanophyceae)、颤藻目(Oscillatoriales)、颤藻科(Oscillaoriales)。藻体为多细胞排列而成的丝状体,弯曲呈螺旋状,无分支。节旋藻的蛋白质含量高达60%~72%,还含有多种维生素、氨基酸和矿物质[1],有很好的提高免疫力[2]、抗肿瘤[3-4]、抗辐射[5]和抗病毒[6]的功能,被世界粮农组织誉为21世纪人类最理想的食品[7]。节旋藻于1980年代初引入中国,经过30多年的发展,节旋藻养殖及相关产业已经成为我国最大的微藻生物技术产业群[8]。
从1960年代以来,因商业化的需要,人们通过自然筛选与诱变育种,选育出一系列生长迅速,蛋白含量高,抗逆性强的节旋藻藻株。诱变育种可以在短时间内获得优良突变体作为新品种直接利用或作为种质资源间接利用,具有自然筛选难以替代的优点[9]。李建宏等采用紫外诱变的方法筛选获得了2株性状优良且稳定的钝顶螺旋藻突变株,与出发株相比,突变株的生长速度和光合放氧速率均有显著提高,藻蓝蛋白含量提高20.2%[10]。Lanfaloni等用紫外线和亚硝基胍诱变钝顶节旋藻,获得抗8-氮鸟嘌呤或抗β-(2-噻嗯基)-DL氨基丙酸的抗性突变株,并从紫外线诱变处理藻株中分离得到氯酸盐抗性突变株[11]。赵萌萌等用不同剂量的He-Ne激光照射钝顶螺旋藻,与出发藻株相比,突变藻体在形态、干重、蛋白质、β-胡萝卜素和胞外多糖等方面都有不同程度的变化,其中β-胡萝卜素含量增幅18.1%[12]。赵炎生等利用倍频Nd:YAG激光诱变钝顶螺旋藻,选出光合作用较强的藻株,其藻体蛋白质含量增加12%,胞外多糖分泌量提高24.6%[13]。汪志平等用甲基磺酸乙酯(EMS)和60Co-γ射线处理钝顶螺旋藻的单细胞或原生质球,得到了4株多糖含量分别比出发品系高32.8%、17.3%、23.4%和42.3%的形态突变体[14]。张学成等用甲基磺酸乙酯诱变处理钝顶节旋藻,筛选得到2株耐低温的藻株[15]。韩岚等用紫外诱变极大节旋藻,获得2株耐低温品种,突变株的胡萝卜素和不饱和脂肪酸的含量也比出发藻株明显提高[16]。
本实验采用亚硝基胍(1-methyl-3-nitro-1-nitroso-guanidin,NTG)作为诱变剂,以除草剂喹禾灵(Quizalofop-Ethyl)作为筛选压力对钝顶节旋藻进行选育。对出发株和突变株形态特征、生长速度、蛋白含量、油脂含量和乙酰辅酶A羧化酶酶活性进行比较,并对pH、光照和温度等培养条件进行探索。为工业生产提供高品质的钝顶节旋藻藻种提供实验基础。
1 材料和方法
1.1 藻种及其培养
本实验选用的出发藻株为青岛黄岛养殖厂筛选出的钝顶节旋藻藻株(Arthrospiraplatensis),编号623,具有生长迅速,上浮性好的特点,但藻丝短,不易聚集成团,不易采收。培养条件为温度24℃,光照强度为45μmol·m-2·s-1,光暗周期为12h:12h,Zarrouk培养基[17],每3d将原藻液和新鲜Zarrouk培养基按照1:1的比例混合,对藻种进行活化,活化3次后进行后续实验。
1.2 试剂
亚硝基胍(NTG)母液 0.8g亚硝基胍(TCI公司产品)溶于8mL丙酮,然后加72mL pH6.0磷酸缓冲液,终浓度为10g/L。
喹禾灵(Quizalofop-Ethyl)母液 10mg喹禾灵(SIGMA-ALDRICH公司产品)溶于加入助溶剂的蒸馏水中,终浓度为10g/L。
1.3 方法
1.3.1 吸光度-生物量关系的确定 取活化的藻液按OD560=0.1接种于新鲜Zarrouk培养基中连续进行培养,2d测1次OD560并取150mL藻液过滤,冷冻干燥后称重,以OD560对生物量关系作图,确定吸光度与生物量(g/L)之间的关系。
1.3.2 亚硝基胍诱变预实验 将亚硝基胍母液加入pH=6.0磷酸缓冲液至终浓度为0.05g/L,处理活化后的藻体,设置处理时间梯度为0、0.5、1、1.5和2h,并设置空白对照,每组设置3个平行样。诱变结束后用新鲜Zarrouk培养基冲洗藻体以除去亚硝基胍,避光培养24h后,取100μL藻液涂布在Zarrouk固体培养基上,培养10d,统计藻落数量,计算亚硝基胍处理时间与节旋藻致死率之间的关系。
1.3.3 喹禾灵筛选预实验 将喹禾灵母液加入未凝固的Zarrouk固体培养基中混匀,设置浓度梯度,分别为0、0.1、0.5、1.0、2.0、5.0μmol/L,每组设置3个平行样,将100μL活化后的藻液涂布在设置好喹禾灵浓度梯度的Zarrouk固体培养基上,培养10d,统计藻落数量,计算喹禾灵浓度与钝顶节旋藻致死率的关系。
1.3.4 突变株筛选 依照实验1.3.2和1.3.3的结果选择最佳的亚硝基胍诱变条件和喹禾灵筛选浓度,连续大量进行亚硝基胍诱变和喹禾灵筛选。从平板上挑选生长状态比较良好的藻落转入96孔板继续培养,选取生长迅速的藻株进行后续实验。
1.3.5 突变株生长曲线测定 将实验1.3.4筛选出的优良藻株和出发株按OD560=0.1接种于新鲜Zarrouk培养基中连续进行培养,培养条件为24℃、光照强度45μmol·m-2·s-1、pH=8.5,每株设置3个平行样。每2d测定OD560,以OD560对时间关系作图,比较各个藻株生长速度的差异,筛选出1~2株生长速度最快的藻株。
使用Dual-PAM-100测量出发株和突变株在24℃、光照强度45μmol·m-2·s-1、pH=8.5的培养条件下,PSⅡ的最大光能转化效率(Fv/Fm)并进行比较,通过分析各个藻株的潜在最大光合能力对生长曲线进行验证。
1.3.6 出发株与突变株的形态特征观察 根据实验1.3.5的实验结果,筛选出1~2株生长速度快的突变株,使用OLYMPUS BX41显微镜对其形态特征进行观察,并随机挑选50条藻丝,拍摄照片,使用显微镜自带的图像处理软件中的标尺测量藻丝长度,螺距,螺旋直径,螺旋数等数据,进行统计分析。
1.3.7 蛋白含量测定 出发株与筛选出的突变株每株设置3个平行样,每个样品取0.5g冷冻干燥后的藻粉,用凯氏定氮法测定蛋白含量[18]。
1.3.8 总脂含量测定 出发株与筛选出的突变株每株设置3个平行样,每个样品取0.5g冷冻干燥后的藻粉,超声破碎后加入20mL丙酮抽提油脂,最后使用旋转蒸发法分离溶剂和油脂,测定总脂含量。
1.3.9 乙酰辅酶A羧化酶活性测定 参照卢永忠的方法[19],每株设置3个平行样,提取出发株与筛选出的突变株的粗酶液,与乙酰辅酶A反应生成丙二酸单酰辅酶A,反应相同时间后使用离心超滤的方法分离酶与产物,最后用丙二酸单酰辅酶A ELISA试剂盒确定丙二酸单酰辅酶A浓度,推算乙酰辅酶A羧化酶活性。
1.3.10 突变株培养条件优化 选择光照强度、温度、pH进行单因子实验的结果,设置光照强度梯度为70、45、30μmol·m-2·s-1;温度梯度为24、28、32℃;pH梯度为8.5、9.5、10.5。然后对光照强度、温度、pH和藻株进行4因素3水平正交试验。每组设置3个平行样,培养6d后测定OD560,确定藻株培养的最佳条件。
按照以上条件对光照强度、温度、pH和藻株进行4因素3水平正交实验。分别测定各组的蛋白含量、乙酰辅酶A羧化酶活性及总脂含量。分析各性状指标与藻株间的关系。
2 结果与分析
2.1 节旋藻培养液吸光度-生物量关系的确定
由图1可知,OD560在0.100~2.000之间,节旋藻培养液560nm波长的吸光度与生物量呈线性关系,可以用OD560计算培养液中节旋藻的生物量。表达式为y=0.642 7x+0.246 2,其中y是藻体干重(g/L),x是OD560吸光度。
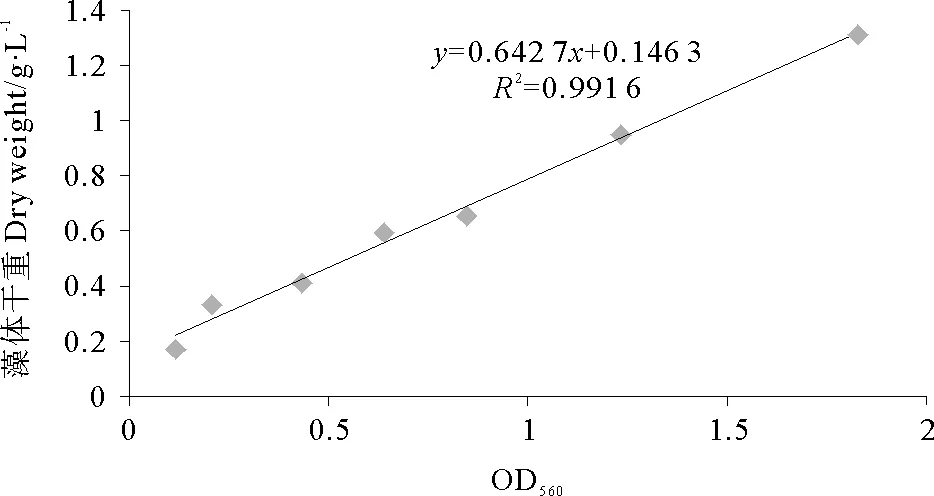
图1 节旋藻培养液OD560与生物量关系
2.2 亚硝基胍诱变预实验
由图2看出,亚硝基胍对节旋藻有明显的剂量效应。0.05g/L的亚硝基胍作用0.5h即达到80%致死率,超过0.5h后致死率上升趋于平缓,到2h以后节旋藻全部死亡。选择致死率为90%为诱变条件,即在亚硝基胍浓度为0.05g/L时,诱变时间1h作为诱变的方案。

图2 亚硝基胍诱变时间与钝顶节旋藻致死率关系
2.3 喹禾灵筛选预实验
由图3可知,在含有喹禾灵的培养基上,节旋藻的致死率随着喹禾灵浓度的上升而上升,1.3μmol/L时达到80%致死率,到5μmol/L时节旋藻全部死亡。选择致死率为90%为筛选实施条件,即喹禾灵浓度为2.0μmol/L。
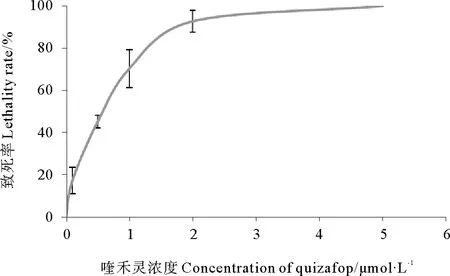
图3 喹禾灵浓度与钝顶节旋藻致死率关系
2.4 突变株筛选
经过亚硝基胍(0.05g/L)诱变1h后在含2.0μmol/L的喹禾灵培养基上筛选出524株藻株,连续传代培养后筛选出5株生长状态最好的藻株进行下一步实验。编号分别为623-8、623-16、623-21、623-23和623-24。将突变株和出发株连续培养10d,比较它们的生长情况,结果如图4。筛选出的5株突变株均比出发株生长速度快,其中623-8与623-16生长速度最快,在第十天时诱变株623-8与623-16的OD560分别达到1.006±0.033和0.974±0.028,比出发株623提高31.68%和27.49%。各突变株与出发藻株623间的t-test值为0.011、0.011、0.017、0.016和0.020均小于0.05,表明与出发株相比突变株的生长速度均有提高,差异显著。

图4 钝顶节旋藻突变株和出发株生长曲线
调制叶绿素荧光(PAM)结果表明,突变株623-8与突变株623-16的PSⅡ最大光能转化效率分别为0.533±0.004和0.524±0.005,均高于出发株623(0.499±0.006)的最大光能转化效率,比出发株623分别提高6.81%和5.01%(见图5)。突变株与出发藻株623间的t-test值为0.00054和0.00027均小于0.01,表明突变株的最大光能转化效率与出发株相比差异非常显著。

图5 钝顶节旋藻623及其突变株623-8和623-16的最大光能转化效率
2.5 出发株623与突变株623-8及623-16的形态特征观察
由表1和图6可知,突变株623-8和623-16在形态特征上与出发株623的差别主要体现在藻丝长度方面,出发株623藻丝较短,仅为246.58μm,较短的藻丝在培养中不易聚集成团,均匀分布在培养基中,突变株623-8的藻丝长度平均为762.16μm,而突变株623-16的藻丝长度平均为1324.5μm,在培养中极易聚集成团,且上浮性好,易于采收,是钝顶节旋藻大规模养殖中重要的性状。此外,突变株的螺距分别为74和82μm,均小于出发株的106μm,但差别不明显。螺旋直径没有变化,均为32μm。
2.6 出发株与突变株的培养条件优化及正交实验结果分析
对光照强度、温度、pH和藻株进行4因素3水平正交实验,见表2、3。
由表3可知,对于生物量,k1A>k2A>k3A,k2B>k1B>k3B,k2C>k1C>k3C,说明组合A1、B2、C2,即pH8.5、光照强度45μmol·m-2·s-1、培养温度28℃是最适宜钝顶节旋藻生长的条件。k2D>k3D>k1D,说明不考虑培养条件的情况下突变株623-8的生物量高于突变株623-16,而且两者均高于出发株623。突变株623-8和623-16的生物量分别比出发株623高67.86%和46.43%。

(A:出发株623;B:突变株623-8;C:突变株623-16。比例尺:200 μm。A:Original A. platensis 623. B: Mutant strain 623-8. C:Mutant strain 623-16 Scale bar: 200 μm.)
图6 钝顶节旋藻出发藻株623及其突变株623-8和623-16的形态观察
Fig.6 Morphological observations between the originalA.platensis623 and its mutant strains

表1 出发株623与突变株623-8及623-16的形态参数比较
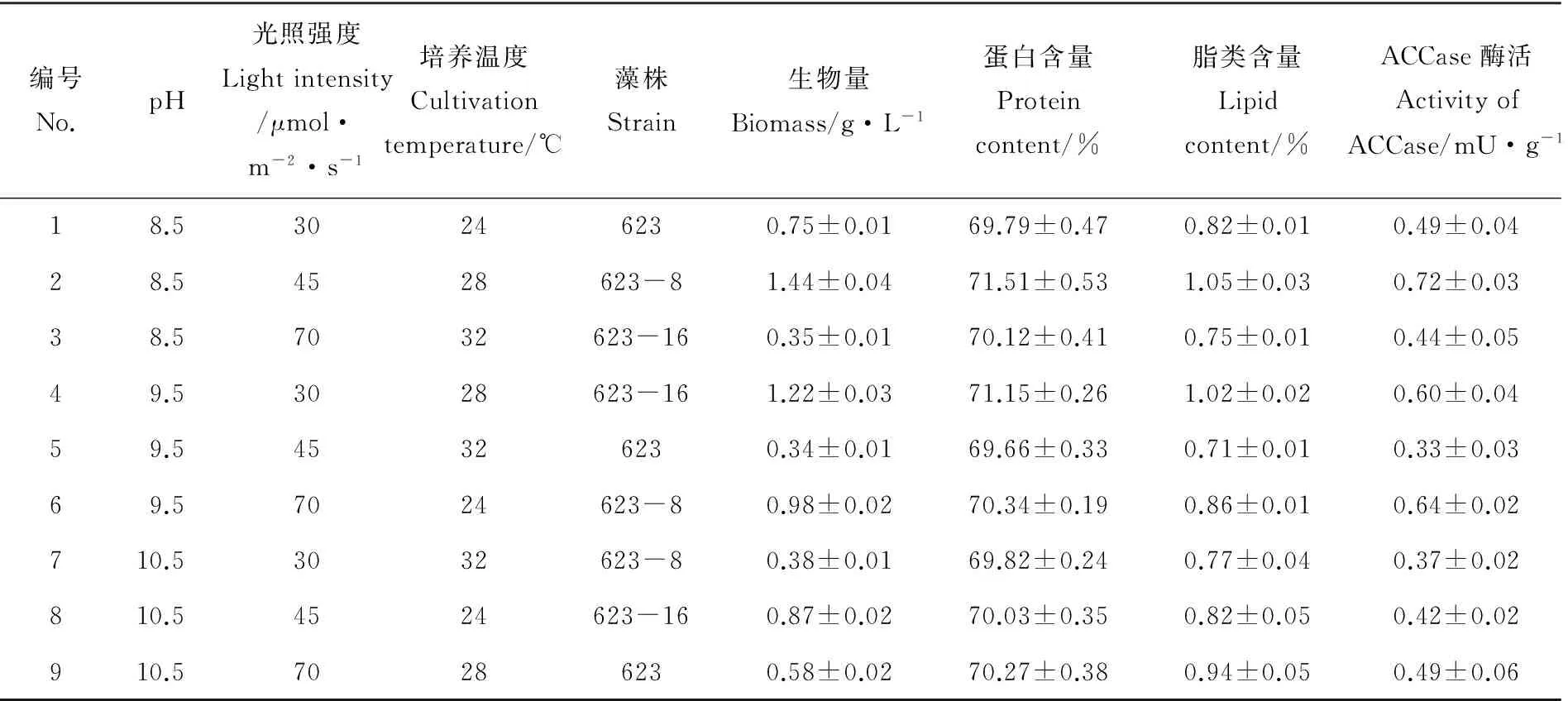
表2 生物量、蛋白含量、脂类含量与乙酰辅酶A羧化酶活性正交实验表

表3 节旋藻正交实验的k值和r值分析
注:因子A为pH,因子B为光照强度,因子C为培养温度,因子D为藻株。表中k1,k2,k3分别为影响出发株与突变株的生物量,蛋白含量,脂类含量和ACCase酶活的4因子在3水平下的平均数;r为k1,k2,k3中最大与最小差值。Factor A is for pH, factor B is for light intensity, factor C is for cultivation temperature, and factor D isfor algae strains.k1,k2andk3is the average of the three levels of the four factors on biomass, protein content, lipid content, and activity of ACCase of the original strain and the mutants.ris the difference of the maximum and minimum ofk1,k2andk3respectively.
对于蛋白含量来说,k1A>k2A>k3A,k2B>k3B>k1B,k2C>k1C>k3C;说明培养条件在组合A1、B2、C2,即pH8.5、光照强度45mol·m-2·s-1、培养温度28℃时,钝顶节旋藻的蛋白含量最大;对于脂类含量来说,k1A>k2A>k3A,k3B>k2B>k1B,k2C>k1C>k3C,培养条件在组合A1、B3、C2,即pH8.5、光照强度70μmol·m-2·s-1、培养温度28℃时,钝顶节旋藻的脂类含量最大。且对于蛋白含量和脂类含量来说,均有k2D>k3D>k1D,说明不考虑培养条件的情况下突变株623-8的蛋白含量和脂类含量均高于突变株623-16,而且两者均高于出发株623。突变株623-8和623-16的蛋白含量分别比出发株623高1.98%和0.84%;脂类含量高8.54%和4.88%。ACCase是生物体中多不饱和脂肪酸代谢途径中的关键酶,其活性的变化关系到脂类的积累情况。由表3可知,ACCase活性的实验结果中,k1A>k2A>k3A,k3B>k2B>k1B,k2C>k3C>k1C,说明培养条件在组合A1、B3、C2,即pH8.5、光照强度70μmol·m-2·s-1、培养温度28℃时ACCase的活性较高,同时在这个条件下脂类含量较高,两者呈现正相关的关系。k2D>k3D>k1D,突变株623-8的ACCase活性(0.58mU)高于突变株623-16(0.49mU),分别比出发株623(0.44mU)高出31.82%和11.36%。
3 讨论
亚硝基胍(NTG)作为一种超诱变剂,广泛的应用在微生物以及微藻的诱变育种中。殷春涛等用亚硝基胍诱变螺旋藻获得形态特征与出发株具有显著不同的耐低温突变品系,其蛋白质含量比出发品系提高9.5%[20]。Singh等用NTG诱变钝顶螺旋藻,筛选出耐甲硝基羟乙唑和3,4-二氯苯-1,1-二甲脲能力为野生型细胞的3倍的藻株[21]。Singh等还用亚硝基胍处理极大螺旋藻,获得氯酸盐抗性突变株SM11和SM25[22]。喹禾灵(Quizalofop-Ethyl)是一种乙酰辅酶A羧化酶抑制剂,应用于微藻诱变后筛选高产藻株的报道较少。曲晓梅等使用喹禾灵筛选微拟球藻高脂藻株,筛选出2株抗7.5μmol/L精喹禾灵藻株KA1和KA2,总脂含量达干重的46.73%和38.60%,分别比出发藻株提高了29.02%和6.57%[23]。曹小红等将喹禾灵应用于硅藻生产二十碳五烯酸(EPA),喹禾灵浓度为0.1mmol/L时,EPA的含量从3.00%增加到3.58%,提高了19.3%,EPA占总脂肪酸的比例也由25.15%提高到了32.88%[24]。本实验首次将NTG诱变与喹禾灵筛选结合,当设置NTG的浓度为0.05g/L、诱变时间1h、喹禾灵筛选浓度为2.0μmol/L时,最终获得了生长速度和蛋白含量均显著提高的突变钝顶节旋藻藻株623-8和623-16。表明喹禾灵是一种有效的筛选压力,在改善种质、新种培育和工业化养殖等方面有应用价值。
通过诱变选育获得的突变株,由于突变的随机性,突变株生长的最适条件可能会发生变化。因此,在养殖之前需要对突变株培养的最适环境因子进行探索,优化培养条件以获得最大生长速度与蛋白积累量对于节旋藻的养殖有着重要的经济价值。本实验探索得到的最佳培养条件为pH=8.5、光照强度45μmol·m-2·s-1、培养温度28℃,在此培养条件下,突变株623-8和623-16的生物量分别比出发株高出67.86%和46.43%;蛋白含量提高1.98%和0.84%。且2株突变株在生长速度,蛋白含量及脂质含量与乙酰辅酶A羧化酶活性呈现正相关的关系。
脂质含量和ACCase活性与光照强度呈正相关的关系。这与Kozaki[25]等发现的ACCase羧基转移酶亚基中的二硫键会被光诱导发生氧化还原反应而打开,激活乙酰辅酶A羧化酶活性的研究结果相符。
筛选出的2株突变株表现出了高于出发株的乙酰辅酶A羧化酶活性,本文仅对其活性的宏观影响因素如温度、光照强度和pH进行研究,在分子水平上的影响因素如编码乙酰辅酶A羧化酶α和β亚基的基因结构与表达水平等,还有待进一步探索。
[1] Niels T E. Production of phycocyanin-a pigment with applicaations in biology, bioechnology, foods and medicine [J]. Appl Microbiol Biotechnol, 2008, 80: 1-14.
[2] 唐玟, 金鹰, 郭宝江. 螺旋藻藻蓝蛋白和藻多糖对人体外周血淋巴细胞功能的影响 [J]. 华南师范大学学报, 1998, 4: 63-67.
[3] 高向东, 吴梧桐. 节旋藻多糖抗肿瘤作用的研究 [J]. 中国药科大学学报, 2000, 31(6): 458-461.
[4] Babu M, Rengaswamy S, Padmanabhan P N, et al. Evaluation of chemoprevention of oral cancer withSpirulinafusiformis[J]. Nutrition and Cancer, 1995, 24(2): 197-202.
[5] Pang Q S, Guo B J, Ada K. Radioprotective effect of extract fromSpirulinaPlatensisin mouse bone marrow cells studied by using the micronucleus test [J]. Toxicology Letters, 1989, 48: 165-169.
[6] Hayashi K, Hayashi T, Kojima I. A natual sulfated polysaccharide, calcium spirulina, isolated fromSpirulinaplatensis: In vitro and ex vivo evaluation of anti-herpes simplex virus and anti-human immunodeficiency virus activities [J]. AIDS Research and Human Retro-viruses, 1996, 12(15): 1463-1471.
[7] 张学成, 信式祥, 李清华, 等. 节旋藻-最完美的功能食品 [M]. 青岛: 青岛海洋大学出版社, 1999: 55-89.
[8] 王高歌, 张宝红, 茅云翔, 等. 无菌钝顶螺旋藻单细胞的制备和再生 [J]. 高技术通讯, 2001, 11(4): 6-10.
[9] 梁英, 陈书秀. 微藻育种的研究现状及前景 [J]. 海洋通报, 2008, 27(3): 88-94.
[10] 李建宏, 郑卫, 倪霞, 等. 两株钝顶螺旋藻紫外诱变的特征 [J]. 水产生物学报, 2001, 25(5): 486-490.
[11] Lanfaloni L, Trinei M, Russo M. Mutagenesis of the cyanobacteriumSpirulinaplatensisby UV and nitrosoguanidine treatment [J]. FEMS Microbiol Lett, 1991, 83(1): 85-90.
[12] 赵萌萌, 王卫卫. He-Ne激光对钝顶螺旋藻的诱变效应 [J]. 光子学报, 2005, 34(3): 400-403.
[13] 赵炎生, 尹鸿萍, 陈向东, 等. 倍频ND: YAG脉冲激光诱变钝顶螺旋藻的初步研究 [J]. 光电子激光, 1999, 10(6): 563-565.
[14] 汪志平, 刘艳辉. 高产多糖钝顶螺旋藻新品系的选育及蛋白质SDS-PAGE鉴定 [J]. 核农学报, 2004, 18(5): 349-352.
[15] 张学成, 谭桂英, 和丽容, 等. 甲基磺酸乙酯对螺旋藻的诱变作用 [J]. 海洋学报, 1994, 12(4): 517-522.
[16] 韩岚, 汪育文, 李建宏, 等. 耐低温螺旋蓝细菌突变株的诱变及特性研究 [J]. 食品科学, 2008, 29(3): 350-354.
[17] Claude Z. Contribution à l’étude d’une cuanophycée influencé de divers facteurs physiques la croissance et la photosynthése deSpirulinamaxima(Setch et Gardner) Geitler [D]. Paris: University of Paris, 1966.
[18] 李婷. 1. 南海大型经济海藻数据库2. 小紫金牛石油醚萃取部位的化学成分和抗病毒活性研究 [D]. 广东: 暨南大学, 2007.
[19] 卢永忠.一种检测乙酰辅酶A羧化酶活性的方法: 中国, 201110313352 [P]. 2012-06-20.
[20] 殷春涛, 胡鸿钧, 李夜光, 等. 中温螺旋藻新品系的选育研究 [J]. 武汉植物学研究, 1997, 15(3): 250-254.
[21] Singh D P, Singh N. Isolation and characterization of a metronidazole tolerant mutant of the cyanobacteriumSpirulinaplatensisexhibiting multiple stress tolerance [J]. World J Miceobiol Biotechnol, 1997, 13(2): 179-183.
[22] Singh Y, Kumar H D. Physiological characterization of chlorate-resistant mutants of the cyanobacteriumSpirulinamajor[J]. Basic Microbiol, 1994, 34(5): 345-350.
[23] 曲晓梅, 宓文义, 朱葆华, 等. 精喹禾灵筛选高脂微藻的有效性研究 [J]. 中国海洋大学学报: 自然科学版, 2013, 43(6): 25-28.
[24] 曹小红, 李松耀, 王春玲, 等. 除草剂精喹禾灵用于硅藻过量产生二十碳五烯酸 [J]. 生物工程学报, 2007, 23(5): 885-889.
[25] Kozaki A, Mayumi K, Sasaki Y. Thiol-disulfide exchange between nuclear-encoded and chloroplast-encoded subunits of pea acetyl-CoA carboxylase [J]. Journal of Biological Chenistry, 2001, 276(43): 39919-39925.
责任编辑 朱宝象
Selection of Strains of Arthrospira platensis with High-Yield Trait by Mutation
LIU Qi, ZANG Xiao-Nan, ZHANG Xue-Cheng
(The Key Laboratory of Marine Genetics and Breeding, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Stably inherited strains ofArthrospiraplatensiswith high-yield trait were obtained by using nitrosoguanidine (NTG) mutagenesis and Quizalofop-Ethyl screening. Compared with the original strain 623 ofA.platensis, the two mutants of 623-8 and 623-16 had longer filaments and easily aggregated into clusters. Moreover, higher growth rate and higher contents of protein and lipid as well as higher activities of acetyl coenzyme A carboxylase were detected. The growth rate of mutants of 623-8 and 623-16 reached their maximum of 67.86% and 46.43% respectively at 28 ℃ with pH=8.5 and light intensity of 45 μmol·m-2·s-1. Protein contents of both mutants increased by 1.98% and 0.84% respectively. While, lipid contents increased by 8.54% and 4.88%. The activities of acetyl coenzyme A carboxylase increased by 31.82% and 11.36% respectively. Our findings showed that a combination of NTG with Quizalofop-Ethyl can be used to mutate and screen theArthrospirastrains for high growth rate and high protein content, which is important to improve the yield and quality ofArthrospirain industry.
Arthrospiraplatensis; Nitrosoguanidine; mutagenesis; Quizalofop-Ethyl
山东省优秀中青年科学家科研奖励基金项目(BS2012HZ017);国家高技术研究发展计划项目(2008AA09Z410)资助
2014-03-04;
2014-05-28
刘 奇(1987-),男,硕士生。E-mail: liuqichris67@hotmail.com
** 通讯作者: E-mail:xczhang8@163.com
Q319+.2
A
1672-5174(2015)04-059-07
10.16441/j.cnki.hdxb.20140043

