采用亚硫酸钠还原法从 沉金后液中回收稀贵金属
张福元 ,郑雅杰,孙召明,马亚赟,董俊斐
(1. 中南大学 冶金与环境学院,长沙 410083; 2. 河南中原黄金冶炼厂有限责任公司 河南省黄金资源综合利用重点实验室,三门峡 472000)
铜阳极泥是粗铜电解精炼工艺过程得到的不溶性固体产物,其产率和成分根据原料来源、生产工艺、技术指标的不同而波动,一般产率为粗铜质量的0.2%~1.0%,因其中含有大量的金、银、铂、钯、硒、碲等稀贵金属和铜、铅、锡、铋、锑等重金属而备受关注[1-8],成为回收稀贵元素的重要原料。一般铜阳极 泥处理工艺首先通过预处理脱除部分有价元素[9-11],再采用湿法工艺[12-14]氯化分金,或采用火法熔炼得到多尔合金,对多尔合金的电解阳极泥进行氯化分金,两种工艺得到的分金液采用焦亚硫酸钠或草酸还原得到金粉和沉金后液,铂、钯、硒、碲等元素主要残留在沉金后液中。
目前,工业上主要采用锌粉置换[15-16]工艺回收沉金后液中的金铂钯等贵金属,该工艺虽简单、易操作,但还原精矿杂质含量高、贵金属品位低,金、铂、钯还原不彻底,尤其是硒和碲回收率基本为零,且该工艺易发生放氢副反应,成为工业生产的重大危险源。本文作者[17-18]研究了SO2法回收硒碲和铂钯贵金属的工艺,与传统的锌粉置换工艺相比,有价元素的回收率近100%,得到了高品位精矿,但二氧化硫作为气态还原剂容易溢出,造成环境污染,增加外溢SO2的处理成本。在此,本文作者首次提出采用亚硫酸钠法复合催化还原沉金后液,回收硒、碲、金、铂、钯等有价元素,确定复合催化还原的最佳条件。该工艺可完全回收硒、碲和金、铂、钯等有价元素,硒还原析出时形成胶体态单质硒,可高效捕集细微粒的金、铂、钯,有效避免了SO2气体的溢出,避免了环境污染,更加适合工业生产的需求,为工业生产提供了一种新的方向。
1 实验
1.1 实验原料
实验原料为某铜阳极泥处理工序的沉金后液,淡黄色,pH约为0,其多元素分析结果如表1所示。

表1 沉金后液多元素化学分析结果 Table1 Multi-element analysis results of solution after precipitating gold (mg/L)
1.2 实验步骤
准确量取一定量沉金后液倒入三颈烧瓶中,将三颈烧瓶放入恒温水浴锅并安装固定在电磁搅拌器上,开启搅拌、维持一定转速,升温到目标温度并维持,加入一定量的催化剂和还原剂,反应预定时间后,固液分离,滤饼洗涤、烘干、称量,滤液定容分析,其工艺流程如图1所示。

图1 采用亚硫酸钠还原法从沉金后液中回收稀贵金属工艺流程图Fig.1 Flow diagram of experimental process of recovering rare and precious metals from precipitated gold solution by Na2SO3 reduction
1.3 分析方法
采用美国热电元素公司的Intrepid II XSP型电感耦合等离子体发射光谱仪(ICP)分析溶液成分;采用X射线荧光光谱仪(XRF)定性半定量分析固体产物成分;采用日本理学D/max-TTR III型X射线衍射仪(XRD)分析固体产物物相;采用日本电子株式会社JSM-6300型扫描电镜(SEM)观察固体产物显微形貌。
2 结果与讨论
2.1 Cl-催化作用下亚硫酸钠的还原
2.1.1 催化剂用量对稀贵金属还原率的影响
实验准确量取200 mL沉金后液,为保证实验效果,取1.5倍理论用量亚硫酸钠配成溶液后缓慢加入,当体系温度85 ℃、硫酸浓度184 g/L、还原时间2 h,考察催化剂NaCl浓度对稀贵金属还原率的影响,其结果如图2所示。
由图2可知,在催化剂Cl-浓度范围内,沉金后液中金、铂、钯、硒全部被还原,还原率约为100%,碲的回收率随催化剂浓度增加而增加,当NaCl浓度从0.3 mol/L增加到1.1 mol/L时,碲的回收率由68.3%增加到99.6%,故选择1.1 mol/L NaCl为适宜的催化剂浓度。碲在硫酸体系中主要是以硫酸氧碲的形式存在,有Cl-离子存在时溶液中碲发生如下变化:

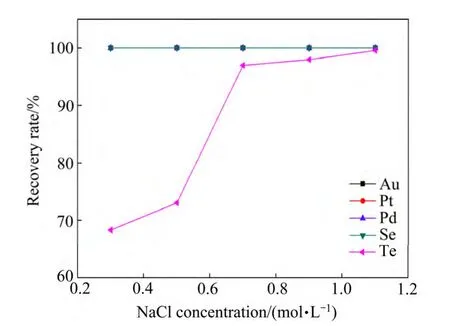
图2 催化剂NaCl浓度对沉金后溶液中稀贵金属还原率的 影响 Fig.2 Effect of NaCl concentration on recovery rate of rare and precious metals in precipitated gold solution
Cl-破坏了硫酸体系溶液中碲氧双键的稳定性,同时消除了硫酸根离子的阻隔效应,从而降低反应的活化能,对还原反应起到催化作用[18]。
2.1.2 亚硫酸钠用量对稀贵金属还原率的影响
当体系温度为85 ℃、NaCl浓度为1.1 mol/L、硫酸用量184 g/L时,亚硫酸钠的用量对稀贵金属还原率的影响如图3所示。由图3可知,当亚硫酸钠用量在35~125 g/L范围内变化时,随亚硫酸钠用量的增加,沉金后液中钯和碲还原率逐渐增加,钯的还原率从80.0%增加到100.0%,碲的还原率从33.7%增加到75.0%;硒的还原率先增加后下降;当亚硫酸钠用量从35 g/L变化到100 g/L时,硒的还原率从81.0%增加到100.0%;然而,当亚硫酸钠用量增加到125 g/L时,硒的还原率降低为60.8%,金和铂的还原率为100.0%,故选择100 g/L为亚硫酸钠适宜的用量。 沉金后溶液中的硒主要以Se(Ⅳ)形式存在,在温度高于70 ℃的酸性溶液中,Se(Ⅳ)的化合物H2SeO3离解为SeO2和H2O。热力学分析表明[19],在强酸性条件下,在沉金后液中加入亚硫酸钠后立即生产亚硫酸,以亚硫酸形态存在的还原剂具有较强还原性,可将稀贵金属元素还原;同时,可生成H2SeS2O6[20-22];而在温度更高的条件下H2SeS2O6可分解为Se。当亚硫酸钠浓度增加到一定程度后,还原出的单质硒与亚硫酸钠反应,发生返溶造成硒的还原率降低。主要反应如下:

图3 亚硫酸钠用量对沉金后液中稀贵金属还原率的影响 Fig.3 Effect of Na2SO3 dosage on recovery rates of rare and precious metals in precipitated gold solution
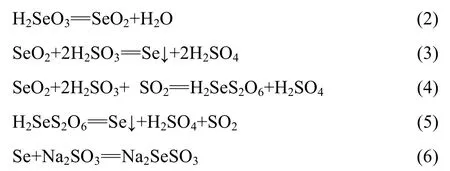
2.1.3 硫酸用量对稀贵金属还原率的影响
当体系温度为85 ℃、NaCl浓度为1.1 mol/L、亚硫酸钠的用量为100 g/L时硫酸用量对稀贵金属还原率的影响如图4所示。由图4可知,硫酸浓度范围内金、铂、钯还原率均为100.0%;当硫酸浓度在184~460 g/L范围变化时,随体系中硫酸浓度的升高,硒和碲的还原率逐渐增高,硒的还原率从98.2%增加到100.0%,碲还原率从65.5%增加到97.0%。

图4 体系中硫酸浓度对沉金后液中稀贵金属还原率的 影响 Fig.4 Effect of H2SO4 dosage on recovery rates of rare and precious metals in precipitated gold solution
沉金后液中Se(Ⅳ)和Te(Ⅳ)的可能存在形式主要有SeO32-、HSeO3-、H2SeO3和TeO32-、HTeO3-、H2TeO3、H3TeO3+等形态,其热力学关系式[20-22]为

式中:KT为反应热力学平衡常数;iν为化学计量系数;

图5 沉金后液中Se(Ⅳ)浓度组分-pH曲线 Fig.5 Curves of Se(Ⅳ) concentration-pH in precipitated gold solution

图6 沉金后液中Te(Ⅳ)浓度组分-pH曲线 Fig.6 Curves of Te(Ⅳ) concentration-pH in precipitated gold solution
对于含硫酸的沉金后液体系中,反应TeO32-+ 2H+=H2TeO3和HTeO3-+H+=H2TeO3,lg K均大于0,在酸性条件下化学平衡向右移动,TeO32和HTeO3-离 子与H+结合,形成H2TeO3;H3TeO3+=H2TeO3+H+的lg K小于0,在酸性条件下平衡向左移动,即TeO32-和HTeO3-离子与H+结合形成的H2TeO3,进一步与H+结合形成H2TeO3+。因此,硫酸浓度为184 g/L时,[H+]=3.7 mol/L的沉金后液中碲以H2TeO3+形式存在,在含Se(Ⅳ)、Te(Ⅳ)、Pt(Ⅱ)、Pd(Ⅱ)和Au(Ⅲ)的沉金后液中加入亚硫酸钠,涉及的电化学反应如表2所列。

表2 电极反应及标准电极电势 Table2 Electrode reaction and standard electrode potential
从表2所示的标准电极电势判断,在沉金后液中金的电极电势最高,为1.002 V,最易被亚硫酸钠还原,H2SeO3在酸性条件下易被还原,H3TeO3+的氧化性比金、铂、钯的氧化性低,相应还原率也较低。当有Cl-存在时,溶液中H3TeO3+在Cl-缔合作用下逐渐转变为TeCl62-。由表2可知,TeCl62-的电极电势较H3TeO3+的正,从而促进了溶液中Te(Ⅳ)的还原,有利于增大碲的回收率。
2.1.4 反应时间对稀贵金属还原率的影响
当体系温度为85 ℃、NaCl浓度为1.1 mol/L、亚硫酸钠用量为100 g/L、硫酸浓度为368 g/L时,反应时间对稀贵金属还原率的影响如图7所示。由图7可知,在15 min以内,沉金后溶液中的金铂钯均被全部还原;当反应时间从15 min增加到2 h时,碲和硒的还原率随反应时间的延长而增加,碲的还原率由0增加到97.7%,硒的还原率由19.3%增加到100.0%。
2.2 复合催化剂作用下亚硫酸钠的还原
2.2.1 催化剂对比实验
当体系温度为85 ℃、硫酸浓度为368 g/L、催化剂总浓度为0.6 mol/L时进行催化剂对比实验,由于亚硫酸钠加入一定量后,金、铂、钯均完全还原,对比实验仅考察硒、碲的还原效果,其结果如表3所列。由表3可以看出,单一采用NaCl和NaI作为催化剂时,其催化效果不如NaBr的,复合催化剂效果优于 单一催化剂的。

图7 反应时间对稀贵金属还原率的影响 Fig.7 Effect of reaction time on recovery reduction of rare and precious metals
2.2.2 复合催化剂成分选择实验
上述其他条件不变,采用NaCl和NaBr作为复合催化剂时,改变NaCl和NaBr的摩尔比并控制总浓度为0.6mol/L不变,其结果如表4所示。由表4可知,随复合催化剂中NaBr含量的增加,硒和碲的还原速率也呈增加趋势,复合催化剂nNaCl:nNaBr=1:2时,硒、碲的还原速度最快。
综合以上结果,复合催化剂优于单一催化剂的还原效果;当复合催化剂中NaBr含量增高时,反应速度加快,催化效果较好。另外,采用复合催化剂能够明显降低催化剂的用量。
2.3 沉金后液最佳还原条件放大实验
实验取3.0 L沉金后液,采用最佳还原条件进行放大实验。放大实验中各元素的还原率如表5所列,所得硒碲精矿的XRF定性分析检测成分如表6所列,XRD和SEM分析结果如图8和9所示。由表5可知,采用复合催化剂还原60 min,硒碲金铂钯的还原率均达到100%,还原效果理想。由表6定性半定量结果可知,还原产物主要成分为碲、铜、硒和金,含量约为97%(质量分数),稀散元素碲含量为73.95%,硒为7.65%,贵金属金铂钯含量分别为3.31%、0.24%、0.95%,总含量为4.5%,贵金属得到有效富集;此外,铜含量为12.35%,镁含量为0.63,铟含量为0.35%,其他杂质含量为0.58%。
从图8可知,还原产物中出现单质碲的衍射峰和标准谱线基本重合,这与表6中所示的成分分析结果一致,即还原产物中主要成分为碲单质。由图9知,还原产物碲呈柱状体,长度约为2~3 μm,颗粒较均匀;其他颗粒状产物主要为铜、硒和金等元素的复杂产物。
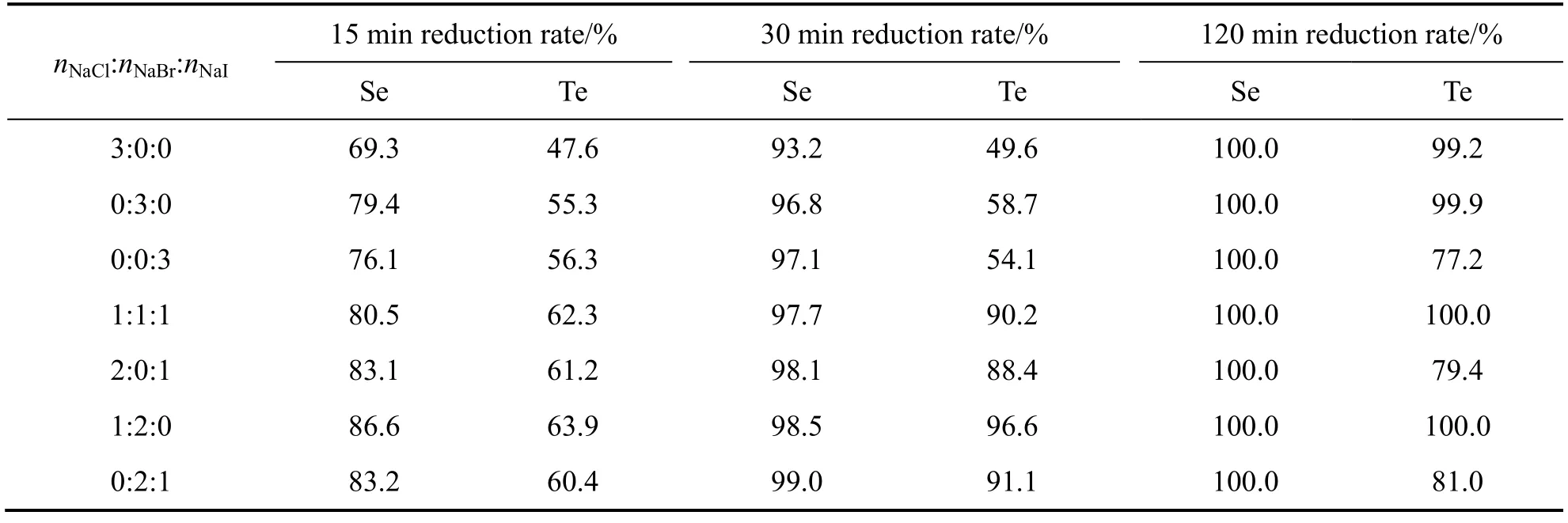
表3 复合催化剂用量对硒和碲还原率的影响 Table3 Effect of catalyst addition on reduction rates of Se and Te by complex catalyst
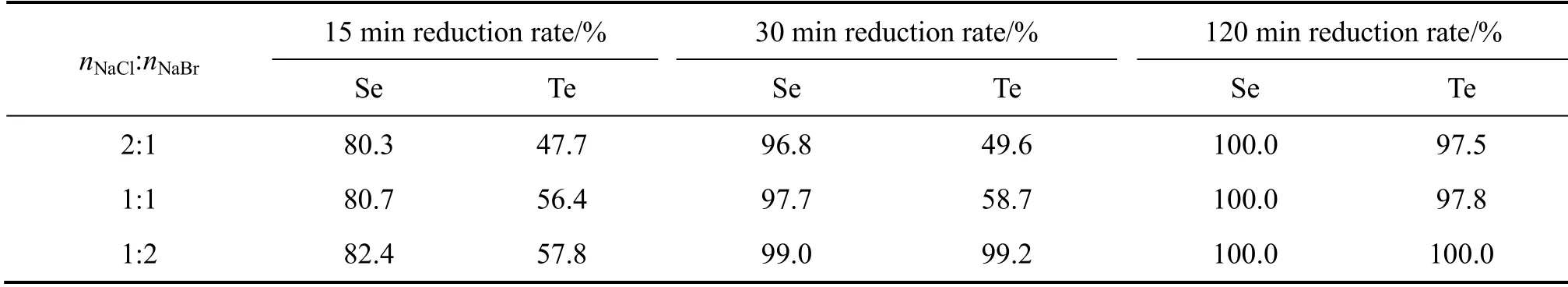
表4 复合催化剂NaCl和NaBr用量对硒和碲还原率的影响 Table4 Effect of catalyst addition on reduction rates of Se and Te by complex catalyst of NaCl and NaBr

表5 放大实验还原率试验结果 Table5 Results of scale-up test

表6 还原产物的XRF定性分析结果 Table6 XRF analysis of reduction product (mass fraction,%)

图8 放大实验还原产物的XRD谱 Fig.8 XRD pattern of scale-up test reduction product

图9 放大实验还原产物的SEM像 Fig.9 SEM image of scale-up test reduction product
3 结论
1) 采用亚硫酸钠作为沉金后液还原剂,NaCl作为单一催化剂,催化剂浓度为1.1 mol/L、亚硫酸钠用量为100 g/L、硫酸浓度为368 g/L、反应温度85 ℃条件下反应2 h后,硒金铂钯还原率为100%,碲为97.7 %。
2) 以亚硫酸钠作为沉金后液还原剂,在复合催化剂NaCl与NaBr的物质的量比为1:2,反应温度85 ℃,亚硫酸钠的用量为100 g/L,硫酸浓度为368 g/L时,反应1 h后,硒、碲、金、铂、钯的还原率为100.0%。
3) 还原产物中碲、硒、金、铂、钯品位分别为73.95%、7.65%、3.31%、0.24%、0.95%。还原产物中碲主要为为碲单质,TEM分析表明还原产物主要为柱状单质碲。
[1] 郑雅杰,孙召明.铜阳极泥中回收碲及其新材料制备技术进展[J]. 稀有金属,2011,35(4):593-599.
ZHENG Ya-jie,SUN Zhao-ming. Progress in recovery of tellurium form copper anode slime and preparation of new materials with tellurium[J]. Chinese Journal of Rare Metals,2011,35(4):593-599.
[2] 陈国宝,杨洪英,郭 军,李雪娇.铜阳极泥选冶富集金银的粗选研究[J]. 贵金属,2013,34(3):32-36.
CHEN Guo-bao,YANG Hong-ying,GUO Jun,LI Xue-jiao. The rougher flotation process of copper anode slime for collecting gold and silver[J]. Precious Metals,2010,34(3):32-36.
[3] 郑雅杰,汪 蓓,史建远,孙召明,刘昭成. 铜阳极泥预处理富集金银的研究[J]. 中南大学学报(自然科学版),2010,41(3):865-870.
ZHENG Ya-jie,WANG Bei,SHI Jian-yuan,SUN Zhao-ming,LIU Zhao-cheng. Pretreatment of copper anode slime for concentrating gold and silver[J]. Journal of Central South University (Science and Technology),2010,41(3):865-870.
[4] 李雪娇,杨洪英,佟琳琳,陈国宝. 铜阳极泥的工艺矿物学[J]. 东北大学学报(自然科学版),2013,34(4):560-563.
LI Xue-jiao,YANG Hong-ying,TONG Lin-lin,CHEN Guo-bao. Technological mineralogy of copper anode slime[J]. Journal of Northeastern University (Natural Science),2013,34(4):560-563.
[5] 郑雅杰,乐红春,孙召明. 铜阳极泥处理过程中中和渣中碲的提取与制备[J]. 中国有色金属学报,2012,22(8):2360-2365.
ZHENG Ya-jie,LE Hong-chun,SUN Zhao-ming. Extraction and preparation of tellurium from neutralization sludge of process for treatment of anode slime[J]. The Chinese Journal of Nonferrous Metals,2012,22(8):2360-2365.
[6] 郭学益,肖彩梅,钟菊芽,田庆华. 铜阳极泥处理过程中贵金属的行为[J]. 中国有色金属学报,2010,20(5):990-998.
GUO Xue-yi,XIAO Cai-mei,ZHONG Ju-ya,TIAN Qing-hua. Behaviors of precious metals in process of copper anode slime treatment[J]. The Chinese Journal of Nonferrous Metals,2010,20(5):990-998.
[7] FAN Y Q,YANG Y X,XIAO Y P,ZHAO Z,LEI Y. Recovery of tellurium from high tellurium-bearing materials by alkaline pressure leaching process:Thermodynamic evaluation and experimental study[J]. Hydrometallurgy,2013,139:95-99.
[8] ZHENG Y J,CHEN K K. Leaching kinetics of selenium from selenium" tellurium-rich materials in sodium sulfite solutions[J]. Transactions of Nonferrous Metals Society of China,2014,24(2):536-543.
[9] 张博亚,王吉坤. 加压酸浸预处理铜阳极泥的工艺研究[J]. 矿冶工程,2007,27(5):41-43.
ZHANG Bo-ya,WANG Ji-kun. The technological research on pre-treating copper anode slime with pressure acid leaching method[J]. Mining and Metallurgical Engineering,2007,27(5):41-43.
[10] HOFFMANN J E. Recovering selenium and tellurium from copper refinery slimes[J]. The Journal of the Minerals Material Society,1989,41(7):33-38.
[11] LIU W F,YANG T Z,ZHANG D C,CHNE L,LIU Y N. Pretreatment of copper anode slime with alkaline pressure oxidative leaching[J]. International Journal of Mineral Processing,2014,128:48-54.
[12] 王 辉,汤集钢,贾木欣. 某铜阳极泥分金渣组分特征及银的浸出[J]. 有色金属,2010,62(4):109-114.
WANG Hui,TANG Ji-gang,JIA Mu-xin. Component characteristics of gold separating slag from copper anode slime and silver leaching[J]. Nonferrous Metals,2010,62(4):109-114.
[13] RANJBAR R,NADERI M,OMIDVAR H,AMOABEDINY G. Gold recovery from copper anode slime by means of magnetite nanoparticles (MNPs)[J]. Hydrometallurgy,2014,43:54-59.
[14] KHALEGHI A,GHADER S,AFZALI D. Ag recovery from copper anode slime by acid leaching at atmospheric pressure to synthesize silver nanoparticles[J]. International Journal of Mining Science and Technology,2014,24:251-257.
[15] 胡建辉. 从金还原后液中置换铂钯的工艺优化研究[J]. 湿法冶金,2000,19(2):22-25.
HU Jian-hui. Study on optimum process for displacing Pt and Pd from the solution Au reduced[J]. Hydrometallurgy of China,2000,19(2):22-25.
[16] 张钦发,龚竹青,陈白珍. 从铂钯精矿中提取金铂钯的研 究—铂钯精矿的预处理[J]. 矿冶工程,2002,22(2):70-72.
ZHANG Qin-fa,GONG Zhu-qing,CHEN Bai-zhen. Investigation on extraction of Au,Pt and Pd-Pretreatment of the concentrate[J]. Mining and Metallurgical Engineering,2002,22(2):70-72.
[17] 郑雅杰,陈昆昆,孙召明. SO2还原沉金后液回收硒碲及捕集铂钯[J]. 中国有色金属学报,2011,21(9):2258-2264.
ZHENG Ya-jie,CHEN Kun-kun,SUN Zhao-ming. Recycling Se and Te and capturing Pt and Pd from solution after precipitating gold by SO2reduction[J]. The Chinese Journal of Nonferrous Metals,2011,21(9):2258-2264.
[18] 孙召明,郑雅杰. Te(Ⅳ)-H2SO4-H2O体系中卤素离子催化还原Te(Ⅳ)反应动力学[J]. 中国有色金属学报,2010,20(12):2438-2444.
SUN Zhao-ming,ZHENG Ya-jie. Reaction kinetics of Te(Ⅳ) using halogen ions as catalyst in Te(Ⅳ)-H2SO4-H2O system[J]. The Chinese Journal of Nonferrous Metals,2010,20(12):2438-2444.
[19] 侯晓川,肖连生,高丛堦,张启修,张贵清,曹佐英,李青刚. 从镍钼矿冶炼烟尘浸出液中还原硒的热力学及应用[J]. 中国有色金属学报,2010,20(12):2431-2437.
HOU Xiao-chuan,XIAO Lian-sheng,GAO Cong-jie,ZHANG Qi-xiu,ZHANG Gui-qing,CAO Zuo-ying,LI Qing-gang. Thermodynamics and application of selenium reduction from leaching solution of smelting dust of Ni-Mo ore[J]. The Chinese Journal of Nonferrous Metals,2010,20(12):2431-2437.
[20] XIONG Y L. Predicted equilibrium constants for solid and aqueous selenium species to 300℃:Applications to selenium- rich mineral deposits[J]. Ore Geology Reviews,2003,23(3/4):259-276.
[21] SEBY F,POTIN-GAUTIER M,GIFFAUT E,BORGE G,DONARD O F X. A critical review of thermodynamic data for selenium species at 25 ℃[J]. Chemical Geology,2001,171(3/4):173-194.
[22] MCPHAIL D C. Thermodynamic properties of aqueous tellurium species between 25 and 350 ℃[J]. Geochimica et Cosmochimica Acta,1995,59(5):851-866.
——庆祝中国共产党成立一百周年贵金属纪念币展

