不同基因转染方法对小鼠内耳毛细胞转染效率的比较*
陈岩赖垂金△李雯李华伟
·实验研究·
不同基因转染方法对小鼠内耳毛细胞转染效率的比较*
陈岩1赖垂金1△李雯1李华伟1
目的 对比不同的基因转染方法对小鼠内耳毛细胞的转染效率,以探寻简便、高效转染耳蜗毛细胞的方法。方法 分离111只新生昆明小鼠(P2)耳蜗螺旋韧带及感染上皮,分别采用电穿孔法介导质粒载体(pGPHI/GFP/Neo)、腺病毒载体(Ad5/CMV/GFP)和慢病毒载体(LV/CMV/GFP)3种方法转染小鼠内耳毛细胞,于转染48小时后在荧光显微镜下观察并比较三种方法基因转染后小鼠内耳毛细胞绿色荧光蛋白(green fluorescence protein,GFP)的表达。结果 电穿孔法介导质粒载体转染组和慢病毒载体转染组GFP阳性细胞极少;腺病毒载体转染组效率最高,耳蜗中回外毛细胞GFP阳性率为90.0%±4.1%,内毛细胞GFP阳性率为5%±0.4%。结论腺病毒载体能更有效地将外源基因导入耳蜗毛细胞内表达,是基因转染耳蜗毛细胞的理想载体。
腺病毒载体; 慢病毒载体; 电穿孔法; 基因转染; 内耳毛细胞
噪声、耳毒性药物、感染及老化等因素可以造成耳蜗毛细胞损伤死亡,毛细胞丢失是感音神经性聋的主要原因。哺乳动物耳蜗毛细胞不能自发再生,一旦毛细胞损伤死亡将造成永久性耳聋。基因转染技术是将目的基因转入靶细胞的重要方法,通过基因转染内耳毛细胞预防毛细胞丢失、促进损伤毛细胞修复和激活毛细胞再生,是未来的研究和治疗感音神经性聋的方向。
相对于内耳非感觉上皮细胞和成纤维细胞,毛细胞的基因转染效率比较低。目前,许多病毒和非病毒载体已经应用于内耳毛细胞基因转染研究,常规的脂质体和钙沉淀转染方法很难将外源基因导入毛细胞[1]。Holt和Chen等[2,3]报道腺病毒载体(Ad5 DeltaE1/E3/CMV/GFP)能够成功介导毛细胞基因转染并且不影响毛细胞功能,而Venail等[4]报道腺病毒载体(Ad5 DeltaE1-E3/CMV/GFP)只转染耳蜗的非感觉上皮细胞,绿色荧光蛋白(green fluorescence protein,GFP)阳性的毛细胞非常少。Pietola等[5]研究报道,用慢病毒载体内耳注射介导GFP转染,仅在耳蜗鼓阶和前庭阶的非感觉上皮细胞中发现GFP阳性细胞,而Corti氏器中没有GFP阳性细胞。Li[6]和shibata[7]发现腺相关病毒AAV只转染血管纹细胞和支持细胞,不能转染毛细胞;但Stone等[8]发现AAV1和AAV2能成功地将GFP转导至毛细胞和支持细胞。本研究拟通过比较腺病毒、慢病毒和电穿孔法介导耳蜗毛细胞基因转染的效果差异,以探寻一种简便、高效转染耳蜗毛细胞的方法。
1 材料与方法
1.1 主要试剂和仪器 人血清型5型E1/E3缺陷型重组腺病毒(Ad5 DeltaE1/E3/CMV-GFP)购自北京诺赛基因组研究中心公司;慢病毒Lv-CMV -GFP购自广州复能基因公司。DEME培养基和RNA提取试剂Trizol购自invitrogen公司;反转录试剂盒和Real t ime PCR试剂盒购自Promega公司;胎牛血清(GIBCO);电转仪(Bio Red);荧光显微镜(Olympus);Real time PCR仪(ABI)。
1.2 细胞培养和基因转染方法
1.2.1 细胞培养 新生昆明小鼠(P2)111只(222耳),麻醉后断头,取出耳蜗,在PBS中分离螺旋韧带和耳蜗感觉上皮。每个分离好的耳蜗感觉上皮分别置于预涂有多聚赖氨酸的玻片上,在DEME培养基,37℃、5%CO2、饱和湿度条件下进行培养。
1.2.2 电穿孔法介导质粒转染内耳毛细胞 分离好的耳蜗感觉上皮置于电转缓冲液和质粒混合液(质粒终浓度为0.05μg/μl)中,将电极放在耳蜗上皮两端(电极距离2 mm),实施电击。采用不同条件(电压20、27、35 V,方波/回旋波,持续时间20、35、40 ms,脉冲次数2、5、8次,共27组,每组4个耳蜗感觉上皮,共使用108个耳蜗)尝试电穿孔法介导质粒转染内耳毛细胞,电击后立即将上皮小心地转移至预涂有多聚赖氨酸的玻片上,在DEME培养基中(含10%胎牛血清)中培养,48小时后检测GFP荧光。
1.2.3 腺病毒、慢病毒载体介导转染内耳毛细胞耳蜗感觉上皮贴壁培养过夜后,分别加入不同滴度的腺病毒(原液1x1010pfu/ml,按1:10,1:100,1:1 000稀释,共3组)和慢病毒(原液1×108颗粒/ml,按1:10,1:100,1:1 000稀释,共3组),并设一组未转染病毒的细胞为阴性对照,总共7组,每组6个耳蜗,共使用42个耳蜗,病毒转染6小时(腺病毒)或24小时(慢病毒)后更换培养基,继续培养48小时后更换培养基并在倒置荧光显微镜下观察转染效率。
1.3 Real-time PCR检测Bmi1 mRNA表达水平耳蜗感觉上皮培养过夜后,分别加入不同滴度的重组腺病毒Ads-Bmi1-GFP(原液1×1010pfu/ml,按1:10,1:100,1:1 000稀释,共3组),并设一组转染重组腺病毒Ads-GFP的细胞为阴性对照组,共4组,每组6个耳蜗,重复三次实验,共使用72个耳蜗。病毒转染6小时后更换培养基,继续培养48小时后提取RNA。RNA提取采用Trizol法提取耳蜗感觉上皮总RNA,紫外分光光度仪测定总RNA含量。按照promega的试剂盒说明书合成cDNA并进行Real time PCR分析。Bmi1引物:F:5’-CAGCAATGACTGTGATGC-3’;R:5’-CTCCAGCATTCGTCAGTC-3’。GAPDH引物:F:5’-TGCGACTTCAACAGCAACTC-3’;R:5’-CTTGCTCAGTGTCCTTGCTG-3’。
1.4 统计学方法 应用SPSS11.0软件对数据进行单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 荧光显微镜下内耳毛细胞转染效果
2.1.1 电穿孔法内耳毛细胞转染效果 不同条件下电穿孔法介导质粒转染内耳毛细胞的效果不理想,当电压超过30 V或持续时间超过40 ms时,耳蜗感觉上皮组织和细胞容易死亡;最高转染效率的条件是质粒0.5μg/μl,电压27 V,方波/回旋波,持续时间35 ms,脉冲次数8次。在这种条件下,转染阳性的GFP阳性细胞主要为大上皮塉细胞和成纤维细胞,GFP阳性的毛细胞偶见(图1)。
2.1.2 慢病毒载体介导转染内耳毛细胞效果 慢病毒载体介导转染内耳毛细胞效率非常低,没有GFP阳性的毛细胞(图2)。
2.1.3 腺病毒载体介导转染内耳毛细胞效果 腺病毒转染内耳毛细胞效率较高,GFP阳性的毛细胞较多。耳蜗顶回的毛细胞转染阳性率较低,中回和底回的毛细胞转染阳性率较高;内毛细胞转染阳性率较低,外毛细胞转染阳性率较高;腺病毒滴度为1x108pfu/ml时,耳蜗中回外毛细胞转染阳性率为90.0%±4.1%,内毛细胞转染阳性率为5%±0.4%(图3)。
2.2 real-time PCR测定目的基因表达水平 为了进一步验证腺病毒载体能否有效的介导外源基因在毛细胞中高表达,构建重组腺病毒载体Ad5-Bmi1-GFP,并通过Real-time PCR检测各实验组Bmi1 mRNA表达水平,以GAPDH作为内参,结果显示,腺病毒载体成功介导外源Bmi1基因在毛细胞内高表达(图4)。

图1 电穿孔法毛细胞基因转染效果

图2 慢病毒载体介导毛细胞基因转染效果

图3 腺病毒载体介导毛细胞基因转染效果
3 讨论
基因转染的方法很多,分为病毒转染和非病毒转染两类[9],常用的非病毒转染方法包括磷酸钙沉淀法、脂质体转染法和电穿孔法;耳蜗毛细胞是较难转染的原代细胞,常规的脂质体和钙沉淀法很难将外源基因导入毛细胞。电穿孔方法是较常用的转染悬浮细胞方法,靠脉冲电流在细胞膜上打孔而将核酸导入细胞内,但此方法对细胞损伤较大,电穿孔转染K562细胞后24小时观察转染细胞凋亡率为40%[10]。本研究首次尝试了用电穿孔法转染耳蜗毛细胞,结果显示电穿孔后细胞损伤较大,电压过大或持续时间过长会导致感觉上皮细胞死亡。在细胞能耐受的转染条件下,难以将目的基因转入毛细胞。
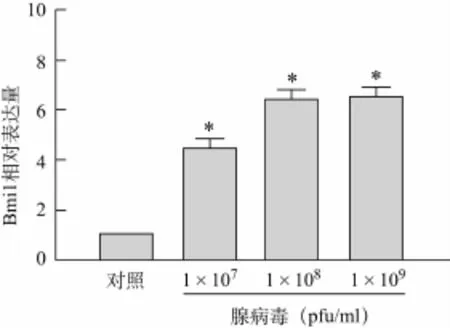
图4 腺病毒载体介导外源Bmi1基因m RNA表达水平测定
常用的病毒载体包括逆转录病毒、慢病毒、腺病毒和腺相关病毒载体。逆转录病毒只能感染分裂期细胞,而内耳毛细胞是原代细胞,因此不适合转染毛细胞。据文献报导,相对于毛细胞来说,腺相关病毒载体更适合转染内耳支持细胞[7,8]。本研究尝试用重组慢病毒和腺病毒载体转染耳蜗毛细胞,结果显示腺病毒载体对内耳毛细胞的转染效率较高,这可能与它们对耳蜗毛细胞的亲嗜性不同有关;此外,随着腺病毒滴度的提高,腺病毒转染效率也随之提高,此现象与文献报导相一致[11];腺病毒类型对毛细胞功能有一定的影响[2],仅去除E1/ab元件的复制缺陷重组腺病毒虽然能有效的将GFP转入毛细胞中,但是影响毛细胞离子通道的功能,而去除E1、E3、病毒聚合酶和前末端蛋白的复制缺陷重组腺病毒转染毛细胞后不影响毛细胞离子通道功能[2]。腺病毒可在293T工具细胞内可大量扩增,具有易制备、容量大、滴度高、高效转染静止和分裂期的细胞、不产生插入突变等优点;腺病毒载体不与靶细胞染色体整合,转入基因可在转染阳性细胞内维持高水平表达2~4周,能够满足耳聋基因致聋机制和促进毛细胞再生研究的需要。
总之,本研究结果显示,与电穿孔和慢病毒载体相比,腺病毒载体能更有效地将外源基因导入耳蜗毛细胞内表达,是转染耳蜗毛细胞的理想载体。
1 Staecker HD,Li BW,O'Malley Jr,et al.Gene expression in the mammalian cochlea:a study of multiple vector systems[J].Acta Otolaryngol,2001,121:157.
2 Holt JR.Viral-mediated gene transfer to study the molecular physiology of the Mammalian inner ear[J].Audiol Neurootol,2002,7:157.
3 Chen Y,Yu H,Zhang Y,et al.Cotransfection of Pax2 and Math1 promote in situ cochlear hair cell regeneration after neomycin insult[J].Sci Rep,2013,3:2996.
4 Venail FJ,Wang J,Ruel J,et al.Coxsackie adenovirus receptor and alpha nu beta3/alpha nu beta5 integrins in adenovirus gene transfer of rat cochlea[J].Gene Ther,2007,14:30.
5 Pietola L,Aarnisalo AA,Joensuu J,et al.HOX-GFP and WOX-GFP lentivirus vectors for inner ear gene transfer[J]. Acta Otolaryngol,2008,128:613.
6 Li Duan,Bordet MT,Mezzina M,et al.Adenoviral and adeno -associated viral vector mediated gene transfer in the guinea pig cochlea[J].Neuroreport,2002,13:1295.
7 Shibata SB,Pasquale GDi,Cortez SR,et al.Gene transfer using bovine adeno-associated virus in the guinea pig cochlea[J].Gene Ther,2009,16:990.
8 Stone IM,Lurie DI,Kelley MW,et al,Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea[J].Mol Ther,2005,11:843.
9 叶美玲,王少元.基因转染技术及其在白血病研究中的应用[J].医学综述,2010,16:1934.
10 窦立萍,刘军华,王畅,等.电穿孔转染K562细胞的效率研究[J].军医进修学院学报,2008,29:420.
11 Holt JR,Johns DC,Wang S,et al.Functional expression of exogenous proteins in mammalian sensory hair cells infected with adenoviral vectors[J].J Neurophysiol,1999,81:1881.
(2014-12-30收稿)
(本文编辑 周涛)
The Comparative Study of Different Methods for Gene Transfer to Cochlear Hair Cells
Chen Yan,Lai Chuijin,Li Wen,Li Huawei
(Affiliated Eye and ENT Hospital of Fudan University,Shanghai,200031,China)
Objective To obtain an easy and high efficient method for gene transfer to cochlear hair cells,by comparing three mediating green fluorescent protein(GFP)methods(electroporation,adenovector and lentivirus vector).Methods Cochlear sensory epithelium was dissected from anaesthetized P2 mice.Sensory epithelia were transferred onto poly-L-lysine treated cover slides and cultured overnight.Gene transfer was performed by electroporation in medium containing pGPHI/GFP/Neo plasmid or by incubation with diluted recombined adenovirus/lentivirus vector.After 48 hours,green fluorescence was checked under fluorescence microscope.To confirm the efficiency of exogenous gene transfer,real-time PCR was performed using specific primers.Results The transfection efficiencies of electroporation and lentivirus vector mediated gene transfer were very low.Both immunofluorescence and real-time PCR results showed that the transfection efficiency of adenovirus mediated GFP and Bmi1 transfer were relatively higher.The proportion of GFP positive cells in outer hair cells and inner hair cells of middle turn were 90.0%±4.1%and 5%±0.4%,respectively.Conclusion Adenovector is more efficient for exogenous gene transfer to cochlear hair cells,thus adenovector is a good carrier for gene transfer to cochlear hair cells.
Inner ear; Cochlear hair cells; Gene transfer; Electroporation; Adenovector; Lentivirus vector
10.3969/j.issn.1006-7299.2015.02.012
时间:2015-3-3 14:40
R764.35
A
1006-7299(2015)02-0166-04
* 973及国家重大研究计划(2011CB504506)、国家自然科学基金(81100709)、教育部博士点基金博导类计划(20120071110077)联合资助
1 复旦大学附属眼耳鼻喉科医院(上海 200031)
陈岩,女,山东人,助理研究员,博士,主要研究方向为感音性聋的机制和防治。
李华伟(Email:lihuawei63@gmail.com)
△ 为并列第一作者
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20150303.1440.032.html

