高级氧化技术去除水中嗅味物质土臭素及2-甲基异冰片的研究现状
陈海涵,武道吉,王占金,宋武昌,孙韶华,贾瑞宝
(1.山东省城市供排水水质监测中心,山东济南 250021;2.山东建筑大学市政与环境工程学院,山东济南 250101)
随着人们生活水平的提高,对饮用水水质的要求也越来越高。新版的《生活饮用水卫生标准》(GB 5749—2006)于2007年7月1日颁布实施,嗅味已列入了出厂水、管网水常规检验指标中的必测项目,这对出水的合格率带来了一定影响,也对水厂的处理工艺提出了新的要求,因此必须给予足够的重视。
自20世纪50年代,国外就开始了对水体嗅味物质(GSM、MIB)的研究,如今已在实际工程中进行了应用[1],而我国在这方面的研究相对较晚,有许多研究工作亟需开展。
1 嗅味物质(GSM、MIB)简介
1.1 GSM、MIB 来源
由于人类的一些活动(如农业、市政、工业废物排放)造成水体富营养化,水源中丰富的营养促进蓝藻和放线菌生长[2],而它们可以产生很多种化学物质,其中包括无毒物质(如GSM、MIB),也包括剧毒的藻毒素(如微囊藻毒素等)[3]。GSM和MIB是造成饮用水中嗅味问题的常见化合物,它们从感官上严重降低了饮用水的品质,同时还有极低的气味阈值(见表1),使得常规工艺难以处理到人的嗅阈值以下。GSM和MIB均为饱和环叔醇类物质,是放线菌和蓝绿藻的二级代谢物,具有挥发性[4],由于叔醇具有氧化抗性,因此氯、二氧化氯、高锰酸钾等常见氧化剂对去除这两种的嗅味化合物基本无效[4]。现已发现有22种放线菌、15种蓝藻、2种真菌、1种黏液性细菌可生成GSM;MIB则可由几种链霉菌、16种放线菌、4种蓝藻所产生。当这两种半挥发物质在水中浓度超过嗅阈值时,人们就会闻到土味、霉味[5,6]。
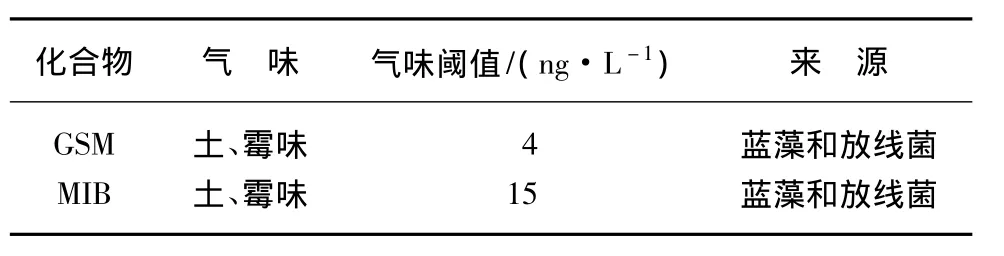
表1 GSM和MIB的气阈值和来源Tab.1 Ventilator Threshold Value and Sources of GSM and MIB
1.2 嗅味物质的危害和常规处理的局限性
在饮用方面,虽然嗅味物质对人体健康的影响尚不明确,但会引起用户的抱怨及对水质的怀疑。在水厂处理方面,在原有工艺处理不达标的情况下,往往采用临时投加颗粒活性炭(GAC)、粉末活性炭(PAC)的应急处理措施[7]。由于天然有机物的存在,活性炭的吸附能力表现出减弱的趋势,因而要对活性炭进行再生处理或者换装新炭,这无疑会增加处理的成本[8]。鉴于常规工艺对嗅味物质处理的局限性,发展新型高效深度处理技术势在必行。在这样的背景下,高级氧化能对大分子难降解有机物特有的高反应速度,高矿化度和非选择性的优势,引起了研究人员的关注。
2 高级氧化技术简介
高级氧化可被广义地定义为基于使用高反应活性的物质[羟基自由基(·OH)],而导致目标化合物降解的氧化方法。高级氧化技术包括一个广大的技术群体,如直接臭氧氧化、臭氧/过氧化氢与紫外线联用、芬顿、光芬顿、半导体光催化、电解、超声波辐照、湿式氧化及其他方法[9]。现今越来越多的科技工作者开始致力于研究通过高级氧化技术去除水溶液中(饮用水/地下水,废水)的嗅味物质。用于去除嗅味化合物的高级氧化技术和每个流程中的反应活性物质[10-12]如表2所示。

表2 用于去除对嗅味化合物的高级氧化技术和每个流程中的反应活性物质Tab.2 Advanced Oxidation Processes for Removal of Taste and Odor Compounds and Reactive Substances in Each Process
2.1 高级氧化反应活性物质的生成过程
(1)O3/H2O2、UV/O3、UV/O3/H2O2反应活性物质的生成过程如下[11]。

(2)臭氧催化氧化反应活性物质的生成过程如下[11]。

(3)光芬顿反应活性物质是在波长小于400 nm的紫外光照射下发生的复杂的光化学反应,其中包括了三价铁离子转化到二价铁离子的光化学反应,具体过程如下[12]。
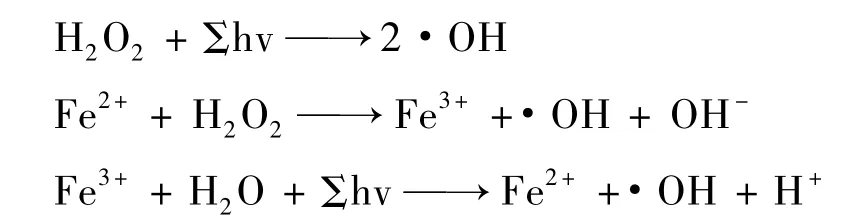
(4)光催化反应活性物质的生成过程如下[10]。
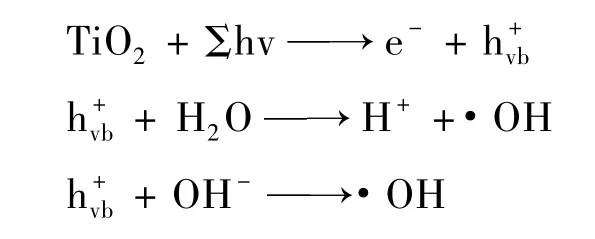
当能量相当于半导体禁带宽度的光照射到催化剂表面时,就会激发半导体内的电子从价带(valence band)跃迁至导带(conduction band),形成具有很强活性的电子-空穴对,并进一步诱导一系列氧化还原反应的进行。光生空穴具有很强的得电子的能力,可与催化剂表面吸附的OH-和H2O发生反应生成·OH。
(5)超声波反应活性物质生成过程如下。

当超声波(ultrasond)的频率为15 kHz~10 MHz时,在液相中会产生空穴效应,即微小气泡(空化核),在毫秒间产生、发展到湮灭,释放出局部能量,促进产生·OH[12]。
2.2 高级氧化反应活性物质的作用机理
上述活性物质中,起主要作用的是·OH,·OH的电子亲和能为569.3 kJ,容易进攻高电子云密度点。·OH的反应活性可以通过进攻点邻近的供电子基(α-OH、α-OR和酰胺N)而得以提高,通过电负性强的取代基而降低[11]。·OH对有机物的氧化作用可分为如下三种反应方式进行。
(1)脱氢反应

(2)亲电子加成

PH为苯的缩写,PHX为苯的卤代物,X为卤族元素。
(3)电子转移
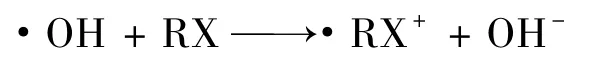
RX为卤代烃。
3 高级氧化降解GSM、MIB
3.1 O3/H2O2、UV/O3、UV/O3/H2O2和臭氧催化氧化
在水厂运行工艺中,臭氧直接氧化处理已比较普遍,但是直接氧化速度低,且选择性较高,对GSM、MIB去除效果不显著。结合臭氧的氧化机理,以臭氧为基础的高级氧化工艺(O3/H2O2、UV/O3、UV/O3/H2O2和臭氧催化氧化)在纯水和不同水质的实际水源水体(湖水、河水)中进行了去除GSM和MIB的研究,结果表明可达到人的嗅阈值之下[13]。根据研究不同试验条件下的臭氧氧化过程,发现通过增加臭氧剂量,提高pH、温度,添加H2O2,都可以提高对MIB和GSM氧化的效果,不同水质对试验过程有着不同影响,低溶解度有机碳(DOC)尤其是腐殖质可以提升去除效果[14,15]。就臭氧(或·OH)浓度和底物浓度两个因素,其反应动力学分别遵循二阶反应速率和一阶反应速率[16]。研究还发现GSM的氧化比MIB更快,有更高的速率常数。
3.1.1 不同试验条件下臭氧氧化去除 GSM、MIB的效果
与单独投加臭氧相比,添加H2O2后,对两嗅味物质的去除效果随着H2O2的增加而显著提高,但是在实际运行过程中,考虑到运行成本,仍有必要细化嗅味去除所需要的过氧化氢和臭氧的最优剂量。此外不同的水质参数对MIB和GSM的去除有不同的影响,低浓度的腐植酸等有机物会促进MIB的降解,反之就会抑制。有关水质对臭氧氧化MIB和GSM过程的影响,不同的科研团队得出了互不相同的结论。Liang等[17]研究发现GSM和MIB在不同水质中的氧化和降解率依次为纯净水>原水>沉后水;这两种化合物在原水中的处理效果比沉后水高,这与预期结果相反。主要归因于在原水中生成了更多的·OH,但是臭氧在纯水中的处理效果与原水相比,仅增加了5% ~10%,这暗示原水所含有机物对臭氧的氧化过程影响并不明显。与此相反,Li等[15]指出过高浓度的腐植酸可显著抑制臭氧降解MIB的效果,这可能是由于天然有机物质(NOM)在浓度与性质上相互竞争造成的;另一方面,低浓度的腐植酸却会使MIB的降解率更高。DOC尤其是腐殖质促进·OH的形成,同时也促进了臭氧与天然有机物的反应,而在 DOC浓度较高时会反过来消耗·OH。
3.1.2 臭氧催化氧化去除GSM、MIB
Qi等[18]采用不同的氧化铝(γ-薄水铝石、γ-氧化铝和α-氧化铝)催化臭氧氧化MIB,与直接臭氧化相比较,添加铝氧化物做催化剂的臭氧氧化后MIB的去除效果显著提高。MIB在被臭氧及臭氧催化降解时都遵循准一级动力学反应,包括两个阶段:初始阶段为瞬时臭氧需求(IOD)阶段,即臭氧和MIB快速氧化反应;第二阶段氧化反应相对较慢。根据臭氧氧化的两阶段反应理论,MIB的去除效果的提高主要在IOD阶段,这是因为臭氧分子转化为活性氧基团(如·OH)就在此阶段,在第二阶段中,残留臭氧分子氧化MIB的速度就比较缓慢了;该过程的效率依赖于臭氧、氧化铝和MIB的浓度等因素。据上述试验可知臭氧及臭氧催化氧化MIB的降解效果随pH增加均有提升。·OH基团和催化剂对MIB的不同吸附百分数,是影响不同铝氧化合物(γ-薄水铝石和γ-氧化铝)之间催化活性的重要因素;γ-氧化铝催化臭氧氧化加速产生·OH,来发挥作用,γ-薄水铝石催化臭氧氧化则遵循了颗粒表面反应机制[19]。
3.1.3 UV/H2O2/O3组合工艺去除 GSM、MIB
研究发现臭氧与紫外线照射的组合可以有效地提高整个过程的效果。当臭氧被紫外线照射后,导致其分解并产生·OH[20]。但是在不同水质、不同处理工艺条件下,GSM、MIB的降解率有所不同。VUV、UV/O3在纯水中的氧化处理效果最好。而对UV/H2O2工艺的研究更加广泛,适用的水质种类更多,在实际应用过程中需要针对不同的水质优选最佳的组合工艺。在水中观察到的较慢降解过程,证实了水质对反应显著影响的存在,同时在水中发生了针对反应的竞争性抑制过程[21]。最新的研究考察了基于紫外照射下,波长为254 nm(紫外区UV)和185 nm(真空紫外区 VUV)的 UV/H2O2、UV/O3、VUV/O3处理纯水和原水中GSM和MIB的效果[22]。在VUV和 UV/H2O2试验中,MIB的反应速率比GSM小。MIB、GSM与·OH的反应速率常数分别为8.20 ×109和1.40 ×1010L·mol-1·s-1。用 UV/O3处理GSM和MIB时,它们的降解常数并没有显著性的差异。相较于UV/H2O2工艺,即使在照射过程中使用高浓度的 H2O2(3.6 mg/L),VUV、UV/O3在纯水中的氧化处理效果也超过前者;而在原水较低的降解率是由于NOM或碳酸氢盐具有捕捉·OH的属性。应用UV/H2O2工艺来处理GSM和MIB的研究广泛开展,并在不同水质中进行了小试与中试规模的试验,来与直接光照进行比较,结果表明加入过氧化氢MIB和GSM的去除效率显著提升[23]。在这类反应过程中,·OH主要形成途径是通过紫外照射H2O2裂解形成的;这两种化合物的去除率随着过氧化氢的浓度及紫外线剂量的增加而增大[24]。
3.1.4 臭氧组合工艺反应过程中生成的中间产物特性
研究发现臭氧组合工艺在处理MIB时会产生TPs,这类物质种类繁多,致嗅特性,毒理特性不明确,还需进一步氧化去除。Qi等[25]通过试验发现异莰酮(一种TPs),将其进一步氧化,将会形成许多中间体,例如醛(甲醛、乙醛、丙醛、丁醛、乙二醛和甲基乙二醛)、酮和羧酸。Li等[15]通过 O3/H2O2试验研究MIB的降解和TPs的产生,MIB降解过程中产生的TPs通过气相色谱-质谱联用仪鉴定,TPs主要为 4-羟基-1,7,7-三甲基双环[2.2.1]庚烷-二酮、1,7,7-三甲基[2.2.1]庚烷-2,5-二酮、1,7,7-三甲基双环[2.2.1]庚烷-二酮、单环化合物、开环羧酸、醛酮等化合物。所形成的一些TPs,有可能造成水中产生异味,因此需要后续添加臭氧、臭氧/过氧化氢处理[19]。
3.2 光催化去除GSM、MIB
与一些基于过氧化氢降解GSM和2-MIB的同类反应相比,通过可见光或紫外线照射的光催化处理是一种很有前景的高级氧化技术。它结合了高分解能力(反应60 min降解率大于80%)、操作简便、成本低的优点;随着二氧化钛光触媒的大量商业化合成,使该工艺的总体成本大幅降低,近来已有许多关于其在浆液或固定化反应器用于去除 MIB[26]和 GSM[27]的研究。结果表明MIB和GSM的降解遵循准一级反应动力学。去除试验证明·OH对整体降解效果影响最显著[28],在一定范围内增加催化剂和提高照射强度使降解速率加大。还有试验观察到在D2O溶剂中GSM的降解程度显著减少,这就暗示了光催化过程中溶液的动力学效用受到了D2O的同位素效应的影响[29]。光催化处理GSM产生四种饱和、不饱和的化合物,通过气相色谱确定,分别是3,5-二甲基-1-烯、2,4-二甲基戊烷-3-酮、2-甲基丙酸乙酯、2-庚醇,这意味着GSM的转化是通过在不同位置断键后再迅速进行开环反应[29]。通过采用紫外线 UV(254 nm)、VUV(254~185 nm)在超纯和原水中直接光解去除MIB和GSM的试验[30],可知两种物质的降解速率和降解程度比光催化小,降解过程遵循准一级动力学,由于水体中天然有机物的存在而使速率常数减小,GSM比MIB的反应速率常数更大。
3.3 超声波去除GSM、MIB
使用640 kHz的超声波辐射MIB和GSM,其快速降解的反应遵循准一级反应动力学。GSM与MIB相比具有更强的挥发性,更大的降解速率,这证明发生在气液接触面的进程对降解至关重要[31]。六种 TPs[2-甲基-2-冰片烯、2-亚甲基莰烷、1-甲基莰烯、莰酮、1,2-二甲基-4-(丙-1-烯-2-基)环己烯-1 和1,2-二甲基-4-(丙-2-亚基)环己-1-烯]是超声诱导MIB通过脱水、解离和结构重排产生的转化产物;类似的,GSM被超声诱导脱水降解,一种降解途径是形成(1S,4aR)-1,4 二甲基-1,2,3,4,4a,5,6,7 八氢萘和(1S,4aR)-1,4a-二甲基-1,2,3,4,4a,5,6,7 八氢萘及随后的脱氢得到相应烯烃,另一个主要的降解途径则是开环并形成(S)-2-3-烯基-1,3二甲基环己烯-1-甲醛。
4 结语
(1)GSM和MIB是造成饮用水嗅味问题的主要物质。
(2)基于UV的高级氧化技术具有矿化程度高、反应快速等优势。O3/H2O2、UV/O3、UV/O3/H2O2工艺降解GSM、MIB过程均符合准一级反应动力学,并可最终降解到人的嗅阈值之下。光催化处理技术也是一种很有前景的去除技术,具有耗能低、使用周期长,可同时提供消毒的优势,随着二氧化钛光触媒的大量商业化合成,此技术的成本越来越低。
(3)在所有的臭氧氧化中,均有TPs形成。这类物质种类繁多,有致嗅特性,毒理特性尚不明确,仍需进行研究定性。
(4)有关现有的这两种化合物的去除研究,侧重于通过降解速率、矿化率和运行参数来评估高级氧化系统的性能,较少研究反应过程涉及的反应机制和中间体结构,这应是下一步的研究重点。
[1]Sagehashi M,Shiraishi K,Fujita H,et al.Ozone decomposition of 2-methylisoborneol(MIB)in adsorption phase on high silica zeolites with preventing bromate formation[J].Water Research,2005,39(13):2926-2934.
[2]Paerl H W,Hall N S,Calandrino E S.Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change[J].Science of the Total Environment,2011,409(10):1739-1745.
[3]Juottner F,Watson S B.Biochemical and ecological control of geosmin and 2-methylisoborneol in source waters[J].Applied and Environment Microbiology,2007,73(11):4395-4406.
[4]陈蓓蓓,高乃云,马晓雁,等.饮用水中嗅味物质-土臭素和二甲基异冰片去除技术[J].四川环境,2007,26(3):87-93.
[5]纪荣平,吕锡武,李先宁.富氧化水源水中嗅味物质的去除技术[J].给水排水,2004,30(10):8-12.
[6]张朝,尹宝国.城市给水系统嗅味问题初步探讨[J].城镇供水,2003,23(4):14-17.
[7]Sun A,Xiong Z,Xu Y.Removal of malodorous organic sulfides with molecular oxygen and visible light over metal phthalocyanine[J].Journal of Hazardous Materials,2008,152(6):191-195.
[8]Chestnutt T E,Bach M T,Mazyck T W.Improvement of thermal reactivated carbon for the removal of 2-methylisoborneol[J].Water Research.,2007,41(1):79-86.
[9]Comninellis C,Kapalka A,Malato S,et al.Advanced oxidation processes for water treatment:advances and trends for R&D[J].Journal of Chemical Technology and Biotechnology,2008,83(8):769-776.
[10]Konstantinou I K,Albanis T A.TiO2-assisted photocatalytic degradation ofazo dyes in aqueous solution:kinetic and mechanistic investigations:a review[J].Applied Catalysis B:Environmental,2004,49(2):1-14.
[11]Wojnarovits L, TakácsE. Irradiation treatmentofazodye containing wastewater:an overview[J].Radiation Physics and Chemistry,2008,77(8):225-244.
[12]Homem V, Santos L. Degradation and removal methods of antibiotics from aqueous matrices:a review[J].Journal of Environmental Management,2011,92(9):2304-2347.
[13]Ndreadakis A D,Mamais D,Gavalakis E A,et al.Removal of taste and odour from potable water by ozone and powdered activated carbon(PAC)[J].Int Environ.Waste Manag.,2010,5(3-4):392-409.
[14]Mizuno T,Ohara S,Nishimura F,et al.O3/H2O2process for both removal of odorous algal-derived compounds and control of bromate ion formation[J].Ozone-Science & Engineering,2011,33(2):121-135.
[15]Li X, HuangY, WangD. Efficiencyandmechanism of degradation of 2-methylisoborneol(2-MIB)by O3/H2O2in water[C].Chengdu:4th International Conference on Bioinformatics and Biomedical Engineering(iCBBE),2010.
[16]Miao H,Tao W.Ozonation of odorous organic compounds in eutrophic water[J].Environmental Science,2008,29(12):3439-3444.
[17]Liang C,Wang D,Chen J,et al.Kinetics analysis on the ozonation of MIB and Geosmin[J].Ozone-Science & Engineering,2007,29(12):185-189.
[18]Qi F,Xu B,Li S.Catalyzed ozonation decomposition of taste and odor-causing substances in water and simultaneous control of aldehyde generation[J].Environmental Engineering Science,2012,29(7):580-589.
[19]Qi F,Xu B,Chen D.Mechanism investigation of catalyzed ozonation of 2-methylisoborneol in drinking water over aluminum(hydroxyl)oxides:role of surface hydroxyl group[J].Chemical Engineering Science,2010,165(2):490-499.
[20]Collivignarelli C,Sorlini S.AOPs with ozone and UV radiation in drinking water:contaminants removal and effects on disinfection by-products formation[J].Water Science and Technology,2004,49(4):51-56.
[21]Klausen M M,Grønborg O.Pilot scale testing of advanced oxidation processesfordegradation ofgeosmin and MIB in recirculated aquaculture[J].Water Science and Technology,2010,10(2):217-225.
[22]Zoschke K,Dietrich N,Bornick H,et al.UV-based advanced oxidation processes for the treatment of odourcompounds:efficiency and by-product formation[J].Water Research,2012,46(16):5365-5373.
[23]Jo C H,Dietrich A M,Tanko J M.Simultaneous degradation of disinfection byproducts and earthy-musty odorants by the UV/H2O2advanced oxidation process[J].Water Research,2011,45(8):2507-2516.
[24]Dani D, LindenK, SummersR S. EvaluatingUV/H2O2performance for taste and odor control[C].American Water Works Association Water Quality Technology Conference and Exposition,2007.
[25]Qi F,Xu B,Chen Z,et al.Efficiency and products investigations on the ozonation of 2-methylisoborneol in drinking water[J].Water Environment Research,2009,81(12):2411-2419.
[26]Tran H,Evans G M,Yan Y,et al.Photocatalytic removal of taste and odour compounds for drinking water treatment[J].Water Science and Technology,2009,9(5):477-483.
[27]Bamuza-Pemu E E,Chirwa E M.Photocatalytic degradation of geosmin:reaction pathway analysis[J].Water SA,2012,38(5):689-696.
[28]Bamuza-Pemu E E,Chirwa E M N.Photocatalytic degradation of geosmin:Intermediates and degradation pathway analysis[J].Chem.Eng.Trans.,2011,24(7):91-96.
[29]Robertson P K J,Bahnemann D W,Lawton L A,et al.A study of the kinetic solvent isotope effect on the destruction of microcystin-LR and geosmin using TiO2photocatalysis[J].Applied Catalysis B:Environmental,2011,46(108-109):1-5.
[30]Kutschera K,Bornick H,Worch E.Photoinitiated oxidation of geosmin and 2-methylisoborneol by irradiation with 254 nm and 185 nm UV light[J].Water Research,2009,43(8):2224-2232.
[31]Song W,O'Shea K E.Ultrasonically induced degradation of 2-methylisoborneol and geosmin[J].Water Research,2007,41(12):2672-2678.

