CT引导下三维后装治疗周围型非小细胞肺癌肺内转移灶的疗效观察
向 莉,张振华,庞皓文,杨 波,林 盛,吴敬波
(泸州医学院附属医院肿瘤科,四川泸州 646000)
·临床探讨·
CT引导下三维后装治疗周围型非小细胞肺癌肺内转移灶的疗效观察
向 莉,张振华,庞皓文,杨 波,林 盛△,吴敬波
(泸州医学院附属医院肿瘤科,四川泸州 646000)
目的 评估三维后装治疗非小细胞肺癌(NSCLC)肺内转移灶的疗效及安全性。方法 选取1例NSCLC术后肺内转移患者,在CT引导下,采用肺插植放疗治疗肺内转移病灶。将CT扫描图像传至三维放射治疗计划系统,勾画靶区及正常组织,并三维重建。计划验收满意后,采用单次剂量为30 Gy后装放疗。结果 患者疗效评价达完全缓解,患者插植针植入过程中未出现气胸、血胸等不适。结论 CT引导下三维后装治疗周围型NSCLC肺内转移灶取得满意的局部控制,操作安全,不良反应小,但需要增加样本量和延长随访时间验证其临床实用性。
非小细胞肺癌; 转移; 后装
中国是全球范围内最大的烟草生产国和消费国,而肺癌是最常见的吸烟相关的疾病,非小细胞肺癌(NSCLC)占肺癌的85%[1-2]。外科手术仍是早期NSCLC患者的首选治疗手段,但是大约30%的患者术后会出现局部或区域复发,是治疗失败的主要原因之一[3-5]。术后局部复发的病灶如果比较局限,再次手术仍能获得较长的生存期[6]。由于NSCLC术后肺内孤立转移的患者存在肺功能低下和病期较晚等原因,仅有少于30%的患者适合再手术,而70%以上的患者只能接受放射治疗与化学治疗,生存率低于再手术组,因此寻找新的局部补救治疗手段具有重要的临床意义[7]。当予以有效生物剂量(BED)超过100 Gy,局部控制率上升到80%以上[8]。然而,对于常规外照射技术,由于邻近的正常组织剂量限制,导致无法实现高的肿瘤致死剂量。立体定向放射治疗(SBRT)具有快速剂量跌落梯度,可实现高剂量集中于较小的肿瘤区域,但是由于持续的呼吸运动,引起器官运动误差仍然是需要解决的问题[9]。后装放疗具有对病变提供单次高剂量导致长时间细胞致死的优点,可以缩短治疗时间和更好的器官保护,相对于体外放射治疗技术,后装放疗可以提供更好的剂量曲线,而且呼吸对靶区的精度和可重复性的影响很小。经皮插植放疗用于肺内恶性肿瘤病灶治疗,国外的报道已证明其安全性、有效性和可行性[10-12]。国内目前尚无对于NSCLC切除术后肺内孤立性转移灶的研究,本文旨在评价三维后装治疗NSCLC切除术后肺内孤立性转移灶的临床疗效和安全性,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 选取1例NSCLC(T1N1M0)术后1年出现孤立转移患者(男性,65岁)进行CT引导下三维后装放疗。患者正电子发射计算机断层显像(PET/CT)检查诊断为肺内孤立性转移;肺外无病灶;CT引导下经皮肺穿刺活检病理结果与首次一致;患者拒绝手术切除。
1.2 CT引导下三维后装放疗 本治疗方案符合人体试验伦理学标准及赫尔辛基宣言,并取得伦理委员会的批准及患者知情同意。局部麻醉后,在CT引导下植入插植针,针间距为1.0~1.5 cm。为了避免划伤胸膜,植入针时一定要小心,避免呼吸,最后CT扫描进行验证,确认所有的针都在正确的位置。CT扫描层厚为2.5 mm,图像传至三维放射治疗计划系统(ONCENTRA)计划系统。危及器官(OAR)包括肺、心脏、食管和脊髓。靶区勾画完成后采用三维图像重建,高剂量率后装放疗使用铱-192放射源。30 Gy(BED=120 Gy)单次剂量覆盖肿瘤靶区(GTV)90%剂量曲线。因参照立体放射治疗经验,对于靶区体积不扩大以考虑临床靶区(CTV),即CTV和GTV概念等同[13]。正常器官及肿瘤靶区计算剂量体积时均转换为等效生物学剂量。V20是OAR接受大于或等于20 Gy的体积百分比,Dmax为给定体积的最大剂量,Dmean为危及器官的平均剂量,肺平均剂量(MLD)表示照射到双肺的平均剂量。为了在放疗后保护正常器官的功能,可以规定正常组织必须满足剂量-体积约束条件:(1)脊髓Dmax≤45 Gy;(2)肺的V20和V5分别低于30%和65%;(3)MLD是不超过20 Gy;(4)心脏的V30和V40分别小于40%和30%;(5)食道Dmean≤34 Gy,Dmax≤58 Gy。治疗结束后插植针拔出时患者屏住呼吸。患者在充分呼气时再次行胸部CT,以检查任何延迟气胸或血胸。患者留院观察24 h,同时与调强放疗(IMRT)进行模拟剂量学比较。采用IMRT方案时,CTV外扩8 mm,计划靶区(PTV)在CTV的基础上头脚方向外扩1.5 cm,轴向平面外扩1 cm,不超过正常器官边界。比较2种照射方式下危及器官的剂量。
1.3 化疗方案 患者第1天和第8天采用吉西他滨1.25 g/m2静脉滴注,第2天采用卡铂350 mg/m2静脉滴注的方案进行化疗。化疗周期为21 d。
1.4 并发症的评估 在插植时或随后1周内发生的并发症被定义为围手术期并发症。严重并发症定义为危及生命,并需要延长住院时间和紧急医疗救治。轻度的并发症包括轻度血丝痰、血胸、气胸等,不需要任何复苏措施。
1.5 疗效和毒性评价标准 依据实体瘤治疗疗效评价标准(RECIST)评价治疗疗效。放疗的相关性毒性参照放射治疗肿瘤组(RTOG)/欧洲组织研究和治疗癌症(EORTC)标准评估急性或晚期不良反应,预期的随访期为2年。植入3周后行PET/CT,以后每3个月行胸部CT检查。
2 结 果
2.1 并发症及毒性评估 患者已随访1年。患者后装治疗结束后复查胸部CT未出现气胸、血胸等不良反应。患者诉穿刺点疼痛,疼痛分级(VAS评分)为3分,24 h后自行缓解。患者接受了4个周期的吉西他滨+卡铂化疗。化疗过程中出现Ⅲ度白细胞下降,予以升白细胞治疗恢复正常。随访过程中胸部CT未出现放射性肺炎改变。
2.2 疗效评估 患者放疗后3周复查PET/CT肿瘤体积无明显变化,但发现部分肿瘤出现坏死,标准摄取值(SUV)由治疗前的7.6下降至4.3。治疗后3个月复查胸部CT疗效评价达完全缓解(CR),随访1年时患者未出现复发及转移征象。
2.3 剂量学评估 换算为等效生物学剂量进行计算,患者后装放疗GTV的D90为134.3 Gy,D95为120.4 Gy;双肺V30为5.33%,V20为8.05%,V5为16.20%,MLD为10.2 Gy;食道Dmean为11.7 Gy,Dmax为38.9 Gy;脊髓Dmax为30 Gy;心脏V30和V40均为0.00%。采用调强放疗(IMRT)模拟剂量比较时,PTV D90为120.0 Gy,D95为119.0 Gy;双肺V30为9.10%,V20为14.50%,V5为28.10%,MLD为11.4 Gy;食道Dmean为13.7 Gy,Dmax为63.0 Gy;脊髓Dmax为38.1 Gy;心脏V30和V40也均为0.00%。见表1。
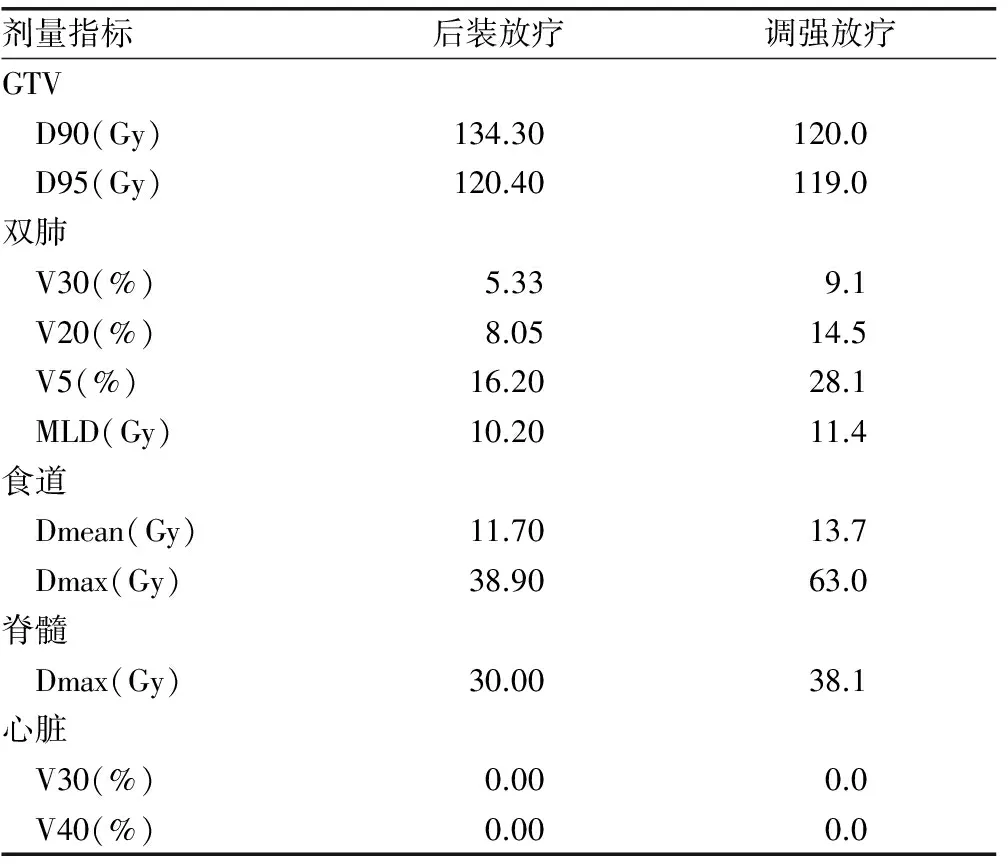
表1 后装放疗与调强放疗剂量比较
3 讨 论
高剂量放疗可以提高肺癌的局部控制率和总生存率,但是肺组织的耐受性限制了对肿瘤照射剂量的提高。放射性肺炎是胸部照射最常见的严重并发症和剂量限制因素,目前尚缺乏有效防护手段,对肺实质的损伤较为严重,最终发展为不可逆转的放射性肺纤维化,一旦发生将会严重影响患者生活质量,甚至可成为致死的直接原因[14]。而放射性肺炎与肺的受照体积密切相关。由于组织间放疗的剂量梯度可以将高剂量集中在很小的区域,这些剂量限制影响对于近距离放疗中几乎可以忽略不计。基于理论原理,后装放疗优于任何形式的外照射治疗。
近年来,CT引导下射频消融术成为一种不适合手术治疗的原发性或转移性肺肿瘤的新的局部治疗手段,但可能出现严重肺损伤或者死亡,治疗后的病死率可达5.6%[15]。气胸是常见的并发症,有28.4%发生气胸,9.8%患者需要胸腔闭式引流,还包括热损伤邻近结构导致穿孔、出血、疼痛等[16]。经皮植入碘-125(I-125)粒子已广泛用于周围型肿瘤,但仍存在粒子迁移或关键结构(如肺动脉)的高剂量有关的严重并发症。同时存在医务人员遭受辐射暴露的危险[17]。
NSCLC术后单发转移的治疗应该在患者身体条件允许的条件下首选局部治疗,同时辅以全身治疗以提高局部控制率。但由于患者首次治疗已行肺叶切除,多数肺癌患者合并肺部慢性疾患,再次手术存在一定安全隐患。立体放射治疗由于其满意的剂量分布在肺癌中广泛使用。但由于持续的呼吸运动引起的器官运动误差仍可能导致肿瘤脱靶。呼吸门控技术可在一定程度上控制呼吸对肿瘤靶区的影响,能精确勾画靶区位置,但由于其技术复杂,费用昂贵,目前无法广泛开展。
最近,已有研究报道了CT引导下后装放疗治疗NSCLC取得令人满意的结果。这一方法已被认为是肺部恶性肿瘤一种新型的、可行的、微创治疗方法。因为施源管相对于肿瘤具有恒定的位置,呼吸运动不是CT引导下组织间插植放疗的制约因素。虽然这种治疗的经验是相对有限,但它在提高患者局控率,改善患者生存质量有非常大的潜力。
采用CT引导下后装放疗治疗NSCLC术后复发患者,该例患者在治疗后3周,患者PET/CT显示肿瘤SUV由7.6下降至4.3,说明单次高剂量的插植放疗已引起肿瘤细胞的早期凋亡。治疗过程中患者无气胸、血胸、呼吸困难及心悸等不良反应,治疗3个月后疗效评价CR,随访1年时患者仍达到满意的局部控制。Sharma等[18]报道其1年局控率为75%,与其使用1根插植针治疗4 cm以内的肿瘤导致剂量分布不均有关。根据巴黎系统剂量分布要求对直径大于1.5 cm的病灶需要使用多针以充分覆盖,获得均匀的剂量分布,因此可以确定针间距为1.0~1.5 cm,从而获得满意的剂量分布。
CT插植放疗在NSCLC术后转移患者的治疗中显示出不良反应低,局控好的优势,但由于随访时间短,病例数少,因此需要增加样本量来验证其临床实用性。
[1]Gu D,Kelly TN,Wu X,et al.Mortality attributable to smoking in China[J].N Engl J Med,2009,360(18):150-159.
[2]Sandler A,Gray R,Perry MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N Engl J Med,2006,355(24):2542-2550.
[3]Saynak M,Veeramachaneni NK,Hubbs JL.Local failure after complete resection of N0-1 non-small cell lung cancer[J].Lung Cancer,2011,71(2):156-165.
[4]Kelsey CR,Marks LB,Hollis D,et al.Local recurrence after surgery for early stage lung cancer:an 11-year experience with 975 patients[J].Cancer,2009,115(22):5218-5227.
[5]Dai Y.Survival analysis of 220 patients with completely resected stage-Ⅱ non-small cell lung cancer[J].Chin J Cancer,2010,29(5):538-544.
[6]Kodama H,Yamakado K,Takaki H,et al.Lung radiofrequency ablation for the treatment of unresectable recurrent non-small-cell lung cancer after surgical intervention[J].Cardiovasc Intervent Radiol,2012,35(3):563-569.
[7]刘宝东,刘磊,胡牧,等.肺癌切除术后肺内孤立性转移复发灶的射频消融治疗[J].中国肺癌杂志,2014,17(6):460-464.
[8]Baumann P,Nyman J,Hoyer M,et al.Outcome in a prospective phase Ⅱ trial of medically inoperable stage I non-small-cell lung cancer patients treated with stereotactic body radiotherapy[J].J Clin Oncol,2009,27(20):3290-3296.
[9]Ikushima H,Balter P,Komaki R,et al.Daily alignment results of in-room computed tomography-guided stereotactic body radiation therapy for lung cancer[J].Int J Radiat Oncol Biol Phys,2011,79(2):473-480.
[10]Imamura F,Chatani M,Nakayama T,et al.Percutaneous brachytherapy for small-sized non-small cell lung cancer[J].Lung Cancer,1999,24(3):169-174.
[11]Riceke J,Wust P,Wieners G,et al.CT-guided interstitial single-fraction brachytherapy of lung tumors:phase I results of a novel technique[J].Chest,2005,127(6):2237-2242.
[12]Peters N,Wieners G,Pech M,et al.CT-guided interstitial brachytherapy of primary and secondary lung malignancies:results of a prospective phase Ⅱ trial[J].Strahlenther Onkol,2008,184(6):296-301.
[13]Videtic GM,Hu C,Singh A,et al.Radiation Therapy Oncology Group(RTOG) Protocol 0915:A Randomized Phase 2 Study Comparing 2 Stereotactic Body Radiation Therapy(SBRT) Schedules for Medically Inoperable Patients With Stage I Peripheral Non-Small Cell Lung Cancer[J].Int J Radiat Oncol Biol Phys,2013,87(2):S3.
[14]张晓晶,孙建国,孙洁,等.肺癌三维适形放射治疗所致放射性肺炎的相关因素分析[J].重庆医学,2012,41(11):1065-1068.
[15]Powell JW,Dexter E,Scalzetti EM,et al.Treatment advances for medically inoperable non-small-cell lung cancer:emphasis on prospective trials[J].Lancet Oncol,2009,10(9):885-894.
[16]Simon CJ,Dupuy DE,Dipetrillo TA,et al.Pulmonary radiofrequency ablation:long-term safety and efficacy in 153 patients[J].Radiology,2007,243(1):268-275.
[17]Trombetta MG,Colonlas A,Makishi D,et al.Tolerance of the aorta using intraoperative iodine-125 interstitial brachytherapy in cancer of the lung[J].Brachytherapy,2008,7(1):50-54.
[18]Sharma DN,Rath GK,Thulkar S,et al.Computerized tomography-guided percutaneous high-dose-rate interstitial brachytherapy for malignant lung lesions[J].J Cancer Res Ther,2011,7(2):174-179.
国家自然科学基金资助项目(81201682)。
10.3969/j.issn.1672-9455.2015.15.043
A
1672-9455(2015)15-2243-03
2015-02-15
2015-04-10)
△通讯作者,E-mail:lslinsheng@163.com。

