负载抗原的DC与CIK共培养对多药耐药肝癌细胞HepG2/ADM的杀伤作用及其机制研究
徐巧元,杨志祥,罗 阔
(1.重庆市第五人民医院肿瘤科 400062;2.重庆市中山医院肿瘤科400013)
·论 著·
负载抗原的DC与CIK共培养对多药耐药肝癌细胞HepG2/ADM的杀伤作用及其机制研究
徐巧元1,杨志祥2△,罗 阔2
(1.重庆市第五人民医院肿瘤科 400062;2.重庆市中山医院肿瘤科400013)
目的 观察负载抗原的树突状细胞(DC)与细胞因子诱导的杀伤细胞(CIK)对高表达P-糖蛋白(P-gp)的多药耐药(MDR)的肝癌细胞株HepG2/ADM细胞的杀伤作用和机制研究。方法 用常规方法诱导健康志愿者外周血中单个核细胞产生DC和CIK细胞,制备HepG2/ADM细胞冻融抗原后冲击DC,并与CIK细胞分别共培养24、48、72、96 h,并将未负载抗原的DC和CIK细胞共培养作为对照。采用流式细胞术鉴定DC、CIK细胞的表型,采用CCK-8试剂检测HepG2/ADM细胞的增殖活力。用RT-PCR检测各组细胞内mdr-1 mRNA的水平变化,Western blot检测细胞内P-gp蛋白水平的变化。结果 与未负载抗原的DC-CIK相比,负载抗原的DC-CIK表面分子表达明显增高(P<0.05),对HepG2/ADM细胞增殖活力抑制作用更加明显(P<0.05)。RT-PCR和Western blot结果分别显示,随着作用时间的延长,未负载抗原的DC-CIK和负载抗原DC-CIK的HepG2/ADM细胞内的mdr-1 mRNA和P-gp蛋白水平分别都有明显的降低(P<0.05),而且后者的抑制作用更明显(P<0.05)。结论 经抗原冲击的DC和CIK共培养可以明显提高对多药耐药HepG2/ADM细胞株的杀伤活性,其机制可能与抑制与MDR密切相关的mdr-1基因和及其编码的P-gp蛋白水平有关。
细胞因子诱导的杀伤细胞; 树突状细胞; 多药耐药; P-糖蛋白; HepG2/ADM细胞
树突状细胞(DC)是体内已知功能最强、唯一能活化静息T细胞的专职抗原提呈细胞。细胞因子诱导的杀伤细胞(CIK)一种新型的免疫活性细胞,它是将人外周血单个核细胞在体外用多种细胞因子共同培养一段时间后获得的一群异质细胞。研究表明,CIK和DC两者共培养后具有更强的增殖活性和细胞毒性,能刺激机体的免疫系统,诱导产生特异性的抗肿瘤免疫反应,从而达到治疗肿瘤的目的。目前DC联合CIK细胞免疫治疗在多种实体肿瘤和血液系统疾病中得到令人鼓舞的效果,而对于肝癌细胞多药耐药性调节方面报道较少,故本研究欲将CIK 细胞与负载耐药肝癌HepG2/ADM细胞冻融抗原的DC细胞共培养,观察其对细胞杀伤性的影响,并探讨其机制[1-3]。现将研究结果报道如下。
1 材料与方法
1.1 细胞系 DC和CIK细胞取自健康志愿者的外周血,HepG2肝癌细胞株来自重庆医科大学分子与肿瘤研究中心,并建立由阿霉素诱导的多药耐药细胞株HepG2/ADM。
1.2 仪器与试剂 RPMI-1640培养液和胎牛血清购自Gibco公司;人淋巴细胞分离液为TBS产品;RHGM-CSF、TNF-α、IFN-γ、IL-2和IL-4购自厦门特宝生物工程股份有限公司;CD3单克隆抗体(CD3McAb)购自深圳达科为生物有限公司;FITC标记的CD3、CD8、CD56、CD80、CD83、CD86和主要组织相容性复合体Ⅱ(MHCⅡ)单克隆抗体购自美国eBioscience公司;IL-2和IFN-γ的ELISA试剂盒购自博士德生物公司;CCK-8试剂盒购自日本株式会社;Annexin V-FITC/PI 购自凯基生物。RT-PCR试剂盒购自大连宝生生物工程有限公司,mdr-1引物由Invitrogen公司设计并合成。P-gp单克隆抗体购自Santa Cruz公司,内参抗体β-actin购自博鳌森生物有限公司。
1.3 方法
1.3.1 细胞冻融抗原的制备 常规收集对数生长期的HepG2/ADM细胞,磷酸缓冲液(PBS)冲洗3遍后,再用PBS稀释将浓度调整至1×108/mL,制成细胞悬液。在-80 ℃冰冻,后于37 ℃融解,如此反复冻融3次,再于冰浴中超声波破碎,以3 000 r/min离心10 min,收集上清液,过滤除菌,存放于4 ℃备用。
1.3.2 DC和CIK细胞的诱导培养和共培养 取自于健康志愿者的外周血,经血细胞分离机和淋巴细胞分离液梯度离心法分离纯化单个核细胞。用含10% FCS的RPMI 1640培养基将细胞浓度调整为5×106/mL,加入6孔板中,于37 ℃,5% CO2培养箱培养2 h。收集培养上清中的悬浮细胞作为诱导CIK细胞备用。用含有1 000 U/mL CM-CSF、500 U/mL IL-4、500 U/mL TNF-α以及10% FCS的RPMI 1640培养基继续培养贴壁细胞。每3天换1次液,在第4天,向一部分DC培养液中按100 U/mL加入冻融抗原,诱导至第7天收获成熟DCs。将收集的悬浮细胞密度调整至2×106/mL加入6孔板中,用含50 ng/mL 抗CD3单抗、2 000 U/mL IFN-γ、1 000 U/mL IL-2以及10% FCS的RPMI 1640培养基继续培养。每3天换1次液,诱导至14 d收获CIK细胞。将收获的负载抗原和未负载抗原的DC分别与CIK细胞共培养(DC∶CIK=1∶100),采用CIK培养液,分别命名为Ag-DC-CIK和DC-CIK。共培养4 d后,收集细胞备用。
1.3.3 流式细胞术鉴定DC和CIK细胞的免疫表型 共培养4 d的DC以及CIK细胞,用PBS将细胞密度调整至1×106/mL,分别加入相应的抗体,混匀后在室温下避光孵育30 min,再用PBS洗涤3遍,加入1%多聚甲醛固定。采用流式细胞仪检测DC表型(CD80、CD83、CD86、MHCⅡ)和CIK表型(CD3、CD8、CD56)。
1.3.4 CCK-8检测共培养细胞对肝癌HepG2/ADM细胞的杀伤作用 将处于对数生长期的HepG2/ADM细胞以1×104/孔接种于96孔板中,培养12 h细胞贴壁后,将DC-CIK细胞或Ag-DC-CIK细胞加入HepG2/ADM培养体系中(效靶比1∶1、10∶1、100∶1),继续培养24、48、72、96 h。在培养相应时间点后加入10 μL的CCK-8试剂,37 ℃孵育2 h,于酶标仪上490 nm处比色。根据公式计算细胞活力:细胞活力=A490(处理组)/A490(自然生长组)×100%。
1.3.5 RT-PCR 收集DC-CIK细胞或Ag-DC-CIK细胞共培养的各组HepG2/ADM细胞,PBS充分洗涤后,参照Trizol试剂盒说明书提取细胞总RNA,用RT-PCR法检测各组细胞中mdr-1基因的表达量。Mdr-1上游引物:5′-GTA CCC ATC ATT GCA ATA GC-3′;下游引物:5′-CAA ACT TCT GCT CCT GAG TC-3′,扩增产物大小为167 bp。内参GAPDH上游引物:5′-CGG AGT CAA CGG ATT TGG TCG TAT-3′;下游引物:5′-AGC CTT CTC CAT GGT GGT GAA GAC-3′,扩增产物大小为228 bp。扩增条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸5 min,35个循环;72 ℃ 延伸7 min。扩增产物以1.5%琼脂糖凝胶进行电泳,凝胶成像扫描。用Quantity One灰度分析软件进行吸光度值计算。以目的基因mdr-1条带灰度值与内参GAPDH条带灰度值的比值作为mdr-1 mRNA的表达量,并重复3次。
1.3.6 Western blot 收集各组细胞提取总蛋白,并测定蛋白的浓度为(2.12±0.24)mg/mL。取蛋白样品20 μL,经过SDS-PAGE电泳后,将蛋白电转移至PVDF膜,以5%脱脂奶粉TBST液封闭后,加入P-糖蛋白(P-gp)抗体4 ℃孵育过夜,洗涤后加入HRP标记的二抗室温孵育1 h后,ECL底物化学发光显色后曝光显影。通过Chemi DocXRS化学发光成像系统,进行曝光分析,然后计算其比值表示结果,即:相对吸光度=目的蛋白P-gp吸光度/β-actin蛋白吸光度。

2 结 果
2.1 DC与Ag-DC细胞的免疫表型的比较 在DC诱导培养7 d后,分别收集DC和Ag-DC,采用流式细胞术鉴定DC表面标志物CD80、CD83、CD86、MHCⅡ,结果见表1。DC分别为:(24.13±2.31)%、(18.77±0.63)%、(33.99±1.53)%、(32.02±2.30)%,而Ag-DC分别为:(42.42±2.27)%、(36.08±2.10)%、(36.66±2.10)%、(42.39±2.55)%。因此,结果显示DC负载抗原后,表面标志物的表达均有上升,且2组间CD80、CD83以及MHCⅡ的差异有统计学意义(P<0.05)。见表1。
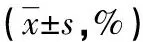
表1 诱导7 d后DC与Ag-DC细胞的免疫表型的表达量
注:DC组与Ag-DC组比较,*P<0.05。
2.2 与DC或Ag-DC共培养后CIK细胞的免疫表型比较 在DC-CIK和Ag-DC-CIK共培养4 d后,收集2组CIK细胞,采用流式细胞术进行表型鉴定,DC-CIK组的CIK细胞CD3+CD8+、CD3+CD56+细胞分别为(25.79±1.70)%、(8.94±0.63)%,而Ag-DC-CIK组的CIK细胞分别为(32.48±1.00)%、(13.97±1.25)%。该结果提示,负载抗原的DC比未负载抗原的DC更能提高CD3+CD8+CIK和CD3+CD56+CIK的百分比。见表2。
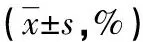
表2 共培养4 d后2组CIK细胞的免疫表型
注:DC-CIK组与Ag-DC-CIK组比较,*P<0.05。
2.3 DC-CIK和Ag-DC-CIK共培养细胞对肝癌HepG2/ADM细胞的杀伤作用 将DC-CIK或Ag-DC-CIK按效靶比分别为1∶1、10∶1、100∶1与肝癌细胞HepG2/ADM共培养,采用CCK-8试剂检测2组共培养细胞对肝癌细胞增殖活力的杀伤作用。当效靶比为1∶1时,无论作用多长时间,2组HepG2/ADM细胞增殖活力下降均不明显。当效靶比为10∶1时,2组共培养细胞在48 h出现杀伤作用,随着作用时间延长,HepG2/ADM细胞增殖活力下降越明显(P<0.05),且Ag-DC-CIK组的细胞活力明显低于DC-CIK组(P<0.05)。当效靶比在100∶1时,共培养细胞的杀伤作用更强,Ag-DC-CIK组在24 h就使HepG2/ADM细胞增殖活力下降至(81.8±4.67)%,当作用时间至96 h,DC-CIK组的HepG2/ADM细胞活力大大降低至(42.23±3.01)%,甚至在Ag-DC-CIK组仅剩(19.14±2.06)%。该结果显示,效靶比在1∶1到100∶1范围内时,共培养细胞对肝癌HepG2/ADM细胞的杀伤作用与效靶比呈正相关,且具有时间依赖性,差异有统计学意义(P<0.05),且Ag-DC-CIK细胞抗癌作用明显优于DC-CIK组(P<0.05)。见表3。
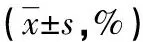
表3 共培养细胞对肝癌HepG2/ADM细胞的杀伤作用
注:与自然生长组比较,*P<0.05;与相同效靶比的DC-CIK组比较,△P<0.05。
2.4 DC-CIK和Ag-DC-CIK共培养细胞对肝癌HepG2/ADM细胞内mdr-1 mRNA表达的影响 根据前面的实验结果,将DC-CIK和Ag-DC-CIK按效靶比为10∶1与肝癌细胞HepG2/ADM共培养,分别于培养24、48、72和96 h后收集各组细胞。采用RT-PCR法和凝胶电泳成像分析,在DC-CIK与HepG2/ADM共培养72 h后,细胞内mdr-1 mRNA的表达量才有明显的下降,作用96 h后,其表达下降更明显,差异有统计学意义(P<0.05);而在Ag-DC-CIK与HepG2/ADM共培养48 h后,细胞内mdr-1 mRNA的表达已有明显降低,且随着作用时间的延长,细胞内的mdr-1 mRNA下降更明显,差异有统计学意义(P<0.05),具有时间依赖性。而且,在48 h时,与DC-CIK比较,Ag-DC-CIK对HepG2/ADM细胞内mdr-1 mRNA的抑制作用较更明显(P<0.05)。见图1、表4。
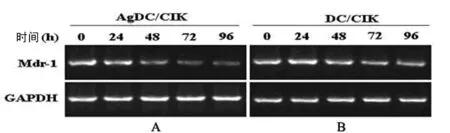
注:A表示Ag-DC-CIK共培养细胞对肝癌HepG2/ADM细胞内mdr-1 mRNA表达的影响;B表示DC-CIK共培养细胞对肝癌HepG2/ADM细胞内mdr-1 mRNA表达水平的比较。

图1 DC-CIK和Ag-DC-CIK共培养细胞对肝癌HepG2/ADM细胞内mdr-1 mRNA表达的影响和比较
注:与0 h组相比,*P<0.05,**P<0.01;Ag-DC-CIK组与DC-CIK组相比,§P<0.01。
2.5 DC-CIK和Ag-DC-CIK共培养细胞对肝癌HepG2/ADM细胞内P-gp蛋白表达水平的影响 将DC-CIK和Ag-DC-CIK按效靶比为10∶1与肝癌细胞HepG2/ADM共培养,分别于培养24、48、72和96 h后收集各组细胞。采用WB法和凝胶成像分析,在DC-CIK与HepG2/ADM共培养48 h后,细胞内P-gp蛋白的表达量有明显的下降,作用72、96 h后,其表达下降更明显,差异有统计学意义(P<0.01);在Ag-DC-CIK与HepG2/ADM共培养48 h后,细胞内P-gp蛋白的表达也有明显降低,且随着作用时间的延长,细胞内的P-gp蛋白表大量下降更明显,具有时间依赖性差异有统计学意义(P<0.05)。而且,在72 h后,与DC-CIK比较,Ag-DC-CIK对HepG2/ADM细胞内P-gp蛋白水平的抑制作用更明显差异有统计学意义(P<0.05)。见图2、表5。
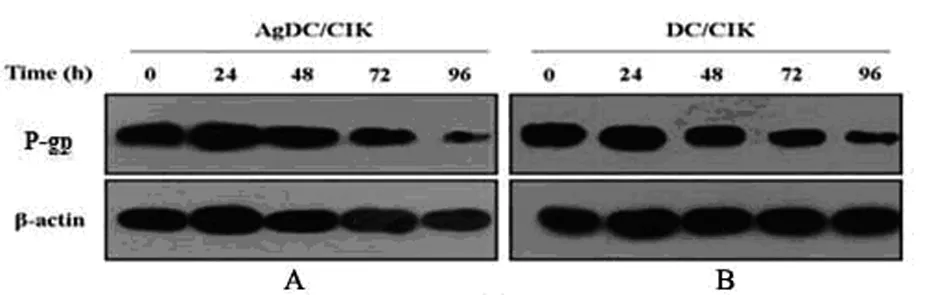
注:A表示Ag-DC-CIK共培养细胞对肝癌HepG2/ADM细胞内P-gp蛋白表达水平的影响;B表示DC-CIK共培养细胞对肝癌HepG2/ADM细胞内P-gp蛋白表达水平的比较。
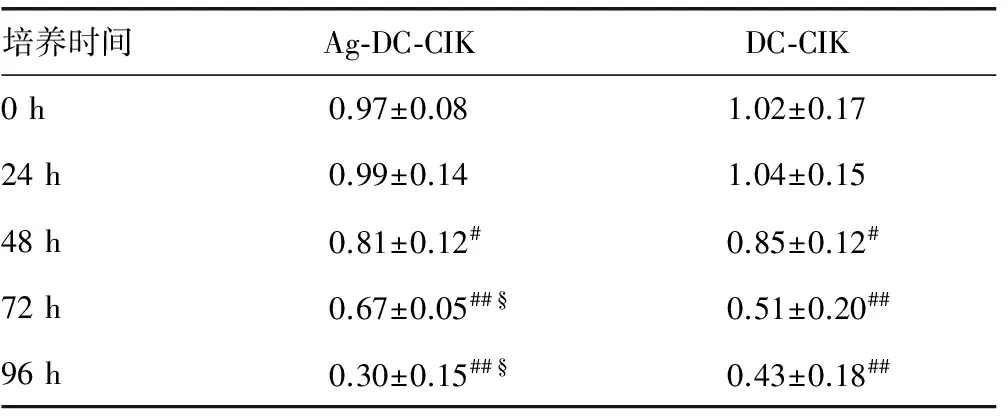
图2 DC-CIK和Ag-DC-CIK共培养细胞对肝癌HepG2/ADM细胞内P-gp蛋白表达水平的影响和比较
注:与0 h组比较,#P<0.05,##P<0.01;Ag-DC-CIK组与DC-CIK组比较,§P<0.01。
3 讨 论
多药耐药(MDR)是指肿瘤细胞对一种抗肿瘤药物产生抗药性的同时,对结构和作用机制不同的多种抗肿瘤药物产生交叉抗药性,从而极大地降低了抗肿瘤药物的疗效。MDR的发生是许多种肿瘤化疗失败的主要原因,其形成的机理复杂多样,而多药耐药基因mdr1编码的P-gp过度表达是其重要原因之一,P-gp能够将亲脂类化疗药物泵出细胞外,从而导致耐药特性[4]。Mdr-1和P-gp在多种恶性肿瘤细胞中的过度表达是形成MDR的重要机制,也是肿瘤患者化疗效果差、预后差、复发率高的重要原因,因此寻找有效的MDR逆转剂一直是抗肿瘤研究的热点[5-6]。
肝癌是消化系统最为常见的恶性肿瘤之一,针对因糖蛋白P-gp高表达引发MDR而导致的肝癌居高不下的发病率和死亡率,各种新型的治疗策略正在迅速地被发掘,其中细胞免疫治疗因其能提高肝癌患者的生存率和降低复发率而备受临床医生和患者的青睐。
CIK是一类具有非MHC限制性的T细胞,具有强大的光谱的杀瘤效应,如肺癌、胃癌、乳腺癌等,而其主要的效应细胞给CD3+和CD6+淋巴细胞[7-9]。DC分布于全身各处,它具有强大的抗原呈递作用,它能激活初始型的T细胞增殖并建立初级免疫应答。DC在体外可以通过多种细胞因子诱导生成。将DC与CIK共培养,前者可识别病原、激活获得性免疫系统,后者通过发挥自身的细胞毒性与分泌细胞因子杀伤肿瘤细胞,因此能够提高CIK的抗瘤疗效。因此,在本研究中,通过利用DC-CIK联合培养,然后作用于多药耐药肝癌细胞株HepG2/ADM,效靶比在100∶1时,显示出了强大的抗肝癌细胞增殖作用,此种抗瘤作用随时间延长而增强,并持续到96 h,具有时间依赖性。其可能的机制为DC表面有大量的树突状突起,使之有利于大量接触抗原,提呈给T细胞;高表达MHCⅠ、Ⅱ类分子及CD80/CD86等共刺激分子,为CIK细胞充分活化提供了有效的刺激,分泌出多种细胞因子,包括IL-12、IFN等,维持和增强CIK细胞的杀伤作用。进一步研究还发现,DC-CIK联合培养后能够显著降低mdr-1 mRNA水平的表达及其编码的P-gp蛋白水平的表达,而且这种抑制作用也呈现时间依赖性(P<0.05)。
DC除能刺激初始型T细胞活化增殖外,还能把抗原有效的呈递给T细胞,使T细胞对抗原蛋白酶致敏,从而杀死肿瘤细胞。将肿瘤细胞全部抗原信息(如提取的肿瘤细胞总RNA或经过灭活的完整的肿瘤细胞)冲击DC,可以有效地致敏和活化DC,促进其分化成熟,增强其功能,因此,将负载有抗原的DC-CIK共培养,可以提高CIK的抗瘤能力[10]。在本研究中,将肝癌HepG2/ADM细胞反复冻融制作的抗原负载于DC上,DC表面的共刺激分子(CD80、CD83和CD86)、MHCⅡ、CD3+CD8+和CD3+CD56+的表达均高于未负载抗原的DC,说明负载了抗原的DC,其成熟度更高,抗原呈递功能更强。进一步的研究发现,与未负载抗原的DC-CIK比较,负载抗原组的抗瘤作用明显强于未负载抗原组,且效靶比在10∶1和100∶1时差异有统计学意义,此种差异随着作用时间延长而渐显明显(P<0.05);且细胞内mdr-1 mRNA水平的表达以及其编码的P-gp蛋白水平的表达明显降低,也呈现时间依赖性(P<0.05)。
目前,负载有特异性的抗原DC瘤苗已运用于临床,此种瘤苗作为强有力的宿主免疫刺激物,具有超强的免疫应答激发功能,能特异性的杀死肿瘤细胞,提高治疗效果并无明显毒副作用[11]。在本研究中,采用HepG2/ADM冻融抗原负载的DC-CIK,产生了比未负载抗原的DC-CIK细胞更有效杀伤mdr-1和P-gp高表达的多药耐药肝癌细胞HepG2/ADM的效应,这为肝癌的综合治疗指出了新的方向。
[1]Wang D,Zhang B,Gao H,et al.Clinical research of genetically modified dendritic cells in combination with cytokine-induced killer cell treatment in advanced renal cancer[J].BMC Cancer,2014,14(11):1-7.
[2]Shi SB,Tang XY,Tian J,et al.Efficacy of erlotinib plus dendritic cells and cytokine-induced killer cells in maintenance therapy of advanced non-small cell lung cancer[J].J Immunother,2014,37(4):250-255.
[3]Qu HQ,Zhou XS,Zhou XL,et al.Effect of DC-CIK cell on the proliferation,apoptosis and differentiation of leukemia cells[J].Asian Pac J Trop Med,2014,7(8):659-662.
[4]Leitner I,Nemeth J,Feurstein T,et al.The third generation P-glycoprotein inhibitor tariquidar may over come bacterial multidrug resistance by increasing intracellular drug concentration[J].Antimicrob Agents Chemother,2011,66(4):834-839.
[5]Liu Z,Duan ZJ,Chang JY,et al.Sinomenine sensitizes multidrug-resistant colon cancer cells(Caco-2) to doxorubicin by downregulation of MDR-1 expression[J].PLoS One,2014,9(6):e98560.[6]Oliveira RFF,Santos RE,Oliveira AL,et al.Prognostic assessment of polymorphisms of the MDR-1 and GSTP1 genes in patients with stage Ⅱ and Ⅲ breast cancer submitted to neoadjuvant chemotherapy[J].Breast J,2012,18(2):185-187.
[7]Jin C,Li J,Wang J,et al.Impact of cellular immune function on prognosis of lung cancer patients after cytokine-induced killer cell therapy[J].Asian Pac J Cancer Prev,2014,15(15):6009-6014.
[8]Du X,Jin R,Ning N,et al.In vivo distribution and antitumor effect of infused immune cells in a gastric cancer model[J].Oncol Rep,2012,28(5):1743-1749.
[9]Pan K,Guan XX,Li YQ,et al.Clinical activity of adjuvant cytokine-induced killer cell immunotherapy in patients with post-mastectomy triple-negative breast cancer[J].Clin Cancer Res,2014,20(11):3003-3011.
[10]岳玲玲,张连生,柴晔,等.负载抗原的DC与CIK共培养对耐药乳腺癌细胞的杀伤作用[J].中国肿瘤生物治疗杂志,2012,19(4):437-441.
[11]Shah AH,Bregy A,Heros DO,et al.Dendritic cell vaccine for recurrent high-grade gliomas in pediatric and adult subjects:clinical trial protocol[J].Neurosurgery,2013,73(5):863-867.
Killing effects of co-culture of antigen-loaded DC and CIK cells on multidrug resistant liver cancer HepG2/ADM and its potential mechanism*
XUQiao-yuan1,YANGZhi-xiang2△,LUOKuo2
(1.DepartmentofOncology,ChongqingFifthPeople′sHospital,Chongqing400062,China;2.DepartmentofOncology,ChongqingZhongshanHospital,Chongqing400013,China)
Objective To observe the killing effects of the antigen-loaded dendritic cells(DC) and cytokine-induced killer cells(CIK) on multidrug resistance liver cancer line HepG2/ADM with highly expressed permeability glycoprotein(P-gp) and to explore its potential mechanisms.Methods DC cells and CIK cells were induced from the peripheral blood in healthy volunteers ′by the conventional methods,and DC cells were impacted with HepG2/ADM cells after frozen-thawed antigen,which were co-cultured with CIK cells for 24,48,72,96 h respectively.The DC cells without antigen-loading and CIK cells were co-cultured as control.The cell phenotype of DC and CIK was identified by the flow cytometry,the cell proliferation vitality of HepG2/ADM was detected by CCK-8;The expression of mdr-1 mRNA was determined by realtime-PCR,the P-gp protein level was detected by Western blot.Results Compared with non-antigen-loaded DC-CIK group,the expression of surface molecules in the antigen-loaded DC-CIK group was significantly increased(P<0.05),the vitality of HepG2 cells was inhibited more significantly(P<0.05).The RT-PCR and Western blot results showed that with the time extension,the expression of mdr-1 mRNA and P-gp protein both were significantly decreased in the above two groups respectively(P<0.05);Furthermore,the inhibitory effects was more significant in the antigen-loaded group(P<0.05).Conclusion The co-culture of DC and CIK after antigen impact could improve its killing activity to multidrug-resistant HepG2/ADM cell line,its potential mechanism may be via inhibiting the MDR closely related mdr-1 gene expression and its encoded P-gp protein level.
cytokine-induced killer cells; dendritic cells; multidrug-resistance; P-gp; HepG2/ADM cells
重庆市渝中区科技计划项目(20120225)。
徐巧元,女,副主任医师,硕士,主要从事肿瘤学方面的研究。△
,E-mail:yzhixiang122@tom.com。
10.3969/j.issn.1672-9455.2015.15.009
A
1672-9455(2015)15-2161-04
2015-02-28
2015-05-15)

