TRPC1是人气道上皮细胞感受压力的受体
何 叶,李 娜,黎 力,李敏超*
(重庆医科大学附属第二医院1.呼吸内科;2.胸心外科,重庆400010)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)和支气管哮喘等慢性气道炎性反应疾病患者由于气道重塑、支气管管腔内黏液增多和支气管平滑肌痉挛等多种因素,使小气道内存在持续异常增高的气道内压力。相关研究发现,压力刺激与气道上皮高分泌、气道重塑、气道炎性反应密切相关[1-3],可见,持续异常的气道高压贯穿于慢性阻塞性肺疾病始终,与疾病的病情进展密切相关,但关于气道感受压力刺激的受体机制尚不清楚。瞬时感受器电位(transient receptor potential,TRP)广泛分布在细胞膜及细胞器膜上,其中TRPC1 是细胞上的一种重要机械敏感离子通道(mechanosensitive cation channel,MscCa)[4-5],在压力负荷作用致心肌重构的病理变化过程中有重要的作用。通过免疫荧光及荧光定量聚合酶链反应(real-time quantitative reverse transcription polymerase chain reaction,qRT-PCR)技术,已发现人肺泡上皮细胞上亦有大量TRPC1 表达[6]。因此TRPC1 介导的信号通路可能是气道上皮细胞感受气道高压的重要机制。
1 材料与方法
1.1 主要试剂
兔抗人TRPC1 抗体(Abcam 公司);兔抗GAPDH单克隆抗体和山羊抗兔IgG 抗体、Fluo3-AM(碧云天生物技术研究所);PrimeScript RT reagent Kit 试剂盒、SYBR Premix EX TaqTM、DL2000 marker、Trizol 试剂盒、TRPC1 引物(TaKaRa Biotechnology 公司);正常人支气管上皮16HBE 细胞(ATCC 公司);1640 培养液、胎牛血清(Hyclone 公司);TRPC1 siRNA、NC siRNA(广州锐博公司),Lipofectamine RNAiMAX Reagent(Invitrogen 公司)。
1.2 组织标本
收集因肺癌于2014年3月至2014年9月在重庆医科大学附属第二医院胸外科行肺叶切除术患者肺组织,共20 例,取自距离肿块5 cm 以上肺癌旁组织,经HE 染色证实无癌性病变。所有患者均被告知研究项目内容并签字同意参与本研究,该研究亦取得伦理委员会批准。
组织标本根据患者术前临床表现,依据中华医学会呼吸病学会2013 诊断指南分为COPD 组、支气管哮喘组和对照组(无其他慢性气道炎性反应疾病)。COPD 组8 例,男5 例,女3 例,平均年龄(62.4 ±10.2)岁(54~69 岁);支气管哮喘5 例,男3 例,女2 例,平均年龄(59.2 ± 3.4)岁(56~62岁);对照组7 例,男4 例,女3 例,平均年龄(60.1 ±7.31)岁(50~69 岁)。各组间年龄、性别、吸烟者所占比例均无统计学差异。用于Western blot 及qRTPCR 检测的支气管组织用薄刀片在显微镜下快速切取支气管黏膜组织,置于液氮罐中保存备用。用于免疫组织化学检测的肺组织标本则用10%多聚甲醛固定,常温保存。
1.3 人气道上皮细胞TRPC1 表达水平检测
1.3.1 免疫组化SP 法检测TRPC1 表达水平:常规步骤制蜡块、切片、脱蜡水化。参照SP kit 试剂盒说明书进行免疫组化(兔抗TRPC1 多克隆抗体按1∶2稀释,阴性对照组则加入非免疫源性正常兔IgG)。用Imagepro-Plus 软件进行结果分析。选取整个支气管黏膜上皮作为测量区域,图像中黄色区域作为AOI 进行累积光密度(integrated optical,IA)测定分析。以IA/测量面积(area)值作为统计数据。每张切片均在高倍镜下(×400)选择5 个视野,其平均值即为该标本的支气管黏膜上皮内TRPC1 蛋白含量。
1.3.2 Western blot 方法检测支气管黏膜上皮中TRPC1 蛋白表达水平:用细胞裂解液提取支气管组织总蛋白。采用BCA 法测定总蛋白浓度,行12%SDS-PAGE 分离蛋白,印迹转移至PVDF 膜,5%脱脂奶粉封闭1 h,加兔抗TRPC1 多克隆抗体(1∶1 000)、兔抗GAPDH单克隆抗体(1∶5 000)4 ℃孵育过夜;洗膜后,辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000)于37 ℃孵育1 h。ECL 发光剂显影,扫描并存像。结果用Quantity One 分析软件行灰度分析,以与GAPDH 产物条带的比值作为蛋白的相对含量。
1.3.3 qRT-PCR 测定支气管黏膜上皮TRPC1 mRNA 表达水平:采用Trizol 法分别提取组织细胞内总RNA,按PrimeScript RT reagent Kit 试剂盒说明反转录合成cDNA。TRPC1 上游引物序列为5'-GCCAG TTTTGTCACTTTGTTATTT -3',下游引物序列为5'-C CCATTGTGTTTTTCTTATCCTCA-3';GAPDH 上游引物序列为5'-CGCTGAGTACGTCGTGGAGTC-3',下游引物序列为5'-GCTGATGATCTTGAGGCTGTTGTC-3'。PCR 反应体系:SYBR® Permix EX TaqTMⅡ(2 ×)12.5 μL、上下游引物各1 μL,cDNA 2 μL,ddH2O 8.5 μL。PCR 反应条件:94 ℃预变性2 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,共35 个循环,最后72 ℃延伸10 min。基于内部参照GAPDH 做定量分析,采用2-ΔΔCt值比较法进行组织TRPC1 mRNA 的相对定量。
1.4 细胞培养及处理
1.4.1 细胞培养:人气道上皮16HBE 细胞用1640 培养基(含10%胎牛血清、75 μg/mL 青霉素、125 μg/mL链霉素)常规培养,培养条件为37 ℃、5% CO2。
1.4.2 细胞的TRPC1 siRNA 转染:16HBE 细胞以2×105个/孔接种于6 孔板中,24 h 后换为无血清、无双抗1640 培养基。将100 pmol 的TRPC1 siRNA、100 pmol 的NC siRNA 和10 μL 的Lipofectamine RNAiMAX Reagent 分别加入100 μL 无血清、无双抗1640 培养液中,室温下孵育5 min 后,轻轻混匀,室温下孵育20 min,将混合物分别加入6 孔板中,6 h后更换为含10%胎牛血清的1640 培养基继续培养,48 h 后进行下一步处理。
1.4.3 细胞免疫荧光检测细胞转染效率:细胞以1 ×105个/孔接种于预先放有盖玻片的24 孔培养板中,常规培养24 h 后,按照1.4.2 的方法转染细胞。48 h 后去除培养基,磷酸盐缓冲液(PBS)清洗20 min,4%多聚甲醛固定30 min。PBS 再次冲洗20 min,以山羊血清封闭30 min 后,兔抗人TRPC1抗体(1∶100)4 ℃孵育过夜。PBS 清洗20 min,用异硫氰酸荧光素(FITC)标记的山羊抗兔二抗于37 ℃下孵育30 min,PBS 再次清洗20 min 后,4',6-二脒基-2-苯基吲哚(DAPI)孵育15 min。抗荧光淬灭封片剂封片后在荧光显微镜观察、成像,用Imagepro-Plus 软件进行分析,每张爬片选取4 个视野进行荧光强度测定后取其平均值。
1.4.4 细胞的牵张刺激:16HBE 细胞以4 ×105个/孔接种至胶原包被的硅胶弹性细胞双向牵拉力6 孔培养板,常规培养24 h 后,使用细胞牵张力加载装置给予细胞刺激。细胞所受压力大小由培养皿底部弹性膜牵拉应变率表示,选用30%牵拉应变率。将细胞分为对照组、单纯刺激组、刺激+TRPC1 siRNA 转染组。以正弦波牵张,频率为0.33 Hz。
1.4.5 激光共聚焦检测细胞内钙离子浓度:各组细胞刺激6 min 后,立即将培养板内细胞消化后制成细胞悬液,D'Hanks 液漂洗2 次,加入5 μmol/L 的Fluo 3-AM,37 ℃恒温箱中避光孵育30 min,D'Hanks液再次漂洗2 次。将细胞悬液转移入35 mm×12 mm聚苯乙烯培养皿,置激光共聚焦扫描显微镜下观察。用488 nm 氩离子激光器激发Fluo 3-AM 的荧光,发射波长为525~530 nm。用Imagepro-Plus 软件进行分析,每个视野随机选4 个细胞进行荧光强度测定后取其均值。
1.5 统计学分析
采用SPSS 软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间比较采用t 检验。
2 结果
2.1 TRPC1 蛋白在支气管上皮的表达差异
2.1.1 免疫组化分析TRPC1 蛋白在支气管上皮的表达差异:TRPC1 阳性染色主要分布于上皮细胞基底面,对照组无明显染色(图1)。COPD 组、支气管哮喘组IA/ area 值明显高于对照组(P<0.05)(表1)。
2.1.2 Western blot 分析TRPC1 蛋白在气道上皮的表达差异:COPD 组、支气管哮喘组TRPC1/GAPDH蛋白值显著高于对照组(P<0.05)(表1)。
2.1.3 qRT-PCR 分析TRPC1 mRNA 在COPD 组、支气管哮喘组和对照组的表达差异:TRPC1 及GAPDH基因的PCR 产物熔解曲线显示为单特异性峰,说明没有引物二聚体及非特异性扩增产物。COPD 组、支气管哮喘组支气管上皮内TRPC1/GAPDH mRNA显著高于对照组(P<0.05)(表1)。
2.2 支气管上皮细胞内TRPC1 受体对机械压力的敏感性
2.2.1 细胞免疫荧光检测细胞转染效率:经TRPC1 siRNA 转染的细胞其胞内TRPC1 含量明显降低,而NC siRNA 转染组的胞内TRPC1 表达水平无明显差异(图2A~C)。TRPC1 siRNA 转染组平均荧光强度显著低于对照组(P<0.05),NC siRNA 转染组表达水平与对照组相比无明显差异(图2D)。
2.2.2 牵张刺激对细胞内钙离子浓度的影响:细胞牵张刺激6 min 后,胞内钙离子荧光强度显著高于对照组(P<0.05);而刺激+TRPC1 siRNA 转染组钙离子荧光强度与对照相比无明显差异(图3)。

图1 COPD 组、支气管哮喘组与对照组气道上皮TRPC1 蛋白的表达Fig 1 The expression of TRPC1 protein in bronchial epithelium from COPD,asthma and control group
表1 COPD 组、支气管哮喘组与对照组气道上皮TRPC1 表达差异Table 1 TRPC1 expression in human bronchial epithelium of subjects from COPD,asthma and control group(±s)
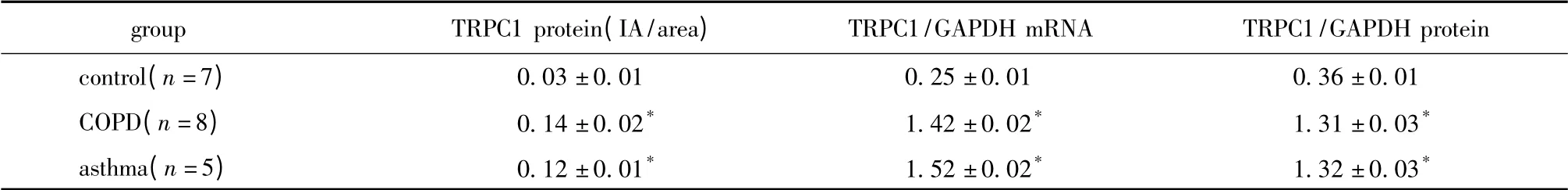
表1 COPD 组、支气管哮喘组与对照组气道上皮TRPC1 表达差异Table 1 TRPC1 expression in human bronchial epithelium of subjects from COPD,asthma and control group(±s)
*P<0.05 compared with control group.
groupTRPC1 protein(IA/area)TRPC1/GAPDH mRNATRPC1/GAPDH protein control(n=7)0.03 ±0.010.25 ±0.010.36 ±0.01 COPD(n=8)0.14 ±0.02*1.42 ±0.02*1.31 ±0.03*asthma(n=5)0.12 ±0.01*1.52 ±0.02*1.32 ±0.03*

图2 荧光显微镜观察TRPC1 siRNA 对TRPC1 基因的沉默效率Fig 2 The extent of knockdown in TRPC1 expression after TRPC1 siRNA transfection by fluorescence microscope
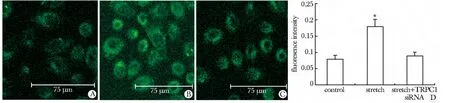
图3 激光共聚焦观察机械牵张刺激6 min 后细胞内钙离子荧光强度Fig 3 Ca2+ fluorescence intensity after mechanical stretching for 6 min by laser confocal microscopy
3 讨论
慢性气道炎性反应疾病气道重塑的主要病理改变包括上皮下胶原沉积、上皮杯状细胞化生、气道平滑肌细胞的增殖和硬度的增加等[7],造成不可逆的气流受限,从而形成持续气道高压。相关研究发现,气道高压可促使气道上皮细胞分泌黏蛋白5AC[1];压力刺激可促进气道上皮细胞间质转化(epithelialmesenchymal transition,EMT),而EMT 是气道纤维化的重要标志[2];压力刺激下气道上皮细胞分泌大量转化生长因子-beta 1(transforming growth factorbeta 1,TGF-beta 1)、白细胞介素-2(interleukin-2,IL-2)等炎性因子[3]。
TRP 通道蛋白是细胞膜上的重要受体蛋白,参与机体的多种生理应答过程[8],其亚家族TRPC 包括7 种亚型(TRPC1-TRPC7),可以被多种炎性因子和膜牵张刺激等激活[9]。在脊柱动物卵泡细胞中发现TRPC1 是机械敏感离子通道MscCa 的重要成员[4],而在心肌细胞[5]、血管内皮细胞[10]上已证实TRPC1 是一种压力敏感离子通道。在肺泡上皮细胞上,通过免疫荧光及PCR 技术曾发现大量TRPC1表达[6]。本实验证实了气道上皮细胞内有大量TRPC1蛋白表达,且慢性气道炎性反应疾病患者较正常人明显增多。
本实验通过基因沉默技术明显降低16HBE 细胞内TRPC1 蛋白的表达水平。在压力刺激作用下,单纯刺激组细胞内Ca2+浓度显著高于对照组,而TRPC1 siRNA 转染组无明显变化。可见,TRPC1 是气道感受压力的重要受体,且在慢性气道炎性反应疾病患者上皮细胞内表达量明显增加,可能为该类患者气道高反应的机制之一。既往研究发现TRPM8为气道感受冷刺激的重要受体[11],与冷刺激致气道黏液分泌、炎性因子释放密切相关。而TRPC1 与TRPM8 激活后均引起细胞内Ca2+浓度升高,Ca2+激活磷脂酶C(phospholipase,PLC)而使磷酯酰肌醇4,5-二磷酸(phosphatidylinositol 4,5-bisphosphate,PIP2)分解为第二信使三磷酸肌醇(inositol trisphosphate,IP3)和二酰甘油(diacylglycerol,DAG)[11-12],通过以上级联反应而将物理刺激转化为化学信号。因此,针对该信号通路的靶向治疗为慢性气道炎性反应疾病的治疗提供新思路。
[1]吴砚樵,周向东.慢性机械压力诱导气道上皮黏蛋白5AC 的表达[J].第三军医大学学报,2010,32:1594-1597.
[2]Cabrera-Benítez NE,Parotto M,Post M,et al.Mechanical stress induces lung fibrosis by epithelial-mesenchymal transition[J].Crit Care Med,2012,40:510-517.
[3]Reis FG,Marques RH,Starling CM,et al.Stress amplifies lung tissue mechanics,inflammation and oxidative stress induced by chronic inflammation[J].Exp Lung Res,2012,38:344-354.
[4]Maroto B,Raso A,Wood TG,et al.TRPC1 forms the stretch-activated cation channel in vertebrate cells[J].Nat Cell Biol,2005,7:179-185.
[5]Shenton FC,Pyner S.Expression of transient receptor potential channels TRPC1 and TRPV4 in venoatrial endocardium of the rat heart[J].Neuroscience,2014,267:195-204.
[6]Jiang HN,Zeng B,Zhang Y,et al.Involvement of TRPC channels in lung cancer cell differentiation and the correlation analysis in human non-small cell lung cancer[J].PLoS One,2013,8: doi: 10.1371/journal.pone.0067637.
[7]Manuyakorn W.Airway remodelling in asthma:role for mechanical Forces[J].Asia Pac Allergy,2014,4:19-24.
[8]Grace MS,Baxter M,Dubuis E,et al.Transient receptor potential (TRP)channels in the airway:role in airway disease[J].Br J Pharmacol,2014,171:2593-2607.
[9]Zheng J.Molecular mechanism of TRP channels[J].Compr Physiol,2013,3:221-242.
[10]Berrout J,Jin M,O'Neil RG.Critical role of TRPP2 and TRPC1 channels in stretch-induced injury of blood-brain barrier endothelial cells[J].Brain Res,2012,1436:1-12.
[11]Li MI,Li Q,Zhou XD,et al.Cold temperature induces mucin hypersecretion from normal human bronchial epithelial cells in vitro through a transient receptor potential melastatin 8 (TRPM8)-mediated mechanism[J].J Allergy Clin Immunol,2011,128:626-634.
[12]Seth M,Zhang ZS,Mao L,et al.TRPC1 channels are critical for hypertrophic signaling in the heart[J].Circ Res,2009,105:1023-1030.

