湖羊肌肉UCP3基因序列特征分析及其在肌肉中的表达
李隐侠, 乔 永, 张 俊, 钱 勇, 孟春花, 王慧利, 钟 声,曹少先, 李齐发
解偶联蛋白质(Uncoupling protein,UCPs)是一类位于线粒体内膜的质子转运蛋白质,参与机体的能量代谢。目前,在哺乳动物中已发现的解偶联蛋白质基因家族成员包括 UCP1、UCP2、UCP3、UCP4和UCP5,其中UCP3基因在啮齿类动物和人类的骨骼肌、白色脂肪组织、棕色脂肪组织及心肌中均有表达,尤其是在骨骼肌中高效、专一表达,是骨骼肌线粒体内膜的重要转运蛋白质[1-2],可能参与脂肪代谢的调节[3]。UCP3蛋白质能够提供非颤抖的生热作用,是体内产热的重要调节因子,被认为是参与骨骼肌能量代谢的重要靶蛋白质物质,并显著影响机体能量平衡涉及的体质量(肥胖)、静止代谢率和体脂代谢等[4]。Liu 等[5]在肥胖人群中发现,UCP3 基因多态对体质量指数有显著影响,表明UCP3多态使肥胖者体质量有增加的危险。Rudofsky等[6]研究认为,人UCP3基因调节能量平衡,与肥胖和糖尿病有关。有研究结果表明UCP3基因可能是影响猪胴体和肉质性状的主效基因或是与主效基因连锁的基因标记[7]。陈哲等[8]研究发现UCP3基因第四内含子Bcc I多态位点与长白猪6~7背膘厚极显著相关。陈翠等[9]研究发现西门塔尔牛UCP3基因的Bgl I酶切位点表现多态性,而且此位点与平均日增质量、胴体长、胴体胸深、后腿宽和背膘厚性状显著相关。金成吉等[10]研究发现,UCP3基因表达减少与2型糖尿病模型OLETF鼠早期肥胖有关。本研究以早期生长发育较快的湖羊为研究对象,克隆测序获得湖羊UCP3基因编码区序列,并对序列特征进行分析,解析UCP3基因在湖羊不同部位肌肉中的表达变化,为绵羊的育种工作提供参考。
1 材料与方法
1.1 试验动物
试验动物为健康纯种湖羊,选自江苏省苏州市东山湖羊资源保种区,初生、1、2、3、4、5 和 6 月龄的各5只,共35只羊,试验动物由东山湖羊资源保种区统一饲料管理,营养以及管理水平保持一致。屠宰后记录屠宰数据,采取背最长肌(第12肋骨后)、腰大肌(8~12肋骨处)、前腿肱二头肌和后腿股二头肌样品,迅速置于液氮中保存,带回后置于-70℃冰箱保存备用。
1.2 RNA提取及反转录
用Trizol法提取各肌肉RNA,紫外分光光度计测定总RNA浓度和纯度(OD260/OD280=1.8~2.0)。
用随机引物对总RNA进行反转录,反应体系为25μl:2μg总 RNA,1μg随机引物,0.4 mmol/L dNTP,20 U RNAse抑制剂,200 U MMLV反转录酶,5μl 5×RT buffer(250.0 mmol/L Tris-HCl pH 8.3,50.0 mmol/L MgCl2,250.0 mmol/L KCl,50.0 mmol/L DTT,2.5 mmol/L亚精胺)。先加 RNA模板、dNTP和随机引物,70℃变性5 min后立即放冰上冷却,再加其余试剂,混匀后于41℃下放置40 min。RT产物保存于-20℃备用。
1.3 引物设计与PCR反应
从GenBank中检索绵羊UCP3(GenBank序列号:KF015729)和GAPDH[看家基因3-磷酸甘油醛脱氢酶基因(GenBank序列号:AF030943)]mRNA序列,用Primer premier 5.0软件设计引物(表1),由上海捷瑞生物技术有限公司合成。
反应体系为20μl:1μl RT产物,1U Taq DNA聚合酶,2μl 10×PCR buffer(100 mmol/L Tris-HCl pH 8.3,500 mmol/L KCl),0.5 mmol/L dNTP,1.4 mmol/L MgCl2,上、下游引物各 0.5 μmol/L。反应程序为:94℃预变性5 min;94℃ 30 s,59℃ 30 s,72℃ 30 s,共35个循环;最后再72℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳分离,EB染色后用凝胶成像系统照相。
1.4 PCR产物回收及克隆测序
PCR产物用1%琼脂糖凝胶电泳分离,紫外灯下割取目的片断,用Karroten DNA凝胶回收试剂盒纯化。将回收纯化的目的片段与PCR 2.1载体充分混匀,在恒温金属浴中16℃连接过夜,将全部连接液转化到感受态细胞,涂于含氨苄抗性的LB板37℃过夜培养。挑取单克隆菌提取质粒,PCR鉴定 为阳性克隆送美吉生物公司测序。

表1 UCP3基因的引物参数Table 1 Parameters of oligo-nucleotide primer pairs of UCP3 and GAPDH
1.5 序列分析与系统发育树的构建
用DNAMAN6.0软件进行序列翻译和与其他动物的核苷酸和氨基酸序列进行比对。开放阅读框的预测在 NCBI的 ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/)中进行,利用 NCBI BLAST服务器从GenBank中挑选8个来源于不同动物的UCP3所编码的氨基酸序列,利用 DNAStar软件进行多序列比对分析和编辑校正,采用 MEGA5.1软件包[11]中的邻接法(Neighbor-joining,NJ)构建系统发育树,自举分析(Bootstrap test)采用1 000次重复抽样检验获得置信度(BP)。
1.6 Real-time PCR
Real-time PCR反应体系为20μl:1μl RT产物,1 U Ex Taq HSDNA 聚合酶,4 μl 5 ×PCR buffer,0.30 mmol/L dNTP,3.75 mmol/L MgCl2,上游和下游引物各0.50μmol/L,1μl 20×SYBR greenⅠ。反应程序为:95℃预变性1 min;95℃ 10 s,退火10 s,72℃ 15 s,45个循环;然后再72℃延伸5 min。融解曲线分析:65~94℃,每隔0.2℃读板1次(温度恒定1 s后读板);最后72℃延伸5 min。每个样品2个重复,取平均值进行计算。
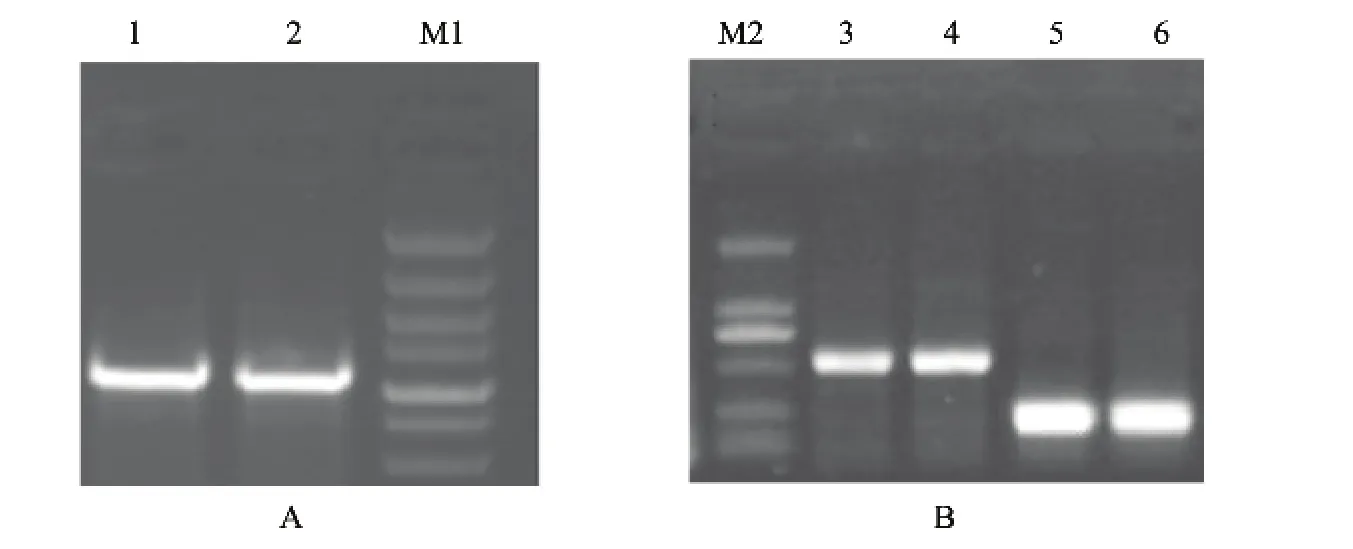
图1 绵羊肌肉UCP3基因克隆扩增电泳图和GAPDH、UCP3基因的RT-PCR电泳图Fig.1 The amplification profile of UCP3 gene and RT-PCR of GAPDH and UCP3 mRNA in sheep muscle
1.7 数据分析
用SPSS11.5 For Windows软件进行分析,其中同一肌肉部位不同月龄间的基因表达差异用Oneway ANOVA进行分析。
2 结果与分析
2.1 绵羊UCP3基因和GAPDH基因扩增结果
以湖羊肌肉总RNA为模板,用所设计的UCP3基因引物P1、P2和P3进行基因扩增,PCR产物琼脂糖电泳图见图1。由图1可以看出,UCP3基因编码区序列片段和GAPDH基因片段在湖羊肌肉组织中均有很好的扩增。
2.2 绵羊UCP3基因编码区序列分析
UCP3基因扩增片断克隆于 PCR2.1载体,PCR鉴定后测序,用 DNAstar对测序结果与引物设计源序列进行同源性比较,得到UCP3基因编码区全序列。ORF Finder在线软件预测发现测定的序列含有湖羊UCP3基因完整的开放阅读框,长度为936 bp,编码311个氨基酸残基(图2)。通过NCBI查找其他哺乳动物的UCP3的编码区序列,DNAMAN比对发现湖羊与牛和人的核苷酸序列同源性分别为97.25%、88.61%,氨基酸序列同源性分别为95.63%和87.54%,表明UCP3基因在物种间具有一定的保守性。

图2 不同哺乳动物UCP3基因所编码的氨基酸序列同源性比较Fig.2 Alignment of amino acid sequences of UCP3 gene from different mammals
2.3 哺乳动物UCP3进化与系统发育树分析

图3 9个物种UCP3蛋白质氨基酸序列NJ系统发育树Fig.3 Phylogenetic tree based on nucleotide sequences of UCP3 coding region from nine species by NJ method
以鱼类(斑马鱼)为外类群,采用 MEGA 5.1软件中的NJ法构建哺乳动物UCP3蛋白质的系统发育树,结果(图3)显示聚类结果与经典分类学结果基本一致。湖羊与8个哺乳动物聚在一起,而外类群鱼类自成一类;在哺乳动物中,鼠科自成一类,3种家畜品种和3个灵长类物种聚在一起;在3种家畜中,湖羊首先和牛聚为一类,然后再与猪聚为一类;而灵长类中的人类、黑猩猩首先聚在一起,然后再和猕猴聚为一类。
2.4 湖羊羔羊不同部位肌肉UCP3基因表达的变化
用 Real-time PCR 法对湖羊羔羊初生、1、2、3、4、5和6月龄时背最长肌、腰大肌、前腿肱二头肌和后腿股二头肌4个部位肌肉的UCP3基因mRNA表达量进行分析,结果(图4)显示,UCP3基因mRNA在湖羊羔羊肌肉不同部位中的发育变化模式基本相似,即在出生时有较低的水平,然后略有上升,随着月龄的增加又下降。在背最长肌中,1月龄时达到最高,4月龄时下降到最低;在腰大肌中,刚出生时UCP3基因表达水平最低,3月龄时最高,然后下降;在前腿肱二头肌中,UCP3基因表达水平2月龄时最高,3月龄时最低;在后腿股二头肌中,UCP3基因表达水平出生时最低,2月龄时最高。另外,初生至6月龄间UCP3基因在后腿股二头肌中的整体表达量偏低,在腰大肌中的表达水平变化较大,3月龄时UCP3基因表达水平显著高于初生和5月龄。

图4 湖羊羔羊不同肌肉不同月龄UCP3基因表达的变化Fig.4 Changes of UCP3 mRNA expression levels in different muscles of differently-aged Hu lamb
3 讨论
UCP3作为肌肉组织线粒体内膜的重要转运蛋白质,对维持肌肉的能量代谢与平衡具有重要的作用[12]。UCP3与肌肉组织中脂肪酸的氧化代谢紧密相关,研究结果表明UCP3在肌肉中表达量的增加能明显增加肌肉中脂肪酸的氧化,Son等通过转基因的方法使小鼠肌肉高表达UCP3,发现UCP3表达水平高于正常表达水平18倍的小鼠能明显减少因饮食增加引起的肥胖,认为UCP3可能是未来治疗肥胖疾病的1个有用工具 。Nakayama等研究结果表明UCP3基因55C/T位点多态性影响日本成年人的肥胖[14]。Udaqawa等研究结果表明UCP3基因与家犬体内总胆固醇水平相关[15]。人的UCP3基因位于11q13,包含6个外显子和5个内含子[16];猪的UCP3基因定位在9P21~P24,开放阅读框为936 bp,编码311个氨基酸残基[17]。本研究获得了湖羊UCP3基因编码区序列,湖羊中UCP3基因编码区长度为936 bp,编码311个氨基酸残基,其起始密码子为ATG,终止密码子为TGA,在哺乳动物间是相对保守的[16]。Esterbauer等[18]研究发现人UCP3基因存在长型和短型2种剪接体,而鼠类中只有长型UCP3基因剪接体,没有检测到短型的UCP3,本研究在湖羊中也只发现1种剪接方式。根据UCP3蛋白质序列构建的哺乳动物系统发育树结果显示,聚类结果与经典的分类结果基本一致,即湖羊与8个哺乳动物聚在一起,而外类群鱼类自成一类;在哺乳动物中,鼠科自成一类,3种家畜和3个灵长类物种聚在一起;在3种家畜中,湖羊首先和牛聚为一类,然后再与猪聚为一类,此分类结果与李隐侠等[19]研究结果一致。
UCP3基因在肌肉中的表达受多种因素的影响,品种、营养水平和环境温度等都会影响其表达。Mostyn 等[20]研究了出生后0、4、7、14 和21 日龄时商品猪和梅山猪UCP3基因表达模式,发现在脂肪组织中,7日龄以前2个品种猪UCP3的表达量相似,7日龄以后梅山猪显著高于商品猪,表明UCP3基因表达具有品种特异性。本研究发现,湖羊羔羊肌肉UCP3的表达模式在不同部位具有较明显的差异,在背最长肌中,出生时UCP3表达量较高,然后缓慢上升后下降,到4月龄时最低,然后又有所回升;在腰大肌和后腿股二头肌中,刚出生的羔羊UCP3表达量较低,随月龄的增加上升,腰大肌在3月龄时升到最高,股二头肌在5月龄时升到最高;在前腿肱二头肌中,出生时较高,1月龄时下降,到2月龄时升到最高,3月龄时又降到最低,4月龄时又上升,表现出波动变化的特征,表明UCP3基因在湖羊肌肉中表达的变化呈明显的组织特异性,与前人的研究结果一致[20-21]。UCP3基因在腰大肌中3月龄时的基因表达水平显著高于0月龄和5月龄,表明UCP3基因可能参与脂肪代谢的调节[3]。
以上研究结果表明,湖羊UCP3基因编码区长度为936 bp,编码311个氨基酸残基,在哺乳动物间相对保守;根据UCP3蛋白质序列构建的哺乳动物进化树结果与经典的拓扑结构一致;UCP3基因在湖羊肌肉中的mRNA的表达变化具有明显的组织特异性。
[1] BOSS,SAMEC S,PAOLONI-GIACOBINO A,et al.Uncoupling protein-3:a new member of the mitochondrial carrier family with tissue-specific expression[J].FEBSLetters,1997,408:39-42.
[2] GONG DW,HE Y,KARASM,et al.Uncoupling protein-3 is a mediator of thermogenesis regulated by thyroid hormone,β3-adrenergic agonist,and leptin[J].The Journal of Biological Chemistry,1997,272:24129-24132.
[3] HIMMS-HAGEN J,HARPER M E.Physiological role of UCP3 may be export of fatty acids from mitochondria when fatty acid oxidation prodomintaes:an hypothesis[J].Experimental Biology and Medicine,2001,226:78-84.
[4] 李 波,李 华,李学伟,等.猪解偶联蛋白3(UCP3)基因的研究进展[J].黑龙江畜牧兽医,2006(8):28-30.
[5] LIU Y J,LIU P Y,LONG J.Linkage and association analyses of the UCP3 gene with obesity phenotypes in Caucasian families[J].Physiol Genomics,2005,22(2):197-203.
[6] RUDOFSKY G J,SCHROEDTER A,SCHLOTTERER A,et al.Functional polymorphisms of UCP2 and UCP3 are associated with a reduced prevalence of diabetic neuropathy in patients with type I diabetes[J].Diabetes Care,2006,29(1):89-94.
[7] 涂荣剑,邓昌彦,熊远著.猪UCP3基因部分编码区域序列分析及单核苷酸多态与胴体、肉质性状的遗传效应[J].遗传学报,2004,31(8):807-812.
[8] 陈 哲,于峰祥,于建宁,等.猪UCP3基因第4内含子Bcc I多态性检测及其与胴体和肉质性状的关联分析[J].江苏农业学报,2012,28(6):1338-1343.
[9] 陈 翠,张立敏,陈晓杰,等.UCP3基因遗传多态性与中国西门塔尔牛生长及育肥性状的遗传效应分析[J].中国农学通报,2012,28(5):13-18.
[10]金成吉,王晓梅,李 湘,等.UCP1蛋白和UCP3基因表达减少与OLETF鼠早期肥胖有关[J].基础医学与临床,2011,3(31):286-290.
[11] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionarydistance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[12]李秋玲,许尚忠,昝林森,等.3个牛品种UCP3基因第5内含子和第6外显子部分序列的多态性研究[J].西北农林科技大学学报,2006,11(34):11-14.
[13] SON C,HOSODA K,ISHIHARA K,et al.Reduction of diet-induced obesity in transgenic mice overexpressing uncoupling protein 3 in skeletal muscle[J].Diabetologia,2004,47:47-54.
[14] NAKAYAMA K,MIYASHITA H,IWAMOTO S.Seasonal effects of the UCP3 and the RPTOR gene polymorphisms on obesity traits in Japanese adults[J].JPhysiol Anthropol,2014,33(1):38.
[15] UDAGAWA C,TADA N,ASANO J,et al.The genetic association study between polymorphisms in uncoupling protein 2 and uncoupling protein 3 and metabolic data in dogs[J].BMC Res Notes,2014,7:904.
[16] SOLANESG,VIDAL-PUIGA,GRUIICD,et al.The human uncoupling protein-3 gene,genomic structure,chromosomal localization,and genetic basis for short and long form transcripts[J].J Biol Chem,1997,272(41):25433-25436.
[17] CEPICA S,YERLE M,STRATIL A,et al.Regional localization of porcine MYOD1,MYF5,LEP,UCP3 and LCN1 genes[J].Anim Genet,1999,30(6):476-478.
[18] ESTERBAUER H,OBERKOFLER H,KREMPLER F,et al.The uncoupling protein-3 gene is transcibed from tissue-specific promoters in humans but not in rodents[J].J Biol Chem,2000,275:36394-36399.
[19]李隐侠,张 俊,李静心,等.乌骨绵羊NR5A2基因编码区序列克隆及特征分析[J].江苏农业学报,2014,30(6):1375-1382.
[20] MOSTYN A,LITTEN JC,PERKINSK S,et al.Influence of size at birth on the endocrine profiles and expression of uncoupling proteins in subcutaneous adipose tissue,lung,and muscle of neonatal pigs[J].Am J Physiol Regul Integr Comp Physiol,2005,288(6):1536-1542.
[21] MOSTYN A,LITTEN J C,PERKINS K S,et al.Influence of genotype on the differential ontogeny of uncoupling protein 2 and 3 in subcutaneous adipose tissue and muscle in neonatal pigs[J].J Endorinol,2004,183:121-131.

