Streptomyces eurocidicus JXJ 0089对铜绿微囊藻的抑制
李汉全, 张炳火, 杨建远, 查代明, 过七根, 石 翔, 郭 静
(九江学院药学与生命科学学院,江西 九江 332000)
蓝藻水华是世界性的水污染问题,暴发时产生大量蓝藻毒素,造成严重的环境问题[1-4],威胁人类健康 ,给水产养殖业带来巨大的经济损失 。随着全球气候变暖、富营养化加剧,蓝藻水华发生频率日益增加,水华水体藻毒素浓度也越来越高[8]。虽然目前有物理、化学和生物操纵等多种水华防治方法,但这些方法具有诸多缺点,如成本高、容易造成二次污染,选择毒性差或者只能适应小面积水域[9-13]。因此,迫切需要寻找新型、高效、环保的蓝藻水华防治方法。
研究结果表明,环境中存在大量的抑藻放线菌,这些放线菌可分泌许多抑藻活性成分,杀死藻细胞,诸如赖氨酸[14]、链霉素[15,16]、niromycin A[17]、anthracidin A[18]、万古霉素、D-环丝氨酸、新生霉素[19]、七 尾 霉 素 A 甲 酯[20]和 2-hydroxy-12-oleanene-3,28-O-D-glucopyranosyl[21]等,其中部分化合物对水华蓝藻选择毒性好,如赖氨酸对微囊藻具有抑藻活性,但是对硅藻和绿藻却没有毒性[22]。因此,抑藻放线菌及其代谢产物在水华蓝藻防治中具有重要的潜在应用价值。
铜绿微囊藻(Microcystis aeruginosa)是引起水华的最常见藻种[23-24],是微囊藻毒素的主要产生者[25],也是中国蓝藻水华的主要藻种。本研究以铜绿微囊藻FACHB-905为指示藻,筛选抑藻放线菌,并初步研究其对铜绿微囊藻的抑藻活性及其部分影响因素。
1 材料与方法
1.1 指示藻
铜绿微囊藻(M.aeruginosa FACHB-905),购自中国科学院水生生物研究所淡水藻种库,并利用平板划线法进行纯化,获得无菌藻株。藻种在25℃、30~50μmol/(m2·s)、光暗比为12 h∶12 h的条件下静置培养,每天摇动4次,每次30 s左右,藻培养基为HGZ培养基。藻平板制作参照文献[26]进行。
HGZ液体培养基:NaNO3496.0 mg,KH2PO439.0 mg,MgSO4·7H2O 75.0 mg,CaCl2·2H2O 36.0 mg,Na2SiO3·9H2O 58.0 mg,土壤提取液 3.0 ml,金属盐溶液3.0 ml(Na2-EDTA 75.0 mg,FeCl3·6H2O 9.7 mg,MnCl2· 4H2O 4.1 mg,ZnCl20.5 mg,CoCl2·6H2O 0.2 mg,Na2MoO4·2H2O 0.4 mg,蒸馏水100.0 ml),蒸馏水 994.0 ml,pH 8.0 ~8.5。
1.2 抑藻放线菌的筛选及形态鉴定和16SrRNA系统发育分析
采用点接法,将土壤中分离的放线菌接种于YIM 38固体平板培养基 ,28℃下培养4~7 d后,用无菌打孔器将长有菌落的琼脂块取出并置于藻平板上,按照方法1.1的条件培养,3 d后观察抑藻圈的产生情况,并根据抑藻圈的有无判断菌株是否产生抑藻活性物质。
参照文献[27]对菌株的形态进行鉴定以及对16SrRNA基因序列进行系统发育分析。采用埋片法制备放线菌菌丝样本,利用扫描电镜观察菌丝形态。采用溶菌酶法提取基因组DNA,用细菌通用引物primer A(5'-AGAGTTTGATCCTGGCTCAG-3')和primer B(5'-TACGGCTACCTTGTTACGACTT-3')进行PCR扩增,检测序列,并将其16SrRNA基因序列在GenBank核酸序列数据库中进行序列同源性比较,通过CLUSTALX和MEGA软件进行序列比对分析,并以Neighbor-Joining法构建系统发育树。
1.3 菌株JXJ 0089液体培养时间
将生长良好的斜面菌种接入YIM 38#液体培养基,培养48 h后,按照10%(体积比)的接种量接入无菌液体培养基(组成:葡萄糖15.0 g,大豆粉15.0 g,酵母浸粉2.0 g,淀粉 10.0 g,蛋白胨 2.0 g,麦芽浸粉 2.0 g,NaCl 4.0 g,K2HPO40.4 g,MgSO4·7 H2O 0.5 g,Ca-CO32.0 g,H2O 1 000 ml,pH7.8),于 180 r/min、28℃摇床培养,每24 h取样1次,连续取样13次,培养液在4 500 r/min的条件下离心10 min,上清液置于无菌容器中,于4℃冰箱保藏备用。取2%(体积比)的上清液加入铜绿微囊藻藻液(5×106CFU/ml)中,采用方法1.1的培养条件进行培养,3 d后采用热乙醇法测藻液的叶绿素 a(Chl.a)含量[28],并根据抑藻效率(%)=(1-Ct/Cc)×100%(Cc和Ct分别为对照组和试验组Chl.a的浓度)计算抑藻效率,根据各样品抑藻效率确定发酵时间。
1.4 上清液抑藻活性组分分析
将放线菌培养液的上清液进行真空冷冻干燥,干燥物分别用乙酸乙酯、甲醇和去离子水溶解,减压蒸馏除去各样品溶液的溶剂后称质量,再将各样品配制为2μg/μl的溶液,用移液器取20μl溶液于无菌滤纸片(直径为0.6 cm)上,置于无菌培养皿中,待溶剂完全挥发后将滤纸片再置于藻平板上,按照方法1.1中的方法培养1~3 d后,用游标卡尺测量抑藻圈直径,根据抑藻圈直径判断样品抑藻活性强弱,并利用薄层层析(TLC)硅胶板进行分析,利用Anis显色剂[29]和茚三酮显色剂显色。
1.5 菌株JXJ 0089的孢子、菌丝体和藻液之间的相互影响
1.5.1 菌株JXJ 0089孢子与铜绿微囊和藻之间的相互影响 取纯化的无菌藻和未纯化的有菌藻各100 ml(5×106CFU/ml),分别加入2 ml放线菌孢子悬液(1.0×107CFU/ml),8 d后检测抑藻效率。并用显微镜观察藻液中是否存在放线菌菌丝体,并取0.1 ml藻液涂布于YIM 38#固体平板上,28℃下培养,连续观察7 d,记录放线菌和细菌的生长情况。对照组试验藻液加入2 ml无菌水。
1.5.2 菌株JXJ 0089菌丝体与铜绿微囊藻之间的相互影响 分别取 0 g、0.15 g、0.30 g、0.45 g和0.60 g菌丝体(湿质量),加入 100 ml(5×106CFU/ml)无菌藻和有菌藻中,8 d后测抑藻效率。用显微镜观察藻液中放线菌的菌丝形态,并取0.1 ml藻液涂布于YIM 38#固体平板上,于28℃下培养,连续观察7 d,记录放线菌和细菌生长情况。
1.6 藻液中抑制放线菌JXJ 0089的细菌
采用平板划线法,对藻液中的细菌进行分离纯化,在获得纯培养细菌后,再将其点接于涂布有放线菌JXJ 0089孢子的平板培养基上,培养3 d后观察细菌菌落周围是否出现抑菌圈。提取有拮抗活性的细菌的基因组,对其16S rRNA基因序列进行系统发育分析。
2 结果与分析
2.1 抑藻放线菌的筛选及形态鉴定和16SrRNA系统发育分析
试验结果显示,对照组YIM 38#培养基在藻平板上未产生明显抑藻圈,而用于筛选的160株放线菌中,35株能够在藻平板上形成明显的抑藻圈,其中放线菌JXJ 0089形成的抑藻圈较透明,这说明该菌产生的代谢产物抑藻活性较强,或者活性成分的含量较高,因此选为后续研究菌株。
放线菌JXJ 0089在固体平板上生长初期气丝相对较少,但随着培养时间的延长,气丝变得极为发达,灰白色,基丝灰褐色,产生水溶性黄褐色色素,孢子丝与 S.eurocidicus[30]类似,为典型链状轮生,孢子椭圆形,表面光滑(图1)。16S rRNA基因序列(1 529 bp;GenBank登录号:KP193140)分析结果表明,放线菌JXJ 0089属于链霉菌属(Streptomyces)的成员,与S.eurocidicus NRRL B-1676T亲缘关系最近(99.73%),采用邻接法构建系统进化树,该菌和S.eurocidicus NRRL B-1676T聚在单独的一支上(图2)。结合形态特征,将放线菌 JXJ 0089鉴定为Streptomyces eurocidicus JXJ 0089。
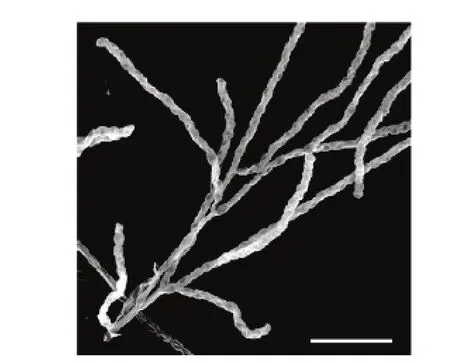
图1 菌株JXJ 0089在YIM 38#培养基上28℃培养14 d后孢子丝的扫描电镜照片Fig.1 Scanning electron micrograph of spore chains of S.eurocidicus JXJ 0089 after growth on YIM 38#medium at 28℃for 14 d
2.2 菌株JXJ 0089培养时间
由图3可知,菌株JXJ 0089在28℃、180 r/min的条件下培养11 d后,其上清液抑藻效率为88.02% ±1.63%,此后变化不明显,因此确定发酵时间为12 d。
2.3 上清液抑藻活性组分分析
抑藻活性组分分析结果显示,乙酸乙酯溶解的组分抑藻活性较弱,抑藻圈直径为8.92 mm,甲醇溶解的组分抑藻活性较强,抑藻圈直径为13.65 mm,去离子水溶解的组分,抑藻活性最强,抑藻圈直径为16.73 mm,这说明该菌产生多种抑藻活性物质。TLC检测和显色剂显示结果表明,乙酸乙酯和甲醇溶解部分的代谢产物化学多样性丰富,而水溶性成分茚三酮显色明显,主要为含氨基的化合物。
2.4 放线菌的孢子、菌丝体与铜绿微囊藻之间的相互影响
2.4.1 孢子与铜绿微囊藻之间的相互影响 抑藻活性分析结果显示,放线菌JXJ 0089的孢子对无细菌藻的抑藻效率为2.17% ±4.06%,对有细菌藻的抑藻效率为6.53% ±3.88%,两种情况下的抑藻效率没有显著差异(P>0.05),与对照组相比,其Chl.a含量也均无显著差异(P>0.05)。显微镜观察结果显示,在无细菌藻液和有细菌藻液中,孢子均未萌发。涂布培养结果显示,加入放线菌孢子的无细菌藻液涂布培养1~2 d后,平板上即长出大量放线菌菌落,但加入放线菌孢子的有细菌藻液涂布培养7 d后,平板上仍然未长出放线菌菌落,这说明,无细菌藻液中的放线菌孢子的萌发虽然受到藻液抑制,但并未死亡,因此涂布在固体培养基上能够迅速萌发生长;而在有细菌藻液中的放线菌孢子已经死亡,因此涂布在固体培养基上长时间培养后仍未见萌发生长。
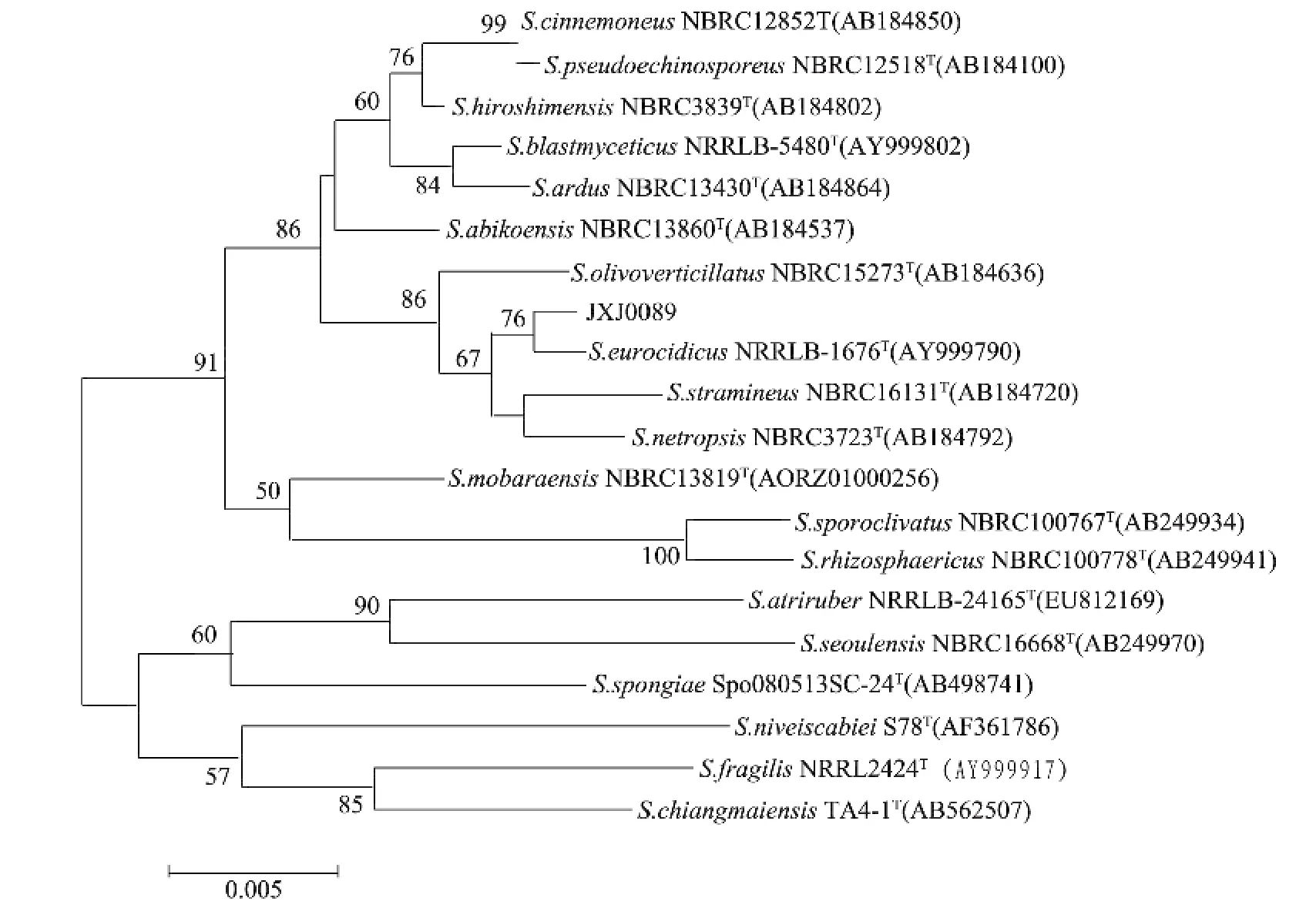
图2 菌株JXJ 0089及亲缘关系最近的相关种以邻接法构建的16S r RNA基因系统进化树Fig.2 Phylogenotic tree of strain JXJ 0089 and other related species of Streptomyces based on 16Sr RNA gene sequences by neighbour-joining
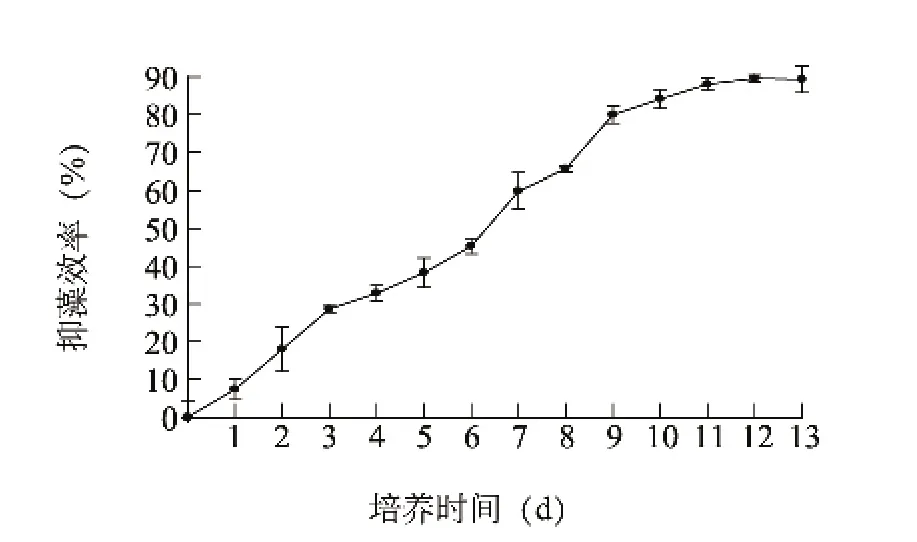
图3 培养时间对S.eurocidicus JXJ 0089抑藻活性的影响Fig.3 Influence of culture time on the inhibitory activity of S.eurocidicus JXJ 0089
2.4.2 菌丝体与铜绿微囊藻之间的相互影响 由图4可知,在100 ml藻液中加入0.2 g菌丝体培养8 d后,有细菌藻和无细菌藻中Chl.a的去除率分别为 52.51% ±2.02%和66.89% ±2.34%,但随着菌丝体的继续增加,Chl.a的去除率没有大幅度增加,即使菌丝体增加到0.8 g,有细菌藻和无细菌藻中Chl.a的去除率也仅分别为 59.00% ±1.98%和76.35% ±1.55%。在藻细胞初始浓度相同的情况下,菌株JXJ 0089菌丝体对无细菌藻Chl.a的去除率显著高于有细菌藻(P<0.01)。显微镜观察显示,无论是在有细菌藻中还是在无细菌藻中,放线菌JXJ 0089的菌丝形态没有明显变化。但平板涂布培养试验结果显示,加入放线菌菌丝的无细菌藻液涂布培养1~2 d后,即长出大量放线菌菌落,而加入放线菌菌丝的有菌藻液涂布培养7 d后,仍然未见放线菌长出,这说明,在无细菌藻液中的放线菌菌丝体未死亡,而在有细菌藻液中的放线菌菌丝体已经死亡。
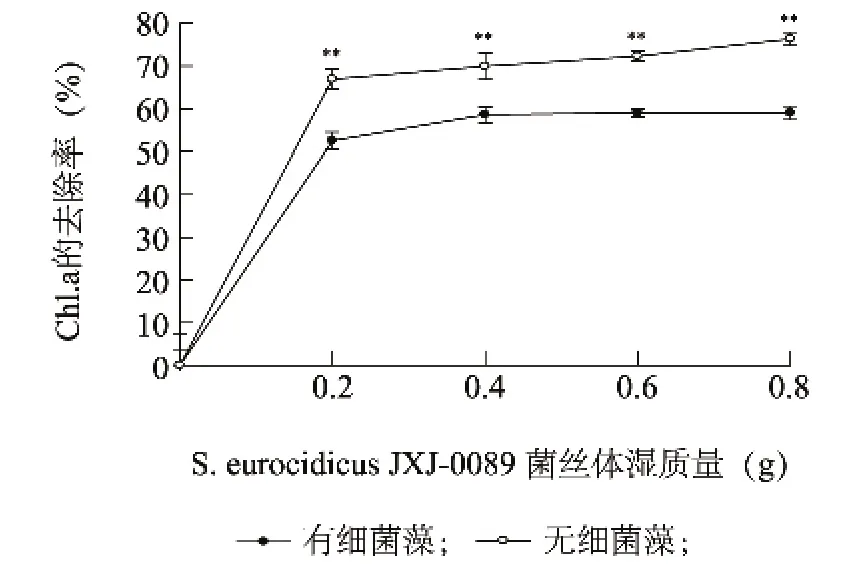
图4 放线菌JXJ 0089的菌丝体对有细菌藻和无细菌藻叶绿素a(Chl.a)的去除率Fig.4 The removal rates of Chl.a in the impure and pure culture of M.aeruginosa by the mycelia of actinomycete strain JXJ 0089
2.5 藻液中抑制放线菌的细菌
经平板划线,从M.aeruginosa FACHB-905培养液中纯化到19株细菌,抑菌试验发现,4株细菌(编号分别为 CY-7、CY-12、CY-16和 CY-19)的菌落周围出现明显的抑菌圈,表明它们对放线菌JXJ 0089具有抑制作用。16SrRNA基因序列分析结果表明,细菌 CY-7与Sphingomonas koreensis JSS26T亲缘关系最近,序列相似性为98.42%,在系统进化树上它们聚在一支(图5A);细菌 CY-12(1 420 bp)与Pseudomonas azotoformans IAM1603T亲缘关系最近,为99.72%,在系统进化树上它们聚在一支(图5B);细菌 CY-16(1 410 bp)与 Agrococcus terreus DNG5T的亲缘关系最近,为99.72%,在系统进化树上它们聚在一支(图5C);细菌CY-19(1 541 bp)与Modestobacter marinus 42H12-1T的亲缘关系最近,为99.12%,在系统进化树上它们聚在一支(图5D)。这些细菌产生何种物质抑制抑藻放线菌JXJ 0089,以及这些细菌对铜绿微囊藻的生长有何影响,目前正在进一步研究中。
3 讨论
抑藻放线菌广泛存在于水陆环境中,且对水华蓝藻具有抑制作用的菌株比率很高[14,31],这与本研究结果一致。目前发现的抑制蓝藻的放线菌主要为链霉菌,如 S.achromogenes[32]、S.phaeofaciens[14]、S. jiujiangensis[33]、S. lushanensis[34]、S. exfoliates[35]、S.endus[17]、S.neyagawaensis[18,36]和 S.hebeiensis 等,本研究首次报道链霉菌S.eurocidicus对蓝藻有抑制活性。
S.eurocidicus代谢产物丰富,能够产生多种抗生素,如叔霉素、氮霉素、优洛杀菌素[37],但尚未有文献报道这些抗生素有抑藻活性。本研究发现,S.eurocidicus JXJ 0089能够分泌多种极性不同的活性成分,抑制铜绿微囊藻生长,其中水溶性成分主要是氨基类化合物。链霉菌产生的含氨基的抑藻物质有蛋白质[36]和赖氨酸[14],另外,含有赖氨酸的多肽往往也具有抑藻活性[38]。TLC分析和茚三酮显色结果说明,S.eurocidicus JXJ 0089产生的水溶性氨基类化合物极性比赖氨酸小,显色也不同,因此应该是其他含氨基的化合物。
放线菌的孢子在无细菌铜绿微囊藻藻液中不能萌发生长,但并未死亡,其菌丝体在无细菌藻液中也能存活,这说明藻细胞或其产生的藻毒素等代谢产物,虽然对放线菌具有一定的抑制作用,尤其是抑制其孢子萌发,但对放线菌的孢子或菌丝体均没有明显的致死作用。
蓝藻附生细菌对蓝藻的生长有重要影响,它们的生理活动或部分代谢产物对藻细胞的生长有促进作用[39]。我们发现,在藻细胞起始浓度相同 (5×106CFU/ml)的情况下,有细菌藻生长速率显著高于无细菌藻,8 d后叶绿素 a含量达到 (1.111±0.042)mg/L,比无细菌藻 (0.688 ±0.051)mg/L高(P<0.01),这可能是附生细菌通过其生理代谢活动,降低了对藻细胞有害物质的浓度,改善了藻细胞的生长环境,或者为藻细胞提供了一些生长所需要的营养成分,从而促进了藻细胞的生长,这应该是S.eurocidicus JXJ 0089菌丝体对无细菌藻的抑藻效率显著高于有细菌藻的重要原因之一。
微囊藻附生细菌包括α-Proteobacteria、γ-Proteobacteria、Actinobacteria和 Bacteroidetes等,其中α-Proteobacteria、γ-Proteobacteria 是 其 主 要 类群[40-44]。从 M.aeruginosa FACHB-905藻液中分离的4株对S.eurocidicus JXJ 0089有抑制作用的细菌,其中CY-7属于α-Proteobacteria的鞘氨醇单胞菌属(Sphingomonas),CY-12 属于γ-Proteobacteria的假单胞菌属(Pseudomonas),而CY-16和CY-19分别属于Actinobacteria的土壤球菌属(Agrococcus)和贫养杆菌属(Modestobacter),Sphingomonas和 Pseudomonas是目前研究最多的两类微囊藻附生细菌。微囊藻的存在有利于附生细菌的生存,增强了细菌吸附有机物等各种营养物质的能力,为细菌提供了有机碳源和更为安全的生长环境[39]。因此,附生细菌可能会抑制一些对藻细胞有害的微生物,降解其抑藻物质,保护藻细胞,以达到维护自身良好生存环境条件的目的,这可能是S.eurocidicus JXJ 0089菌丝体对无细菌藻的抑藻效率显著高于有细菌藻的另一个重要原因。这些研究结果表明,利用抑藻微生物防治蓝藻水华,必须充分考虑藻细胞的附生细菌在其中的作用。

图5 铜绿微囊藻附生细菌及相关种以邻接法构建的16S r RNA基因系统进化树Fig.5 Phylogenetic tree of attached bacteria species of M.aeruginosa based on 16S r RNA gene sequences by neighbor-joining
[1] CHEN W M,SHEU F S,SHEU SY.Novel L-amino acid oxidase with algicidal activity against toxic cyanobacterium Microcystis aeruginosa synthesized by a bacterium Aquimarina sp.[J].Enzyme and Microbial Technology,2011,49(4):372-379.
[2] DAGNINO D,DE ABREU MEIRELESD,DE AQUINO ALMEIDA J C.Growth of nutrient-replete Microcystis PCC 7806 cultures is inhibited by an extracellular signal produced by chlorotic cultures[J].Environmental Microbiology,2006,8(1):30-36.
[3] GUO L.Doing battle with the green monster of Taihu Lake[J].Science,2007,317(5842):1166.
[4] WU X G,JOYCE E M,MASON T J.The effects of ultrasound on cyanobacteria[J].Harmful Algae,2011,10(6):738-743.
[5] AZEVEDO SM,CARMICHAEL W W,JOCHIMSEN E M,et al.Human intoxication by microcystins during renal dialysis treatment in Caruaru-Brazil[J].Toxicology,2002,181-182:441-446.
[6] MIZUNO C S,SCHRADER K K,RIMANDO A M.Algicidal activity of stilbene analogues[J].Journal of Agricultural and Food Chemistry,2008,56(19):9140-9145.
[7] SCHRADER K K,NANAYAKKARA N P,TUCKER C S,et al.Novel derivatives of 9,10-anthraquinone are selective algicides against the musty-odor cyanobacterium Oscillatoria perornata [J].Applied and Environmental Microbiology,2003,69(9):5319-5327.
[8] DAVIS T W,BERRY D L,BOYER G L,et al.The effects of temperature and nutrients on the growth a dynamics of toxic and non-toxic strains of Microcystis during cyanobacterial blooms[J].Harmful Algae,2009,8(5):715-725.
[9] JANCˇULA D,DRÁBKOVÁM,CˇERNY`J,et al.Algicidal activity of phthalocyanines-screening of 31 compounds[J].Environmental Toxicology,2008,23(2):218-223.
[10]刘恩生.生物操纵与非经典生物操纵的应用分析及对策探讨[J].湖泊科学,2010,22(3):307-314.
[11] PAN G,ZHANGM M,CHEN H,et al.Removal of cyanobacterial blooms in Taihu Lake using local soils.I.Equilibrium and kinetic screening on the flocculation of Microcystis aeruginosa using commercially available clays and minerals[J].Environmental Pollution,2006,141(2):195-200.
[12] XU Y F,YANGJ,WANGY L,et al.The effects of jet cavitation on the growth of Microcystis Aeruginosa[J].Journal of Environmental Science and Health,Part A,2006,41(10):2345-2358.
[13] YANR,WUY H,JIH L,et al.The decoction of Radix astragali inhibits the growth of Microcystis aeruginosa[J].Ecotoxicology and Environmental Safety,2011,74(4):1006-1010.
[14] YAMAMOTOY,KOUCHIWA T,HODOKIY.Distribution and identification of actinomycetes lysing cyanobacteria in a eutrotrophic lake[J].Journal of Applied Phycology,1998,10(4):391-397.
[15] KUMAR H D.Streptomycin and penicillin-induced inhibition of growth and pigment production in blue-green algae and production of strains of Anacystis nidulana resistant to these antibiotics[J].Journal of Experimental Botany,1964,15(2):232-250.
[16] QIAN H,LI J J,PAN X J,et al.Effects of streptomycin on growth of algae Chlorella vulgaris and Microcystis aeruginosa [J].Environmental Toxicology,2012,27(4):229-237.
[17] EI-SHERBINY SA,GHALY M F,EI-AYOTY Y M,et al.Niromycin A:an antialgal substance produced by Streptomyces endus N40[J].Research Journal of Microbiology,2007,2(8):606-618.
[18] EI-SHERBINY SA,EI-AYOTY Y M,GHALY M F,et al.Evaluation for the production of antialgal substance from Streptomyces neyagawaensis[J].Biotechnology,2009,8(4):405-415.
[19] SCHRADER K K,RIMANDO A M,DUKE S O.Natural compounds for the management of undesirable freshwater phytoplankton blooms[J].Studies in Natural Products Chemistry,2002,26:351-389.
[20] FENG Y,CHANG X X,ZHAO L X,et al.Nanaomycin a methyl ester,an actinomycete metabolite:algicidal activity and the physiological response of Microcystis aeruginosa[J].Ecological Engineering,2013,53:306-312.
[21] LUOJF,WANGY,TANGSS,et al.Isolation and identification of algicidal compound from Streptomyces and algicidal mechanism to Microcystis aeruginosa[J].Plos One,2013,8(10):1-14.
[22] HEHMANN A,KAYA K,WATANABE M M.Selective control of Microcystis using an amino acid——a laboratory assay[J].Journal of Applied Phycology,2002,14(2):85-89.
[23] PARK M H,CHUNG I M,AHMAD A,et al.Growth inhibition of unicellular and colonial Microcystis strains(Cyanophyceae)by compounds isolated from rice(Oryza sativa)hulls[J].Aquatic Botany,2009,90(4):309-314.
[24] GUMBO JR,CLOETE T E,VAN ZYL GJJ,et al.The viability assessment of Microcystis aeruginosa cells after co-culturing with Bacillus mycoides B16 using flow cytometry[J].Physics and Chemistry of the Earth,2014,72-75:24-33.
[25] DAWSON R M.The toxicology of microcystins[J].Toxicon,1998,36(7):953-962.
[26]余甜甜,张炳火,李汉全,等.一株放线菌对铜绿微囊藻的抑藻活性[J].生态与农村环境学报,2011,27(2):58-63.
[27]徐丽华,李文均,刘志恒,等.放线菌系统学-原理、方法及实践[M].北京:科学出版社,2007.
[28]陈宇炜,陈开宁,胡耀辉.浮游植物叶绿素a测定的“热乙醇法”及其测定误差的探讨[J].湖泊科学,2006,18(5):550-552.
[29]张炳火,张玉琴,李汉全,等.链霉菌JXJ-402产生的抗生素JXJ-402-1的研究[J].中国抗生素杂志,2007,32(5):280-281,299.
[30] HATANO K,NISHII T,KASAI H.Taxonomic re-evaluation of whorl-forming Streptomyces(formerly Streptoverticillium)species by using phenotypes,DNA-DNA hybridization and sequences of gyrB,and proposal of Streptomycesluteireticuli(ex Katoh and Arai 1957)corrig.,sp.nov.,nom.Rev[J].International Journal of Systematic and Evolutionary Microbiology,2003,53(5):1519-1529.
[31] SAFFERMANRS,MORRISM.Evaluation of natural products for algicidal properties[J].Applied Microbiology,1962,10:289-292.
[32] WHYTE L G,MAULE A,CULLIMORE D.Method for isolating cyanobacterial-lysing Streptomycetes from soil[J].J Appl Bacteriol,1985,58:195-197.
[33] ZHANG B H,CHENG J,LI L,et al.Streptomyces jiujiangensis sp.nov.,isolated from soil in South China[J].Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,2014,105(4):763-770.
[34] ZHANG B H,CHENGJ,CHEN W,et al.Streptomyceslushanensis sp.nov.,a novel actinomycete with anti-cyanobacterial activity[J].The Journal of Antibiotics,2015,68(1):5-8.
[35] SIGEE D C,GLENN R,ANDREWS M J,et al.Biological control of cyanobacteria:principles and possibilities[J].Hydrobiologia,1999,395-396:161-172.
[36] CHOIH J,KIM B H,KIM JD,et al.Streptomycesneyagawaensis as a control for the hazardous biomass of Microcystis aeruginosa(Cyanobacteria)in eutrophic freshwaters[J].Biological Control,2005,33(3):335-343.
[37] OSATO T,UEDA M,FUKUYAMA S,et al.Production of tertiomycin(a new antibiotic substance),azomycin and eurocidin by S.eurocidicus[J].The Journal of Antibiotics,1955,8(4):105-109.
[38] TAKAMURA Y,YAMADA T,KIMOTOA,et al.Growth inhibition of Microcystis cyanobacteria by L-lysine and disappearance of natural Microcystis blooms with spraying[J].Microbes and Environments,2004,19(1):31-39.
[39]杨柳燕,肖 琳.湖泊蓝藻水华爆发、危害与控制[M].北京:科学出版社,2011.
[40]董 娟,何晓红,李大平,等.太湖梅梁湾附生细菌和游离细菌群落结构分析[J].应用与环境生物学报,2011,17(1):104-108.
[41] SHI L M,CAI Y F,KONG F X,et al.Specific association between bacteria and buoyant Microcystis colonies compared with other bulk bacterial communities in the eutrophic Lake Taihu,China[J].Environmental Microbiology Reports,2012,4(6):669-678.
[42] SHIL M,CAI Y F,YANG H L,et al.Phylogenetic diversity and specificity of bacteria associated with Microcystis aeruginosa and other cyanobacteria [J].Journal of Environmental Sciences,2009,21(11):1581-1590.
[43] DZIALLAS C,GROSSART H P.Temperature and biotic factors influence bacterial communities associated with the cyanobacterium Microcystis sp[J].Environmental Microbiology,2011,13(3):1632-1641.
[44] PARVEEN B,RAVET V,DJEDIAT C,et al.Bacterial communities associated with Microcystis colonies differ from free-living communities living in the same ecosystem[J].Environmental Microbiology Reports,2013,5(5):716-724.

