小麦籽粒蛋白质双向电泳体系的优化
叶景秀
(青海省农林科学院,青海 西宁 810016)
小麦籽粒灌浆对产量及品质至关重要。前人的工作主要集中在生理生化水平的研究上,例如分析不同因素对灌浆特性的影响[1-3],淀粉的积累规律[4],各种酶的变化规律等[5]。然而,籽粒的灌浆是一个复杂的生理生化过程,仅从生理生化水平无法深层次地揭示其机制。
目前,随着植物蛋白质组学研究技术的日渐成熟,植物蛋白质数据库的不断更新,蛋白质组学技术在水稻[6]、小麦[7]、拟南芥[8]、大豆[9]、烟草[10]等作物中的研究报道日益增多。以植物蛋白质的提取、双向电泳分离、质谱鉴定等先进技术相结合,应用于小麦蛋白质组学的研究主要集中于小麦的根、叶片、花药、花粉等组织器官蛋白质的双向电泳分析及相关蛋白质功能的初步鉴定,然而,由于受籽粒中多糖等物质的影响,较难提取籽粒总蛋白质,影响了蛋白质组学技术在籽粒中的应用。在前人已发表的关于籽粒蛋白质组学研究的文献中,对不同作物所采取的蛋白质提取方法各不相同。王慧娜等[11]在不同方法提取的小麦籽粒蛋白质双向电泳凝胶分离效果的分析比较一文中只介绍了提取方法对双向电泳分离效果的影响,而影响双向电泳效果的因素不仅仅是蛋白质样品的制备还包括蛋白质上样量、分离胶浓度、合适的胶条pH值等。因此,本研究对2种常用的植物组织蛋白质提取方法进行比较,并对双向电泳过程中胶条pH值、蛋白质上样量和分离胶浓度等方面进行优化,以期探索出一套适合于小麦籽粒蛋白质双向电泳的技术体系,为今后开展小麦籽粒蛋白质组学研究提供技术支撑。
1 材料和方法
1.1 试验材料
小麦青春38为青海省农林科学院自育品种,2013年种植于青海省农林科学院试验地,按常规技术栽培管理,乳熟期和蜡熟期分别取穗中部籽粒,以液氮速冻,置-80℃冰箱保存。
1.2 仪器和试剂
PROTEAN IEF Cell等电聚焦系统、PROTEANⅡxi Cell垂直电泳系统、PDQuest 8.0.1凝胶图像分析软件均为美国Bio-Rad公司产品,UMAX Power-Look 2100XL光密度扫描仪为台湾力捷公司产品,pH 4~7和pH 5~8线性IPG胶条、两性电解质等为Bio-Rad公司产品,苯甲基磺酰氟(PMSF)、β-巯基乙醇(β-ME)、二甲氨基丙磺酸(Chaps)、丙烯酰胺(Acrylamide)、甲叉双丙烯酰胺(Bis-acrylamide)、四甲基乙二胺(TEMED)、二硫苏糖醇(DTT)、过硫酸铵、碘乙酰胺、尿素为Sigma和Thermo公司产品,其余试剂均为国产分析纯。
1.3 试验方法
1.3.1 籽粒总蛋白质的提取 TCA(三氯乙酸)/丙酮沉淀法:小麦籽粒加液氮研磨成粉末,参照陈蕊红等[12]的TCA丙酮法提取总蛋白质,略有改动。用-20℃预冷蛋白质提取液(8%TCA,0.07%β-ME,1 mmol/L PMSF)沉淀蛋白质,置-20℃沉淀过夜,期间振荡多次,4℃,14 000 r/min离心30 min,弃上清,沉淀用预冷丙酮溶液(含0.07% β-ME、1 mmol/L PMSF)洗涤,-20℃ 静置1 h后,4℃、14 000 r/min离心30 min,重复4~5次,直至蛋白质沉淀物为纯白色,将沉淀真空冷冻成干粉,-80℃冰箱保存备用。酚提取法:小麦籽粒加液氮研磨成细粉,转移至离心管加适量提取液(0.1 mol/L Tris-HCl,pH8.0,1%DTT,0.9 mol/L蔗糖,1 mmol/L PMSF),搅匀,4℃放置5 min;4℃、14 000 g离心20 min,在上清液中加入等体积的 Tris饱和酚(pH 8.0),充分振荡混匀,4℃静置1 h,离心(4℃,9 000 g,5 min),收集酚相,加入3倍体积预冷的甲醇溶液(含0.1 mol/L醋酸铵),混匀后-20℃过夜,4℃、18 000 g离心30 min,弃上清收集沉淀,沉淀用-20℃预冷丙酮溶液(含0.1%DTT)洗涤,离心(4℃,18 000 g,30 min),重复洗涤过程2~3次,直至蛋白质沉淀物为纯白色,将沉淀真空冷冻成干粉,-80℃冰箱保存备用。
1.3.2 蛋白质的裂解与定量 将蛋白质干粉溶解于水化液(8 mol/L尿素,2 mol/L硫脲,4%Chaps,65 mmol/L DTT,0.5%载体两性电解质),32℃水浴30 min,振荡充分混匀后用液氮冷却,此过程重复2次,于20℃下14 000 r/min离心15 min,吸取上清备用。蛋白质浓度测定参考考马斯亮蓝Bradford法。
1.3.3 蛋白质双向电泳(2D-PAGE) 主要按IPG-phor等电聚焦系统指南进行。取适量蛋白质样品与水化液(加入痕量0.001%溴酚蓝)充分混合至380 μl,沿 PROTAIN IEF Cell型电泳仪(BIO-RAD)聚焦槽内连续加入,将17 cm IPG胶条胶面朝下覆盖在样品上,被动吸收1 h后,加3 ml矿物油覆盖胶条,置于IPG等电聚焦仪的电极板上,在20℃条件下主动水化15 h使胶条充分吸胀,吸收样品,然后以每根50μA的极限电流按表1程序进行第1向等电聚焦电泳。等电聚焦结束后,胶条分别在平衡缓冲液Ⅰ(6 mol/L 尿素,2%SDS,0.375 mol/L Tris-HCl,20%甘油,使用时加2%DTT)和平衡缓冲液Ⅱ(6 mol/L 尿素,2%SDS,0.375 mol/L Tris-HCl,20% 甘油,使用时加2.5%碘乙酰胺)中平衡15 min。第2向SDS-PAGE用12%和13%分离胶。凝胶染色采用硝酸银染色法,其过程依次是:超纯水洗2次,每次2 min,固定液[10%冰乙酸(体积比)+40%无水乙醇(体积比)]固定2.5 h,超纯水快速冲洗2次,敏化液[30%甲醇(体积比)+0.2%硫代硫酸钠(质量体积比)+6.8%乙酸钠(质量体积比)]中30 min,超纯水水洗3次,每次5 min,硝酸银[0.25%硝酸银(质量体积比)]染色20 min,快速漂洗2次,显影液[2.5%无水碳酸钠(质量体积比)+0.04%甲醛(质量体积比)]显影后加终止液[10%冰醋酸(体积比)]终止反应。
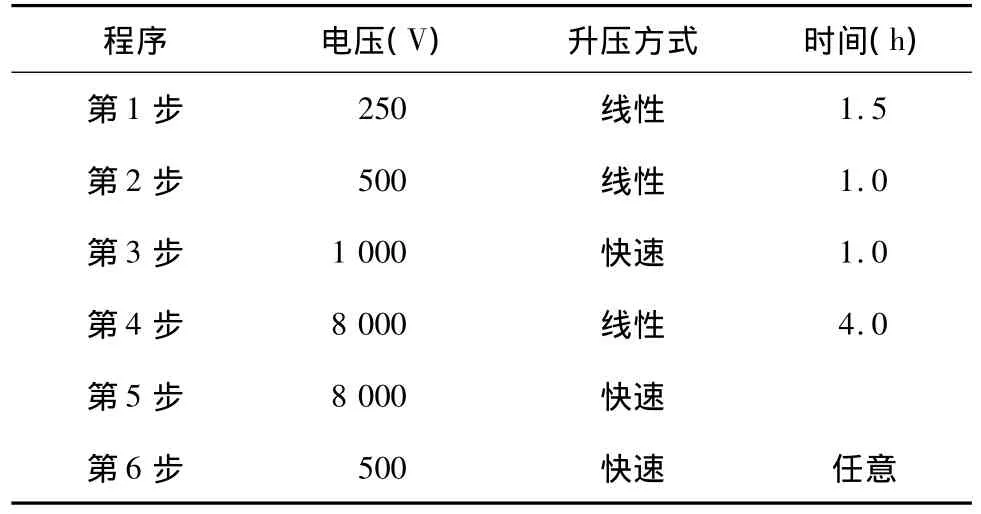
表1 等电聚焦电泳程序Table 1 Procedures of isoelectric focusing electrophoresis
1.3.4 图谱扫描与分析 用 UMAX PowerLook 2100XL型光密度扫描仪透射扫描染色后的双向电泳凝胶获取图像,分辨率设为600 dpi,在PDQuest 2DE 8.0.1分析软件(美国 Bio-Rad公司)的辅助下,定义蛋白质点的大小、强弱,检测和统计蛋白质点数目。
1.3.5 统计分析 用Microsoft Office Excel 2010对3次重复的2-DE图谱上蛋白质点数目进行统计分析。
2 结果
2.1 不同提取方法对蛋白质双向电泳图谱质量的影响
分别用TCA丙酮沉淀法和酚提取法提取小麦籽粒总蛋白质,用蛋白质裂解液裂解蛋白质,用考马斯亮蓝 Bradford法进行蛋白质定量,以17 cm、pH5~8 IPG胶条进行双向电泳分离,硝酸银染色。结果(图1)显示,用酚提取法提取的蛋白质双向电泳图谱酸性端蛋白质点较模糊,分辨率低,横竖纹干扰严重,碱性端效果稍好,但是检测到的蛋白质点数偏少;而TCA丙酮沉淀法提取的蛋白质双向电泳凝胶图谱蛋白质点分布均匀,蛋白质点清晰且更丰富,凝胶背景干净,横竖条纹干扰少。用PDQuest软件统计分析结果显示,在相同的参数条件下,酚提取法可分辨出约260个蛋白质点,TCA丙酮沉淀法则可检测到约490个清晰的蛋白质点,比酚提取法多230个蛋白质点。说明采用TCA丙酮沉淀法提取的小麦籽粒蛋白质双向电泳分离效果较好。
2.2 不同pH值IPG胶条对双向电泳图谱的影响
用等电点pH值4~7的IPG胶条进行的籽粒蛋白质电泳分离结果表明,蛋白质大多集中在碱性端,pH 4~5范围内蛋白质点很少;等电点pH 5~8 IPG胶条的电泳分离结果表明:蛋白质点分布较均匀,能更好地满足研究分析的需求(图2)。

图1 不同方法提取的蛋白质双向电泳图谱比较Fig.1 Comparison of 2-DE maps of proteins extracted by two methods
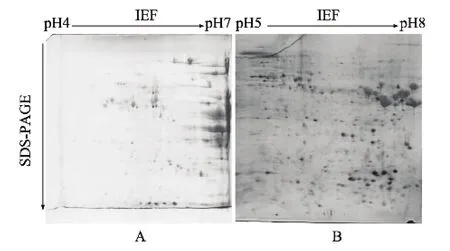
图2 不同pH值IPG胶条的双向电泳图谱比较Fig.2 2-DE maps of protein in the systems with different p H ranges of IPG
2.3 上样量及SDS-PAGE胶浓度对双向电泳图谱的影响
为了更好地分离蛋白质,进一步比较分析了双向电泳中不同蛋白质上样量和SDS-PAGE胶浓度。选用17 cm、pH 5~8 IPG 胶条,分别取300μg、380 μg和450μg蛋白质样品进行双向电泳,结果见图3。在上样量为300μg时,双向电泳图谱上蛋白质点模糊不清,低丰度蛋白质因不能被检测而丢失,影响了双向电泳的准确性和重复性,经软件分析检出304个蛋白质点;在上样量为450μg时,蛋白质点数多,但高丰度蛋白质点过大,出现饱和重叠现象,掩盖了其他蛋白质点,而且图谱上横条纹比较明显,影响了蛋白质点的分离与分析,经软件分析检出570个蛋白质点;上样量为380μg时,蛋白质点清晰,无横条纹干扰,聚焦效果好,图谱质量最佳,经软件分析检出516个蛋白质点。

图3 不同蛋白质上样量的双向电泳图谱比较Fig.3 2-DE maps of different loading quantities of proteins
在选用17 cm pH5~8胶条、上样量380μg的基础上,分别以12%和13%的SDS-PAGE胶浓度对小麦籽粒蛋白质进行电泳分析。分离胶浓度为13%时,高分子量蛋白质分离不充分,蛋白质挤压叠加,遮盖了某些蛋白质点在图谱上的表达,从而降低了分辨率;分离胶浓度为12%时,蛋白质分离较好,蛋白质点清晰圆润,获得较好的分离图谱(图4)。

图4 不同分离胶浓度的双向电泳图谱比较Fig.4 2-DE maps of protein in the systems with different gel concentrations
2.4 双向电泳图谱的重复性分析
蛋白质双向电泳图谱的重复性,是后续蛋白质组学分析结果可靠性的基本保障。为分析本研究建立的小麦籽粒蛋白质双向电泳体系的重复性,在上述优化条件的基础上,采用严格一致的操作程序,并精确控制电泳温度与电流电压,进行了3次双向电泳重复试验。经软件分析发现,3张图谱分别检测到490、512、531个蛋白质点。选取其中1张凝胶图谱作为参考胶,其余图谱与其进行蛋白质点匹配分析,平均匹配率达到96%。蛋白质点位置在IPGIEF方向偏移为 (1.79±0.36)mm,在 SDS-PAGE方向偏移为 (1.65±0.41)mm。说明所建立的双向电泳体系重复性和稳定性均较高。
3 讨论
蛋白质组学是后基因组时代生命科学研究的一个重要领域,蛋白质组学研究的重要性使其相关技术得到突飞猛进的发展[13]。其中,双向电泳作为分离分析蛋白质的重要手段,在蛋白质组研究中发挥着关键作用。因此,对双向电泳条件进行优化显得尤为重要。
样品制备是双向电泳的第一步,采用不同方法提取的蛋白质电泳效果不同。增广娟等[14]比较了苹果叶片蛋白质的不同提取方法,结果表明改良的Tris-HCl提取法的蛋白质点最多,双向电泳效果最好。陈蕊红等[12]比较分析了不同小麦花药蛋白质提取方法,发现TCA丙酮法提取效果较好。石海波等[15]对玉米籽粒蛋白质不同提取方法的研究结果表明,可溶性蛋白质提取法获得的蛋白质纯度高、浓度适中、双向电泳蛋白质点最丰富,最适合双向电泳研究。李奇松等[16]对比了3种不同的蛋白质提取方法,结果表明可溶性蛋白质提取法最适用于籽粒蛋白质组学的研究。本试验对比分析了用途较为广泛的TCA丙酮沉淀法和酚提取法,结果表明TCA丙酮沉淀法比较适用于双向电泳图谱分析,这与王慧娜等[11]的研究结果有分歧,推测可能与提取过程中所用的试剂配方不同有关。
双向电泳体系中电泳条件包括胶条pH值、上样量和SDS-PAGE分离胶浓度等方面[17]。理想的IPG胶条,既要覆盖样品中全部蛋白质的等电点,又不能因等电点相对集中导致大量蛋白质点聚集在一起。本研究根据前期对小麦叶片蛋白质双向电泳分离试验的经验,首先采用了等电点pH值4~7的IPG胶条对小麦籽粒蛋白质进行分离,发现大部分蛋白质集中在碱性端,蛋白质点之间紧密相连,甚至重叠在一起,模糊且不易区分,改用等电点pH 5~8的IPG胶条后,籽粒蛋白质分辨率显著提高,分离效果较好,检测到的蛋白质点数多。
合适的上样量和分离胶浓度在双向电泳中是非常重要的。过大的上样量和分离胶浓度,容易导致蛋白质大量聚集,遮盖部分蛋白质点的表达,无法反映蛋白质组的全部信息;上样量和分离胶浓度过低会导致一些低分子量和低丰度蛋白质超出凝胶所容纳的范围,不能在双向电泳图谱上显现。上样量的多少与IPG胶条的长度、pH值和蛋白质染色方法密切相关。本研究在选用长度17 cm、pH5~8 IPG胶条,采用硝酸银染色的基础上借鉴以往的操作经验,比较了不同上样量(300 μg、380 μg、450 μg)的双向电泳效果,结果表明蛋白质点数量随上样量的增加而增多,但是当上样量增加到450μg时,蛋白质点数量比上样量380 μg时略有增多,但是蛋白质点之间出现了互相重叠,相互干扰现象,表明380μg的上样量较佳。在此基础上比较了分离胶浓度12%和13%的SDS-PAGE凝胶电泳图谱,发现12%的分离胶浓度能够更有效地分离小麦籽粒蛋白质。3次重复试验结果表明,本研究建立的双向电泳体系重复性较好。
综上所述,应用本研究建立的双向电泳体系,能够获得重复性好、蛋白质点清晰、数量丰富的双向电泳图谱,该体系适合于小麦籽粒全蛋白质的双向电泳分析。
[1] 郭明明,赵广才,郭文善,等.播期对不同筋力型小麦旗叶光合及籽粒灌浆特性的影响[J].麦类作物学报,2015,35(2):192-197.
[2] 吴晓丽,汤永禄,李朝苏,等.不同生育时期渍水对冬小麦旗叶叶绿素荧光及籽粒灌浆特性的影响[J].中国生态农业学报,2015,23(3):309-318.
[3] 刘希伟,张 敏,姚凤娟,等.花后不同强度遮光对糯小麦和非糯小麦干物质积累和产量的影响[J].麦类作物学报,2015,35(4):521-527.
[4] 石培春,李英枫,韩 璐,等.不同品质类型小麦籽粒淀粉含量积累的动态差异[J].石河子大学学报:自然科学版,2012,4(30):417-421.
[5] TISCHNER R.Nitrate uptake and reduction in higher and lower plants[J].Plant Cell and Environment,2002,23:1015-1024.
[6] LIU CW,CHANG T S,HSU Y K,et al.Comparative proteomic analysis of early salt stress responsive proteins in roots and leaves of rice[J].Proteomics,2014,14:1759-1775.
[7] PENG Z Y,WANG M C,LI F,et al.A proteomic study of the response to salinity and drought stress in an introgression strain of bread wheat[J].Molecular Cellular Proteomics,2009,8(12):2676-2686.
[8] GALLARDOK,JOB C,GROOTSPC,et al.Proteomics of Arabidopsis seed germination:a comparative study of wild-type and gibberellin-deficient seeds[J].Plant Physiology,2002,129:823-837.
[9] HOUSTON N L,HAJDUCH M,THELEN J J.Quantitative proteomics ofseed filling in castor:comparison with soybean and rapeseed revealsdifferences between photosynthetic and nonphotosyntheticseed metabolism[J].Plant Physiol,2009,151:857-868.
[10] ROCCOA M,CORRADOB G,ARENACS,et al.The expressionof tomato prosystemin gene in tobacco plants highly affects hostproteomic repertoire[J].Joural Proteomics,2008,71:176-185.
[11]王慧娜,高建华,张淑英,等.不同方法提取的小麦籽粒蛋白双向电泳凝胶分离效果的分析比较[J].分子植物育种,2014,12(4):788-795.
[12]陈蕊红,张改生,刘 卫,等.小麦花药蛋白质组双向电泳技术体系的优化[J].核农学报,2008,22(4):404-409.
[13]水 燕,管政兵,赵朝阳,等.克氏原螯虾卵巢发育Ⅳ期与IV期的比较蛋白质组学研究[J].江苏农业科学,2013,41(3):179-183.
[14]增广娟,李春敏,张新忠,等.适于双向电泳分析的苹果叶片蛋白质提取方法[J].色谱,2009,27(4):484-488.
[15]石海波,王云生,冯 勇,等.玉米籽粒蛋白质双向电泳技术体系的优化[J].华北农学报,2015,30(1):171-176.
[16]李奇松,陈 军,林世圣,等.水稻籽粒蛋白双向电泳条件的优化及其蛋白组学方法的比较[J].作物学报,2012,38(5):921-927.
[17]王 娜,谢惠民,王 川.冬小麦叶片抗旱蛋白质组双向电泳技术体系的优化[J].麦类作物学报,2011,31(3):443-449.

