尼洛替尼以PU.1非依赖性调节K562细胞活性*
李有强,曾建明,姚子涛,肖 倩,王丽娜,李 沫
(1.广东省中医院检验科,广州 510006;2.广州中医药大学,广州 510405;3.广东医学院检验学院,广东东莞 523808)
·论 著·
尼洛替尼以PU.1非依赖性调节K562细胞活性*
李有强1,2,曾建明1△,姚子涛3,肖 倩1,王丽娜1,李 沫1
(1.广东省中医院检验科,广州 510006;2.广州中医药大学,广州 510405;3.广东医学院检验学院,广东东莞 523808)
目的 研究尼洛替尼对K562细胞活性和转录因子PU.1的影响。方法 以不同浓度的尼洛替尼分别处理K562细胞48 h后,采用CCK-8法观察K562细胞增殖活性的变化;采用Western blot法检测PU.1的表达情况。结果 CCK-8法显示细胞存活率随尼洛替尼浓度的升高而下降,尼洛替尼对K562细胞株的半数抑制量(IC50)为51.9 nmol/L;Western blot法显示尼洛替尼处理后PU.1的蛋白表达水平未见明显差异(P>0.05)。结论 尼洛替尼可抑制K562细胞活性,但其作用方式非依赖于PU.1。
尼洛替尼; K562细胞; Bcr-Abl; PU.1
尼洛替尼是人工合成的新型酪氨酸激酶抑制剂(TKI),可竞争结合断裂点簇集区-艾贝尔逊白血病病毒(Bcr-Abl)融合蛋白三磷腺苷(ATP)结合位点,抑制Bcr-Abl蛋白的酪氨酸激酶活性,阻断下游多条信号传导通路,达到有效治疗慢性粒细胞白血病(CML)的目的[1]。但由于信号传导通路的复杂性,尼洛替尼通过Bcr-Abl调节下游信号通路的机制尚未完全明确。PU.1蛋白是调控粒系分化的转录因子,不仅在造血干细胞向髓系分化的早期过程中起作用,还与细胞增殖活性有关。有研究表明,Bcr-Abl在mRNA翻译水平通过多聚胞嘧啶结合蛋白E2(hnRNP E2)抑制转录因子C/EBPα的表达[2],而PU.1与C/EBPα有协同作用,可共同调节粒细胞分化增殖[3]。因此,本研究拟探讨尼洛替尼作用于K562细胞株后对PU.1的影响,进一步探索尼洛替尼治疗CML的分子机制。
1 资料与方法
1.1 细胞株来源 K562细胞株由南方医科大学附属珠江医院血液病实验室提供。
1.2 仪器与试剂 尼洛替尼由诺华制药公司提供。CCK-8试剂盒购自日本同仁化学研究所;细胞裂解液RIPA和电化学发光(ECL)显影试剂购自美国Pierce公司;丙烯酰胺和双丙烯酰胺均购自美国Sigma公司。二喹啉甲酸(BCA)蛋白定量试剂盒购自上海百赛生物技术有限公司;聚偏二氟乙烯膜(PVDF膜)和磷酸盐缓冲液(PBS)购自上海生工;蛋白Marker购自北京赛百盛公司。PU.1单克隆抗体和β-actin单克隆抗体均购自美国CST公司。
1.3 方法
1.3.1 K562细胞株的培养 将复苏后的K562细胞株在含有终浓度为10%胎牛血清的RPMI1640培养基中,于37 ℃、饱和湿度、5%CO2的培养箱中培养,每3~4天换液传代,细胞接种密度为每毫升1×105个。
1.3.2 CCK-8法检测细胞增殖 将对数生长期的0.5×104K562细胞接种于96孔板(每孔总体积为200 μL),加入不同终浓度的尼洛替尼(0~100 nmol/L)作用48 h,相同体积的二甲基亚砜(DMSO)为阴性对照组,空白组为不含细胞和尼洛替尼,每组设5个复孔。37 ℃、5%CO2、饱和湿度下共计培养48 h后,取出96孔板,每孔加10 μL的CCK-8溶液,培养箱中继续培养4 h后,酶标仪下测定各孔在450 nm波长处的吸光度值(A450值)。按公式计算存活率:存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%;根据公式计算半数抑制量(IC50):IC50=lg-1[Xm-i(ΣP-0.5)][4]。Xm为设计的最大浓度的对数值,i为各浓度倍比浓度的对数值,ΣP为各组生长抑制率之和,0.5为经验常数。
1.3.3 Western blot检测PU.1的蛋白表达 用RIPA细胞裂解液裂解待测细胞,提取总蛋白质,用BCA法测蛋白含量。等量蛋白质采用SDA-PAGE垂直电泳进行分离,然后转至PVDF膜上,用封闭液[(含5%牛血清蛋白(BSA)的磷酸盐吐温缓冲液(PBST)]4 ℃下封闭1 h后,加入PU.1单克隆抗体(1∶1 000) 4 ℃孵育过夜,室温下洗膜后加相应辣根过氧化物酶(HRP)偶联羊抗兔二抗(1∶4 000)室温孵育1 h,ECL显影。以β-actin作为内参对照。

2 结 果
2.1 K562细胞增殖活性 比较各处理组细胞增殖抑制率,CCK8法检测结果显示尼洛替尼对K562细胞增殖有明显的抑制作用,随尼洛替尼浓度的增加,K562细胞增殖明显下降。尼洛替尼对K562细胞株的IC50为51.9 nmol/L。见表1。
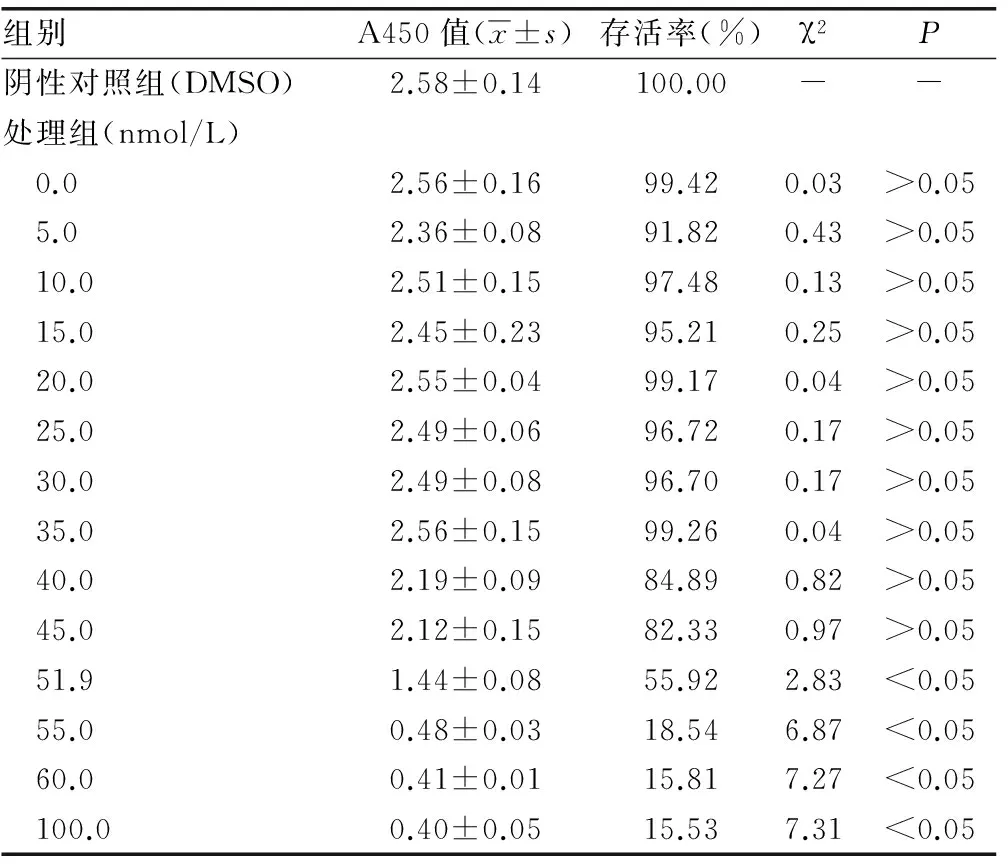
表1 不同浓度尼洛替尼对K562细胞增殖活性的影响
注:χ2、P分别表示各处理组与阴性对照组比较的统计量;-表示无数据。
2.2 Western blot检测PU.1蛋白表达结果 不同浓度的尼洛替尼 (40.0、45.0、51.9 nmol/L)作用于K562细胞48 h后PU.1的蛋白表达量与尼洛替尼处理后比较未见明显差异,差异无统计学意义(P>0.05),见图1。
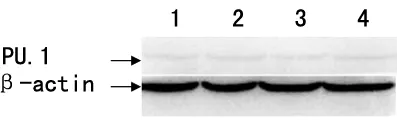
注:1~3号泳道分别为40.0、45.0、51.9 nmol/L 尼洛替尼;4号泳道为DMSO对照组。
图1 尼洛替尼对PU.1蛋白表达的影响
3 讨 论
分子靶向药物尼洛替尼能够特异性地竞争抑制Bcr-Abl酪氨酸激酶活性,且具有较高的反应率和良好的耐受性,已成为CML的一线治疗方案。相对于第1代酪氨酸激酶抑制剂,第2代尼洛替尼具有选择性更强、耐药率更低的优势[1]。同时,由于酪氨酸激酶能催化多种底物蛋白质酪氨酸残基磷酸化,进而启动下游不同的信号转导分子。因此,寻找Bcr-Abl的下游作用蛋白,对进一步阐明尼洛替尼治疗CML的分子机制具有重要意义。然而,本实验发现采用不同浓度的尼洛替尼处理K562细胞后,与K562细胞增殖和分化密切相关的转录因子PU.1的表达量并未出现明显差异,表明尼洛替尼对K562细胞的调节作用非依赖于PU.1。
PU.1是Ets转录因子家族的成员之一,其具有的“螺旋-转角-螺旋”结构的DNA结合区能识别1个富含嘌呤GGAA/T(PU box)基因序列的核心DNA元件,并与之结合,故名PU.1[5]。PU.1不仅在造血干细胞向髓系分化的早期过程中起作用,还在后续的髓细胞和B淋巴细胞的增殖分化中发挥作用。PU.1通过与造血相关基因启动子上的PU.1位点特异性结合,调节靶基因转录表达,如巨细胞集落刺激因子受体(M-CSFR)、粒细胞集落刺激因子受体(G-CSFR)、CD11b、粒细胞过氧化物酶、白细胞介素-7(IL-7)、IL-18和环氧化酶2(COX2)等。同时,CML转归与PU.1基因功能的恢复有关,PU.1基因功能恢复是CML治疗好转的一个重要指标[6-8]。
目前,有研究表明PU.1与转录因子C/EBPα存在协同作用,可共同调节粒细胞分化[3],而且Bcr-Abl可通过hnRNP E2抑制C/EBPα的表达[2]。另外,在髓系细胞分化过程中,PU.1的发挥作用比C/EBPα更早,且在干扰素-α(IFN-α)或STI571治疗好转的CML患者身上发现PU.1表达上调[9]。另有研究表明,降低小鼠PU.1基因的表达能够导致小鼠白血病的发生。因此本研究探讨了在K562细胞株中,Bcr-Abl抑制剂尼洛替尼是否对PU.1的表达有调节作用。在本实验中,通过CCK-8法探索尼洛替尼对K562细胞株增殖活性的影响,发现随着药物浓度的升高,细胞存活率下降,说明尼洛替尼作用于K562细胞后细胞增殖活性发生改变,可促进细胞的死亡。另外,Western blot检测显示尼洛替尼不影响K562细胞中PU.1的表达,表明尼洛替尼未通过Bcr-Abl调节PU.1的表达,证实转录因子PU.1并不是Bcr-Abl的作用底物。
本实验阐明尼洛替尼可明显影响K562细胞株的活性,但其作用方式并不依赖于转录因子PU.1,对进一步探索Bcr-Abl下游相关分子具有一定的借鉴作用。
[1]Weisberg E,Manley P,Mestan J,et al.AMN107 (Nilotinib):a novel and selective inhibitor of BCR-ABL[J].Br J Cancer,2006,94(12):1765-1769.
[2]Ferrari-Amorotti G,Keeshan K,Zattoni M,et al.Leukemogenesis induced by wild-type and STI571-resistant BCR/ABL is potently suppressed by C/EBPalpha[J].Blood,2006,108(4):1353-1362.
[3]Dahl R,Walsh JC,Lancki D,et al.Regulation of macrophage and neutrophil cell fates by the PU.1:C/EBPalpha ratio and granulocyte colony-stimulating factor[J].Nat Immunol,2003,4(10):1029-1036.
[4]赵荣荣,赵瑶,张仕状.肿瘤细胞状态对检测壁虎活性单体IC50的影响[J].潍坊医学院学报,2012,34(1):18-20.
[5]Moreau-Gachelin F.Spi-1/PU.1:an oncogene of the Ets family[J].Biochim Biophys Acta,1994,1198(2-3):149-163.
[6]Ito T,Nishiyama C,Nakano N,et al.Roles of PU.1 in monocyte-and mast cell-specific gene regulation:PU.1 transactivates CIITA pIV in cooperation with IFN-γ[J].Int,Immunol,2009,21(7):803-816.
[7]Kueh HY,Champhekar A,Nutt SL,et al.Positive feedback between PU.1 and the cell cycle controls myeloid differentiation[J].Science,2013,341(6146):670-673.
[8]Kastner P,Chan S.PU.1:a crucial and versatile player in hematopoiesis and leukemia[J].Int J Biochem Cell Biol,2008,40(1):22-27.
[9]Albajar M,Gutierrez P,Richard C,et al.PU.1 expression is restored upon treatment of chronic myeloid leukemia patients[J].Cancer Lett,2008,270(2):328-336.
Nilotinib for regulating K562 cell viability in PU.1-independent manner*
LIYou-qiang1,2,ZENGJian-ming1△,YAOZi-tao3,XIAOQian1,WANGLi-na1,LIMo1
(1.DepartmentofClinicalLaboratory,GuangdongProvincialHospitalofChineseMedicine,Guangzhou,Guangdong510006,China;2.GuangzhouUniversityofChineseMedicine,Guangzhou,Guangdong510405,China;3.InstituteofLaboratoryMedicine,GuangdongMedicalCollege,Dongguan,Guangdong523808,China)
Objective To investigate the effect of nilotinib on the viability and transcription factor PU.1 in K562 cells.Methods K562 cells were treated with different concentrations of nilotinib for 48 h;the CCK-8 method was adopted to observe the change of K562 cells proliferation viability;the expression of PU.1 was determined by using Western Blot.Results The CCK-8 method showed that the survival rate of K562 cells was decreased with the nilotinib concentration increase.The 50% inhibitory concentration(IC50) of niloinib to K562 cells was 51.9 nmol/L;the Western blot test indicated that the expression of PU.1 in K562 cells had no significant difference after niloinib treatment(P>0.05).Conclusion Nilotinib could inhibit the viability of K562 cells in a PU.1-independent manner.
Nilotinib; K562 cells; Bcr-Abl; PU.1
广东省自然科学基金(S2012010008916)。
李有强,男,硕士,主管技师,主要从事临床生化和临床血液检验。△
,E-mail:labo9@126.com。
10.3969/j.issn.1672-9455.2015.06.010
A
1672-9455(2015)06-0745-02
2014-10-11
2014-12-29)

