温度对厌氧环境下污泥中抗生素抗性基因行为特征的影响
钱燕云,郑吉,徐莉柯,苏超,陈红
浙江大学环境与资源学院环境工程研究所,杭州 310058
温度对厌氧环境下污泥中抗生素抗性基因行为特征的影响
钱燕云,郑吉,徐莉柯,苏超,陈红*
浙江大学环境与资源学院环境工程研究所,杭州 310058
抗性基因的转移传播使得污水处理厂成为其重要的储存库,对人类健康存在潜在风险。实验采用序批式厌氧反应器,温度设定分别为15 ℃、中温(30 ℃和36 ℃)、高温(50 ℃和60 ℃),探究温度对污泥厌氧条件下8种抗生素去除效果的影响,以及四环素类抗性基因(tetA、tetG、tetL、tetM、tetO、tetQ、tetW、tetX)、磺胺类抗性基因(sulI、sulII)和Ⅰ类整合子整合酶基因(intI1)的行为特征。研究发现温度升高有利于抗生素及抗性基因的去除,15 ℃、中温和高温下总抗生素的平均去除率分别为45%、59%和78%;15 ℃、中温和高温下四环素类抗性基因分别削减0.52 log、0.90 log和1.50 log,磺胺类抗性基因分别削减0.56 log、0.78 log和1.31 log。相关性分析发现,总抗性基因与总氮、氨氮、SCOD(溶解性COD)均存在显著相关性(R2=0.744、0.760、0.315,P<0.05),而与总磷无显著相关性(P>0.05)。intI1与总氮、氨氮、SCOD皆存在显著相关性(R2=0.698、0.795、0.269,P<0.05),而与总磷无显著相关性(P>0.05)。说明微生物生长环境中的营养元素一定程度上影响着抗性基因的传播和扩散。
抗生素;抗性基因;厌氧环境;温度;序批式
20世纪以来,大量的抗生素被不合理、不规范地使用,其残留给周围环境中的细菌造成了一种选择性压力,使得筛选出的细菌耐药性不断增加,其中含有抗性的DNA片段是环境中抗性基因的重要来源[1]。医用抗生素不能被人体吸收的部分可诱导肠道内的微生物产生耐药性从而形成耐药菌株,它们随粪便排出体外,通过垂直基因转移和水平基因转移[2]等作用传播抗性,使得抗性细菌大量增殖,而这些含有抗性细菌的污水最终排入城市污水处理厂,并在污水处理厂中传播扩散,使得城市污水处理厂成为抗性基因和抗性细菌的储存库[3-5]。污水处理工艺并不能有效削减所有抗性细菌,其出水中仍含有一定丰度的抗性基因,排入自然水体给环境带来了潜在威胁。Lapara等[6]对德鲁斯海港、圣路易斯河中的抗性基因进行研究发现,城镇污水处理厂经三级处理过的污水是其水体中抗性基因的重要来源,即使是处理过的污水,其排放仍对地表水中抗性基因丰度影响很大。目前,污水处理厂主要采用活性污泥法处理污水,会产生大量的剩余污泥,据国家环境保护部测算,我国城市每年污泥产生量预计将近3 000万t(以含水率80%计)。这些污泥经填埋、露天堆放或土地利用后,其中的抗生素抗性基因会扩散传播进入周围环境和土壤中[7]。Munir等[8]研究发现污泥中含有高浓度的抗性基因和抗性细菌,高级污泥处理方法(厌氧消化和石灰石稳定)相比于传统污泥处理方法(脱水和重力浓缩)能很大程度上降低抗性基因的丰度。相比于出水,剩余污泥经过农业和土地应用后,能够释放更多的抗性基因进入环境,给生态环境带来更大的风险。
研究表明厌氧处理能有效削减污泥中的抗性基因。Ma等[9]研究了实验室规模下不同污泥消化条件对磺胺类(sulI、sulII),红霉素类(ermB、ermF),四环素类(tetO、tetW、tetC、tetG、tetX)抗性基因的影响,鉴于其作为预测抗性基因横向转移和多重耐药性的指标,同时也检测了Ⅰ类整合子基因(intI1),研究表明固体停留时间延长,有利于大部分抗性基因(sulI、sulII、tetC、tetG、tetX)的削减,而小部分抗性基因(tetW、ermB、ermF)的丰度反而有所升高。Ghosh等[10]比较研究了高温和中温厌氧消化对不同机理的四环素类抗性基因(tetA、tetO、tetX)以及Ⅰ类整合子(intI1)的去除效果。目前,四环素抗性基因主要有3种机理[11]:(1)编码“外排泵”(tetA、tetB、tetC、tetG、tetL),利用膜转运蛋白将细菌内的抗生素排出细胞或转移到外周胞质内来降低抗生素浓度[12]。(2)编码核糖体保护蛋白(tetM、tetW、tetO、tetQ),这些存在于细胞质中的蛋白可以保护核糖体免受四环素作用。(3)编码一种修饰或钝化四环素的酶(tetX),使四环素失活。研究表明,不同机理的四环素类抗性基因在厌氧消化过程中表现出不同的去除效率[10]。Diehl和Lapara[13]研究了实验室规模下不同温度(22 ℃、37 ℃、46 ℃、55 ℃)对抗性基因(tetA、tetL、tetO、tetW、tetX)以及Ⅰ类整合子基因(intI1)的影响,发现随着温度升高,ARGs的去除效果增加。以上研究均能证明污泥厌氧处理是削减污泥中抗性基因的有效方法。其中,温度控制污泥中微生物的活性,是重要的影响因素[14]。但大部分的研究主要是连续或半连续状态的厌氧处理[9-10,13],温度对序批式厌氧消化反应削减抗性基因影响的研究较少。
本研究采用序批式实验,装置规模为1 L,分别在15 ℃、中温(30 ℃和36 ℃)、高温(50 ℃和60 ℃)下反应50 d,过程中不添加任何物质,定期测定其中的总氮、总磷,SCOD(溶解性COD)、氨氮变化,以及3种抗性机理的四环素类抗性基因(tetA、tetG、tetL、tetM、tetO、tetQ、tetW、tetX),磺胺类抗性基因(sulI、sulII)。Ⅰ类整合子(intI1)广泛存在于污泥中,可能影响抗性基因的水平转移,因此也作为本实验的目标基因之一。泥样中测定的抗生素主要包括四环素(TC)、金霉素(CTC)、氧四环素(OTC)、磺胺嘧啶(SD)、磺胺甲恶唑(SMX)、磺胺甲基嘧啶(SM1)、磺胺二甲嘧啶(SM2)、甲氧苄氨嘧啶(TMP)。根据测定结果,了解抗生素和抗性基因在厌氧反应中的行为特征和温度对其削减的影响。同时分析其中氮磷营养元素与抗性基因以及intI1变化的相关性,探寻抗性基因在环境中传播的潜在影响因素。
1 材料与方法 (Materials and methods)
1.1 实验装置
本实验采用序批式实验,用1 L的三口圆底烧瓶为发酵罐,水浴恒温磁力搅拌器(金坛市医疗仪器厂,中国)来控制发酵温度,并达到全混状态。实验污泥来自临安城市污水处理厂的剩余污泥,含水率为99%。实验过程中,不添加任何物质,为了保证微生物对水的消耗,实验开始时,加入少量去离子水。将该污泥分装到5个1 L烧瓶中,用三脚架固定在水浴锅中,烧瓶的一口通入盛有水的锥形瓶,观察实验过程中是否有气泡产生。向污泥中通氮气(高纯,杭州今工特种气体有限公司)5 min,除去烧瓶中的空气并检查气密性。设定恒温水浴锅的温度分别为15 ℃、30 ℃、36 ℃、50 ℃、60 ℃,用蠕动泵向水浴锅中加水使得水浴锅的水位线超过烧瓶中污泥的水位线,保证污泥的上下恒温,观察温差在1 ℃以内。
1.2 样品采集及预处理
每个温度样品各取15 mL,实验进行50 d,对第0、10、15、20、30、40、50天样品进行采样分析。将采集的样品先用大容量冷冻离心机(Thermo公司,德国)在10 000 r·min-1下冷冻离心10 min,上清液再用0.45 μm的滤膜进行抽滤。收集滤膜,将滤膜与泥样放入物料盘于-20 ℃冰箱内预冷冻4~6 h后,使用真空冷冻干燥机(宁波新芝生物科技有限分公司,中国)进行冻干,将滤膜上的干污泥混入干燥的泥样中,用研钵磨碎过筛(80目)后储存备用。收集滤液,进行氮磷等的测定。
1.3 样品水质指标的测定
将收集的滤液及时测定SCOD、总氮、总磷、氨氮。SCOD采用重铬酸钾消解法,用智能型多功能消解器(兰州连华环保科技有限公司,中国)在150 ℃下消解2 h后,DR5000紫外可见分光光度计(北京安恒测试技术有限公司,中国)测定其吸光度,对照标准曲线得SCOD值。总氮测定采用碱性过硫酸钾消解紫外分光光度法(HJ636—2012)。总磷测定采用钼酸铵分光光度法(GB11893—89)。氨氮测定采用纳氏试剂分光光度法(HJ 535—2009)。
1.4 超高液相色谱- 串联质谱
本实验采用超高液相色谱-串联质谱联用仪(UPLC-MS/MS)测定泥样中8种抗生素(TC、CTC、OTC、SD、SMX、SM1、SM2、TMP)浓度[15]。样品预处理,取0.08 g过筛(80目)后干污泥,采用震荡-超声-离心法萃取抗生素,用超纯水稀释至800 mL,使得甲醇含量在2%以下。经过稀释后的提取液采用固相萃取方法进行进一步净化提纯。使用氮气吹干仪(天津市东康科技有限公司,中国)吹至2 mL以下,用甲醇∶水(V∶V=1∶1)定容至5 mL。处理好的样品密封避光储存在-20 ℃,40 d内进行检测,检测前,添加内标物溶液。样品的测定采用的超高压液相色谱-质谱联用仪为Waters Acquity TM Ultra Performance LC串联Quattro Premier Micromass(Waters, USA),色谱分析柱为Waters AcquityTM UPLC BEH C18(50 mm×2.1 mm, 1.7 μm),电离源为电喷雾电离源(ESI),检测器为Quattro Premier Micromass,MRM检测模式,Masslynx 4.0工作站(美国Waters公司)。为了比较完全的消除基质干扰效应,采用同位素内标法进行定量,通过检测后内标物峰面积、待测物峰面积的比值,同时配置内标工作曲线,从内标物工作曲线中得到实际样品的浓度。
1.5 定量PCR
本实验使用FastDNA Spin Kit Forsoil试剂盒提取DNA,用微量蛋白质核算分析仪测定提取后所得样品DNA的浓度和纯度。试验中选择了四环素类抗性基因(tetA、tetG、tetL、tetM、tetO、tetQ、tetW、tetX)、磺胺类抗性基因(sulI、sulII)、Ⅰ类整合子整合酶基因(intI1)以及16S rRNA进行检测。定量PCR反应在StepOne Plus实时荧光定量PCR仪器(ABI,USA)中进行。反应体系为7.5 μL SYBR Premix Ex Taq溶液,0.3 μL ROX Reference溶液,0.3 μL浓度为10 μmol·L-1的正向引物,0.3 μL浓度为10 μmol·L-1的反向引物,4.6 μL ddH2O,2 μL DNA模板。定量PCR反应程序为预变性95 ℃下热变性30 s;然后进入40个循环的扩增阶段,包括95 ℃变性5 s,退火30 s,72 ℃延伸30 s,延伸的同时扫描荧光信号。溶解曲线程序为55 ℃至95 ℃之间,每0.5 ℃读数,其间停留30 s。每个样品重复3次,根据每一轮扩增扫描到的信号强弱对比标准品的信号强弱得出样品中抗性基因的浓度,反应结果也可以根据标准曲线计算出样品中抗性基因的浓度。表1为本实验中的引物和PCR条件。

表1 本实验中的引物和PCR条件Table 1 Primer and PCR conditions used in this study
1.6 标准曲线建立
对临安污水处理厂剩余污泥进行为期1个月的采样,采样频率为每周1次。样品使用专用DNA提取试剂盒进行DNA提取,普通PCR扩增得到目的基因,然后用商业化凝胶回收试剂盒进行纯化回收,测定DNA含量、纯度并调节至合适浓度后连接到pMD19-T载体,转入E. coli感态细胞DH5α ,将感态细胞涂于含有氨苄青霉素,X-gal和IPTG的LB固体培养基上培养12~16 h,挑选阳性克隆子扩大培养后测序,测序结果同NCBI网站的BLAST进行序列同源性检索比对(http://www.ncbi.nhn.nih.gov/blast/)。使用QIAGEN质粒专用提取试剂盒进行质粒提取,微量核酸蛋白质分析仪监测提取质粒的含量及纯度,确保质粒DNA的A260/A280比值在1.8左右。符合要求的质粒,作为标准品计算浓度(质粒
浓度=(质量/分子量)×6.02×1023)。将已知浓度的质粒标准品依次进行10倍稀释,并且保证质粒浓度在108~103之间,然后进行荧光定量PCR实验,结果经StepOne Software(version 2.0)分析得到各抗性基因的荧光定量标准曲线。
2 结果与讨论(Results and discussion)
2.1 抗生素变化规律
原始污泥中均检出上述8种抗生素,其中3种四环素类抗生素(TC、CTC、OTC)的检出浓度较高,分别为1 185.3 μg·kg-1(干污泥)、1 003.2 μg·kg-1(干污泥)、2 639.1 μg·kg-1(干污泥)。磺胺类抗生素的检出浓度较低,总浓度为910.8 μg·kg-1(干污泥)。相比于磺胺类抗生素,四环素类抗生素较易吸附于污泥颗粒上。抗生素的降解途径主要是水解作用[21-22]。

图1 不同温度下厌氧环境污泥中抗生素的浓度变化
图1为不同温度下抗生素的变化趋势,15 ℃、中温(30 ℃、36 ℃)和高温(50 ℃、60 ℃)下总抗生素的平均去除率分别为45%、59%和78%。其中四环素类抗生素的去除效果较好,15 ℃、中温、高温下的平均去除率分别为46%、60%和81%。磺胺类抗生素中SD、SM2和TMP的原始浓度较低但降解较多,SM1基本没有降解,15 ℃、中温、高温下总磺胺类抗生素的平均去除率分别为41%、51%和59%。可以看出,抗生素的降解效果随温度的升高而升高。
2.2 抗性基因变化规律
原始污泥中均检出8种四环素类目标抗性基因,其中tetG的浓度较高,达到1010copies·g-1(干污泥),这与Auerbach等[4]的研究一致。图2为不同温度下四环素类抗性基因的变化趋势,由图可知温度升高对四环素类抗性基因的削减效果影响显著,15 ℃、中温(30 ℃、36 ℃)和高温(50 ℃、60 ℃)下分别削减0.52 log、0.90 log和1.50 log,但不同抗性机理的抗性基因表现不一致。编码“外排泵”基因(tetA、tetG、tetL)中tetA和tetG的变化趋势相似,相比于中温,高温下该类抗性基因(除tetL)的去除效果更佳,分别削减1.55 log和2.20 log。高温对tetL的影响与其他基因不同,原因在于其主要存在于革兰氏阳性菌,无论在厌氧还是好氧条件下,温度升高对其的削减影响均不大[14]。4种编码核糖体保护蛋白基因(tetM、tetW、tetO、tetQ)的变化趋势相似,高温均能促进其削减,且在40 d时削减量达到最大,分别为1.12 log、2.23 log、1.39 log和0.97 log。其中tetO的削减力度最大,原因在于这类抗性基因虽然来自相同作用机理,但是存在于不同种类的微生物,tetO主要存在于好氧微生物,厌氧环境促进其削减[13]。在反应进行到50 d时,只有高温下的tetM、tetO和tetQ浓度部分回升,分别回升0.49 log、0.84 log和0.54 log。编码钝化酶基因tetX的变化趋势与编码核糖体保护蛋白基因相似,高温下削减效果更佳,在40 d时削减量达到最大,15 ℃、中温和高温下分别为0.75 log、1.37 log和2.64 log。反应50 d时,各个温度下的tetX浓度都有所回升,平均回升为0.33 log。 污泥中同样检出了2种磺胺类抗性基因(sulI、sulII),且两者浓度很高,分别为2.7×1010copies·g-1(干污泥)和1.3×1010copies·g-1(干污泥)。图3为不同温度下磺胺类抗性基因的变化趋势,由图可知温度对磺胺类抗性基因影响显著,15 ℃、中温和高温下分别削减0.56 log、0.78 log和1.31 log。sulI和sulII的表现一致,高温均能促进其削减,在反应40 d时削减量最大,分别为1.07 log和1.86 log,sulII比sulI削减力度更大。但反应50 d时,各个温度下的sulI和sulII都出现了少量回升,sulI平均回升0.18 log,sulII平均回升0.07 log。

图3 不同温度下厌氧环境污泥中磺胺类抗性基因的变化趋势

图4 不同温度下厌氧环境污泥中I类整合子的变化趋势
Ⅰ类整合子(intI1)是允许细菌结合外生基因盒并调节其表达的基因片段,对大部分抗性基因的交流和整合起重要作用[23]。图4为不同温度下污泥中intI1的变化趋势,15 ℃、中温和高温下分别削减0.50 log、0.99 log和1.93 log。但反应50 d时各个温度下平均回升0.15 log,这与磺胺类抗性基因实验结果相似。目前研究表明高温对Ⅰ类整合子具有一定的去除效果[9-10,13],与本实验结果一致。
污泥中细胞外的DNA会被水解和生物降解,其降解速率随温度的升高而升高,胞外DNA中含有一定数量的抗性基因,因此高温相对于中温对胞外抗性基因的去除更有效。除此之外,温度影响着微生物体内的酶活性,改变酶促反应速率,最终影响细胞合成。温度升高,微生物生长繁殖可能受限制,微生物种类数量也会有差异。污泥中微生物多样性丰富,高密度的生物量是横向基因转移的先决条件[24],因此其中的抗性基因可能通过横向基因转移而扩增,但也有部分抗性基因可能由于特异性而衰减,目前还没有定论。本研究中温度升高,有利于抗性基因的削减,这结论也在Ma等[9]的研究中得到印证。其变性梯度凝胶电泳(DGGE)结果显示高温下污泥中生物的多样性比中温下要低,而低多样性减少了微生物通过横向基因转移找到合适宿主的可能性。生物群落的组成也能很大程度上影响抗性基因对环境变化的响应。反应50 d时部分抗性基因有所回升,可能是因为适应环境的微生物增殖而促进纵向基因转移,或者是因为Ⅰ类整合子的同样回升而引起的横向基因转移。
2.3 相关性分析
微生物生长与所在环境有密切关系,微生物所需的氮磷营养元素一定程度上也影响着微生物的生长。本实验定期取样,测其中的总氮(TN)、总磷(TP)、氨氮(NH3-N)和SCOD浓度,图5为其在不同温度下的变化趋势,TP和SCOD浓度在15 ℃和中温下呈下降趋势,高温下变化幅度很小但浓度较高。NH3-N和TN浓度在各个温度下均呈上升趋势,高温下浓度也相对较高。
相关性分析结果见表2,星号标注表示两者显著相关(P<0.05)。由表可知,总抗性基因丰度与TN、NH3-N和SCOD皆存在显著相关性,其中与TN和NH3-N的相关性系数较高(R2=0.745、0.760,P<0.01)。所有的抗性基因与TN、NH3-N均存在相关性,其中tetA与这两者的相关性系数最高(R2=0.839、0.809,P<0.01)。所有的抗性基因与TP都不存在显著相关性。大部分抗性基因与SCOD皆存在显著相关性(P<0.05)。微生物细胞中大约含氮5%~13%,是微生物细胞蛋白质和核酸的主要成分,同时氮源也能提供部分能量供微生物生长,因此在外界不提供氮源的情况下氨氮等氮源物质对微生物的行为影响很大,微生物对氮源的需求量也大,从而在一定程度上影响了抗性基因的扩增、削减和转移。磷等无机盐参与细胞结构组成,并与能量转移、细胞透性调节功能有关,微生物对其的需求量在10-4~10-3mol·L-1,本实验测得磷的浓度均大于10-3mol·L-1,因此该厌氧反应过程中磷浓度变化对微生物的影响较小。
此外,研究还发现Ⅰ类整合子(intI1)与TN、NH3-N和SCOD皆存在显著相关性(P<0.05),其中与TN和NH3-N的相关性系数较高(R2=0.698、0.795,P<0.01),这与总抗性基因表现一致。intI1对细菌间的基因转移起重要作用,营养元素与其相关性显著说明营养元素一定程度上也影响着抗性基因的横向转移,但抗性基因的传播机制复杂,仍需进一步探究。

图5 不同温度下厌氧环境污泥TN、TP、NH3-N和SCOD的变化趋势
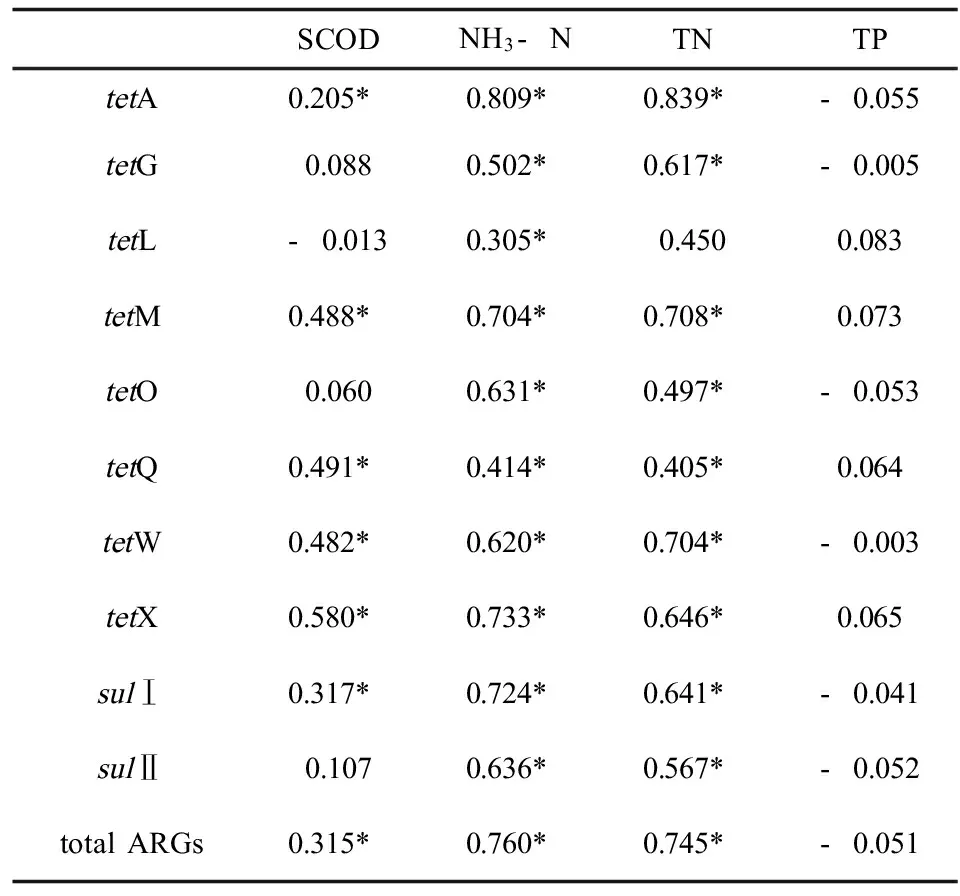
表2 抗性基因与SCOD、NH3-N、TN、TP的相关性分析Table 2 Correlation analysis of ARGs and SCOD, NH3-N, TN and TP
注:*表示两者具有显著相关性(P<0.05)。
Note: Asterisk means there was a significant correlation of ARGs and SCOD, NH3-N, TN and TP.
[1] Tello A, Telfer T C. Selective pressure of antibiotic pollution on bacteria of importance to public health [J]. Environmental Health Perspectives, 2012, 120(8): 1100-1106
[2] Stokes H W, Gillings M R. Gene flow, mobile genetic elements and the recruitment of antibiotic resistance genes into Gram-negative pathogens [J]. FEMS Microbiology Reviews, 2011, 35(5): 790-819
[3] Bouki C, Venieri D, Diamadopoulos E. Detection and fate of antibiotic resistant bacteria in wastewater treatment plants: A review [J]. Ecotoxicology & Environmental Safety, 2013, 91(4): 1-9
[4] Auerbach E A, Seyfried E E, Mcmahon K D. Tetracycline resistance genes in activated sludge wastewater treatment plants [J]. Proceedings of the Water Environment Federation, 2007, 41(5): 1143-1151
[5] Zhang Y, Marrs C F, Simon C, et al. Wastewater treatment contributes to selective increase of antibiotic resistance among Acinetobacter spp [J]. Science of the Total Environment, 2009, 407(12): 3702-3706
[6] Lapara T M, Burch T R, Mcnamara P J, et al. Tertiary-treated municipal wastewater is a significant point source of antibiotic resistance genes into Duluth-Superior Harbor [J]. Environmental Science & Technology, 2011, 45(22): 9543-9549
[7] Munir M, Xagoraraki I. Levels of antibiotic resistance genes in manure, biosolids, and fertilized soil [J]. Journal of Environmental Quality, 2011, 40(1): 248-255
[8] Munir M, Wong K, Xagoraraki I. Release of antibiotic resistant bacteria and genes in the effluent and biosolids of five wastewater utilities in Michigan [J]. Water Research, 2011, 45(2): 681-693
[9] Yanjun M, Christopher A W, John T N, et al. Effect of various sludge digestion conditions on sulfonamide, macrolide, and tetracycline resistance genes and class I integrons [J]. Environmental Science & Technology, 2011, 45(18): 7855-7861
[10] Ghosh S, Ramsden S J, Lapara T M. The role of anaerobic digestion in controlling the release of tetracycline resistance genes and class 1 integrons from municipal wastewater treatment plants [J]. Applied Microbiology & Biotechnology, 2009, 84(4): 791-796
[11] Roberts M C. Update on acquired tetracycline resistance genes [J]. FEMS Microbiology Letters, 2005, 245(2): 195-203
[12] Martinez J L, Martínez S L, Hernez A, et al. Functional role of bacterial multidrug efflux pumps in microbial natural ecosystems [J]. FEMS Microbiology Reviews, 2009, 33(2): 430-449
[13] Diehl D L, Lapara T M. Effect of temperature on the fate of genes encoding tetracycline resistance and the integrase of class 1 integrons within anaerobic and aerobic digesters treating municipal wastewater solids [J]. Environmental Science & Technology, 2010, 44(23): 9128-9133
[14] Zábranská J, Dohányos M, Jenícek P, et al. Efficiency of autothermal thermophilic aerobic digestion and thermophilic anaerobic digestion of municipal wastewater sludge in removing Salmonella spp. and indicator bacteria [J]. Water Science & Technology, 2003, 47(3): 151-156
[15] 朱赛嫦, 王静, 邵卫伟, 等. 超高效液相色谱-串联质谱法同时检测地表水中18种药物与个人护理品的残留量[J]. 色谱, 2013, 31(1): 15-21
Zhu S C, Wang J, Shao W W, et al. Simultaneous determination of 18 pharmaceuticals and personal care products in surface water by ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2013, 31(1): 15-21
[16] Ng L K, Martin I, Alfa M, et al. Multiplex PCR for the detection of tetracycline resistant genes [J]. Molecular & Cellular Probes, 2001, 15(4): 209-215
[17] Aminov R I, Garrigues J N, Mackie R I. Molecular ecology of tetracycline resistance: Development and validation of primers for detection of tetracycline resistance genes encoding ribosomal protection proteins [J]. Applied & Environmental Microbiology, 2001, 67(1): 22-32
[18] Luo Y, Mao D, Rysz M, et al. Trends in antibiotic resistance genes occurrence in the Haihe River, China [J]. Environmental Science & Technology, 2010, 44(19): 7220-7225
[19] Liu M M, Zhang Y, Yang M, et al. Abundance and distribution of tetracycline resistance genes and mobile elements in an oxytetracycline production wastewater treatment system [J]. Environmental Science & Technology, 2012, 46(14): 7551-7557
[20] Gaze W H, Zhang L, Abdouslam N A, et al. Impacts of anthropogenic activity on the ecology of class 1 integrons and integron-associated genes in the environment [J]. ISME Journal, 2011, 5(8): 1253-1261
[21] Joanne C C, Roderick I M, Satoshi K, et al. Fate and transport of antibiotic residues and antibiotic resistance genes following land application of manure waste [J]. Journal of Environmental Quality, 2009, 38: 1086-1108
[22] Kümmerer K, Al A. Biodegradability of some antibiotics, elimination of the genotoxicity and affection of wastewater bacteria in a simple test [J]. Chemosphere, 2000, 40(7): 701-710
[23] Mazel D. Integrons: Agents of bacterial evolution [J]. Nature Reviews Microbiology, 2006, 4(8): 608-620
[24] Snyder L, Champness W. Molecular Genetics of Bacteria [M]. Washington DC: ASM Press, 2007: 117-130
◆
Effect of Temperature on Antibiotic Resistance Genes Behavior During Anaerobic Treatment of Sludge
Qian Yanyun, Zheng Ji, Xu Like, Su Chao, Chen Hong*
Department of Environmental Engineering, College of Environmental and Resource Sciences, Zhejiang University, Hangzhou 310058, China
Received 11 October 2015 accepted 3 December 2015
Sewage treatment plant became the important storage depot of antibiotic resistance genes (ARGs) because of the transfer and spread of ARGs, which may bring the potential risk to human health. In this study, sequencing batch anaerobic digestion is the main experimental method. Operating temperatures of anaerobic condition were 15 ℃ , 30 ℃, 36 ℃, 50 ℃ and 60 ℃. In the process, liquid chromatography-electrospray tandem mass spectrometry (LC-MS/MS) was taken to analyze 8 kinds of antibiotics concentrations in the sludge samples. The abundances of tetracycline resistance genes (tetA, tetG, tetL, tetM, tetO, tetQ, tetW, tetX), sulfonamide resistance genes (sulI, sulII) and class 1 integron (intI1) were quantified by real-time polymerase chain reaction. The results showed that the degradation rate of antibiotics increased as the temperature increased. The average removal rates of total antibiotics under 15 ℃, mesophilic condition (30 ℃, 36 ℃) and thermophilic condition (50 ℃, 60 ℃) were 45%, 59% and 78%, respectively. The reductions of total tet genes under 15 ℃, mesophilic condition and thermophilic condition were 0.52 log, 0.90 log and 1.50 log, while for sul genes the reductions were 0.56 log, 0.78 log and 1.31 log, respectively. Correlation analysis showed, total resistance genes had positive correlations with TN, NH3-N and SCOD (R2=0.744, 0.760 and 0.315, P<0.05), while they had no correlations with TP (P>0.05). intI1 had positive correlations with TN, NH3-N and SCOD (R2=0.698, 0.795 and 0.269, P<0.05), while they had no correlations with TP (P>0.05). Nutrient elements in environment influenced the transfer and spread of ARGs in a degree.
antibiotics; antibiotic resistance genes; anaerobic; temperature; sequencing batch
国家重大水专项(2014ZX07101-012);国家自然科学基金项目(21277117)
钱燕云(1990-),女,硕士研究生,研究方向为污染控制及资源化技术,E-mail: aileen@zju.edu.cn;
*通讯作者(Corresponding author), E-mail: chen_hong@zju.edu.cn
10.7524/AJE.1673-5897. 20151011001
2015-10-11录用日期:2015-12-03
1673-5897(2015)5-056-10
X171.5
A
陈红(1969—),女,博士,教授,主要研究方向为污染控制及资源化技术和环境生物技术。
钱燕云, 郑吉, 徐莉柯, 等. 温度对厌氧环境下污泥中抗生素抗性基因行为特征的影响[J]. 生态毒理学报,2015, 10(5): 56-65
Qian Y Y, Zheng J, Xu L K, et al. Effect of temperature on antibiotic resistance genes behavior during anaerobic treatment of sludge [J]. Asian Journal of Ecotoxicology, 2015, 10(5): 56-65 (in Chinese)

