北江流域抗生素污染水平和来源初探
蒋昊余,张孟迪,周仁钧,杨颖,李军,张畅,邹世春,*,张干,#
1. 中山大学海洋学院,广州 510006 2. 中国科学院广州地球化学研究所,广州 510640 3. 山东百纳瑞分析仪器科技有限公司,济宁 272001
北江流域抗生素污染水平和来源初探
蒋昊余1,2,张孟迪1,周仁钧1,杨颖1,李军2,张畅3,邹世春1,*,张干2,#
1. 中山大学海洋学院,广州 510006 2. 中国科学院广州地球化学研究所,广州 510640 3. 山东百纳瑞分析仪器科技有限公司,济宁 272001
北江是发源于湖南(武水)和江西(浈水),汇于广东韶关,流经广东全境并入海的三大河流之一。为了解整个北江抗生素污染情况,共设置44个采样点,并采集了河水及部分沉积物样品,较全面地分析了各样品中12种典型抗生素含量并初步探究了其污染来源。研究发现,包括北江源头在内的全河段均有抗生素的检出,5类抗生素在表层水和沉积物中的平均浓度分别为77.8 ng·L-1和3.6 ng·g-1。其中,大环内酯类污染最为严重,其含量范围为11.7~114.6 ng·L-1和0~435.3 ng·g-1,远高于其他类抗生素。表层水中磺胺类的磺胺甲恶唑和氯霉素类的检出率达100%,其中以磺胺甲恶唑(14.7 ng·L-1)和阿奇霉素(25.0 ng·L-1)为主,而沉积物中以阿奇霉素(35.9 ng·g-1)、氧氟沙星(5.4 ng·g-1)和四环素(3.3 ng·g-1)为主。由于流域污染源种类和数量不同,各抗生素在北江中的分布也存在差异。表层水中抗生素含量水平表现为下游高于上中游,在沉积物中则主要集中于中、下游之间河段。这反映了人类活动强度对北江抗生素污染的直接影响。
抗生素;北江;表层水;沉积物;来源
抗生素广泛应用于人类和动物的疾病治疗,同时也大量应用于水产养殖和禽畜饲养[1-3]。由于抗生素不能完全被生物体吸收,其中,高达80%~90%的抗生素通过尿液和粪便以母体的形式排放到环境中[4-5]。而且在多种环境样品中均有抗生素检出,包括污水处理厂进水口和出水口,养殖场,地表水,地下水,土壤,沉积物,甚至饮用水[6-8]。
抗生素除直接导致环境中的抗生素化学污染外,更会导致抗生素抗性菌株以及抗生素抗性基因(ARGs)的产生及传播[9],因为抗生素为细菌提供了一个持续性抗性选择压力和维持力。细菌的耐药性增强,对抗生素的药性降低或完全失效,最终严重危害人类身体健康与环境生态安全。
北江是珠江的第二大水系,其流域范围内工业发达,养殖业兴盛,下游服务于繁华的珠江三角洲地区,人口密集。北江流经区域受人类活动影响,越往下游人口越密集、工业越发达、河流水道众多,抗生素污染越严重,这为抗生素及其抗性基因污染扩散提供了便利条件。目前,对抗生素污染的河流研究多集中在人类活动强度高的区域[10-13],而对人类活动强度变化下整条河流的研究少见报道。本文以北江为研究对象,从北江源头,经韶关、清远、佛山和广州南沙等珠江三角洲区域直至南海入海口,共采集了44个表层河流水样和中下游段23个沉积物样品,探究了北江全河段流域抗生素污染特征和来源,在人类活动强度变化影响下的抗生素分布情况,并在一定程度上反应了整个珠江流域的污染状况。
1 材料与方法 (Materials and methods)
1.1 仪器与试剂
CNW固相萃取装置(上海安谱科学仪器有限公司)、沙芯溶液过滤器(T-50,天津津腾仪器公司)、QL-901快速混匀器(江苏海门麒麟医用仪器厂)、SPNB-15型氮吹仪(广州安能特仪器公司)、旋转蒸发仪(Hei-VAP,Heidolph,Germany)、全自动高速冷冻离心机(Eppendorf Centrifuge 5804R,Germany);HPLC-MS/MS三重四级杆液-质联用仪(TSQ Quantum Ultra,USA)、色谱柱(Thermo Hypersil GOLD Dim (mm),100 mm×2.1 mm,1.9 μm);HPLC-MS/MS三重四级杆液-质联用仪(Agilent 1260,USA-AB SCIEX TRIPLE QUAD 4500,USA)、色谱柱(Agilent Eclipse Plus C18 3.0 mm× 150 mm,3.5 μm)、保护柱(Agilent Poroshell 120 EC-C18 3.0 mm× 5 mm,2.7 μm)。
氢氧化钠(分析纯,广州化学试剂厂)、乙醇和甲醇(色谱纯,Oceanpak alexative chemical公司,瑞典);12种抗生素(Dr. Ehrenstorfer公司,德国)、氧氟沙星(TCI公司,日本);13C3-咖啡因(Cambridge Isotope Laboratories,美国)。亲水性改性聚醚砜微孔滤膜:孔径0.22 μm,直径150 mm(Pall公司,美国);Oasis HLB固相萃取小柱(500 mg,6 mL,WATERS,USA,填料为N-乙烯基吡啶烷酮和二乙烯苯共聚物),CNWBOND SAX强阴离子交换柱(500 mg,6 mL,德国CNW科技公司),HPLC-MS/MS系统所用试剂均为色谱纯,甲醇(Xingmake公司,德国)。整个实验过程所用水均为超纯水(美国milli-pore公司Mill-Q 超纯水制备)。
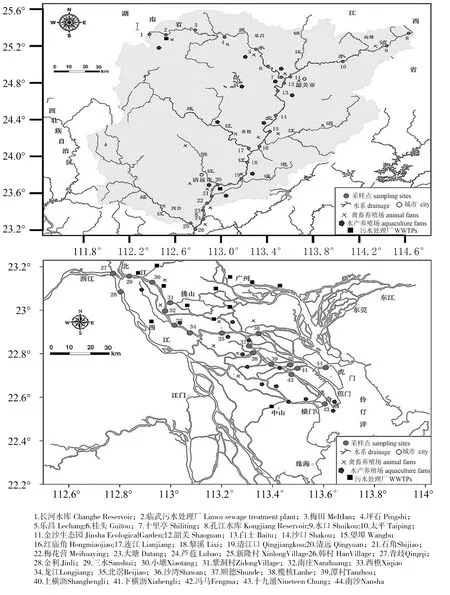
图1 北江全河段采样点分布
1.2 样品采集与处理
样品采集:所有样品分别于2013年3月和6月从北江源头长河水库与孔江水库开始采集,经韶关、清远、佛山和广州,至珠江口南沙岛,共设44个采样点(图1)。根据污染源分布情况,将北江流域分为上、中、下游三段区域。其中,上游段为自韶关以上的水域(#1~12),中游段为韶关至韩村(#13~26),下游段为青岐以下至南沙(#27~44)。上游和中游一带均以禽畜养殖为主,下游则以水产养殖和城市污染排放为主,污染源数量总体分布为上、下游高于中游。每个采样点采集不少于1.5 L的表层水样品,样品于-4 ℃保存并尽快用0.22 μm滤膜进行过滤处理。沉积物样品共采集24份,由于上游河底多为硬质岩石或砂砾,因此沉积物样品采集仅在上游源头长河水库及下游河段。采样过程使用抓斗采集表层沉积物样品,混匀后,取约400 g沉积物样品于PE密封袋,置于冰盒保存,运回后放-20 ℃冰箱保存,尽快分析处理。
水样处理[14]:将1 L经过滤的水样加入100 ng(100 μL×1 mg·mL-1)回收率指示物(13C3-咖啡因)。使用HLB固相萃取小柱直接进行富集、净化及洗脱,最后将洗脱液用0.22 μm针头式过滤器进行过滤并转移至1.5 mL棕色的进样瓶中,保存于-20 ℃待HPLC-MS/MS测定。
沉积物样品处理[15-16]:将沉积物进行冷冻干燥,研磨过60目筛后,准确称取4.00 g样品置于30 mL玻璃离心管中,加入10 mL萃取缓冲液(含1 mmol·L-1Na2EDTA的0.1 mol·L-1柠檬酸缓冲液(pH=3)与甲醇1:1混合)和100 ng的13C3-咖啡因于样品中,涡旋混匀1 min,然后再加入10 mL萃取缓冲液,常温下超声15 min,在3 500 r·min-1转离心3 min,转移上清液于250 mL平底烧瓶;残留物继续重复提取4次,将上清液合并至同一平底烧瓶中,旋转蒸发(旋蒸温度低于50 ℃),加入超纯水稀释至200 mL。向烧瓶中加入1 mL Na2EDTA溶液(0.2 g·mL-1),以消除金属离子干扰。同时加入50 ng目标化合物(n=3)进行加标测回收率试验。接着使用SAX柱和HLB柱串接进行富集和进化,转移到1.5 mL棕色进样瓶中后,氮吹至近干,再用50%的甲醇定容到200 μL,14 000 r·min-1离心10 min,轻轻转移上清液至进样瓶内套管中,尽快进行HPLC-MS/MS分析。
1.3 仪器分析
利用HPLC-MS/MS仪器进行检测,使用的色谱柱为Thermo Hypersil GOLD Dim,100 mm×2.1 mm,1.9 μm高效液相色谱柱。流动相A为甲醇溶液,流动相B为体积百分比为0.1%的甲酸溶液;流速为300 μL·min-1;进样量为10 μL。采用梯度洗脱进行分离,每个梯度完成后平衡时间为10 min。选择电喷雾离子源(ESI),正离子扫描模式;毛细温度300 ℃,电喷雾温度400 ℃;电喷雾电压为3 200 V;鞘气压力为35 ARB,离子吹扫气压力为0 ARB;辅助气阀流速8.00 ARB;鞘气和辅助气均为氩气;检测方式为多反应选择监测(MRM)离子模式。
1.4 质量保证与控制(QA/QC)
水样处理过程中加入一个溶剂空白和过程空白,避免背景污染。同时,配置一系列浓度范围在5~100 ng·g-1的混合标准溶液进行测定,选择定量离子质谱信号响应值对浓度作图,得到10种抗生素的标准曲线。仪器在此范围内线性良好,相关系数大于0.99。样品中13C3-咖啡因的回收率均在72.9%以上,能够满足检测要求。由于河水基质相对简单,因此以信噪比S/N≥3时的各抗生素的浓度作为定量测定限,相对偏差在5%以内。
河流沉积物的加标回收率较低,约66.1%左右,因此本研究使用外标法加标回收率检验。取3个平行样品,经过至少5次回收率测定,获得各个抗生素的平均回收率,实际样品测量浓度可根据平均回收率进行适当校正。由于沉积物基质比较复杂,以信噪比S/N≥3时各抗生素的浓度作为定性检测限,以S/N≥10时的浓度作为定量限。根据称样量,浓缩因子为20,计算出抗生素在沉积物中的方法定量检测限为0.002~0.0265 ng·g-1。配置一系列浓度范围在0~200 ng·g-1的混合标准溶液进行测定,选择一对响应值高的离子对作为定量离子。使用外标法定量,选择定量离子质谱信号响应值对浓度作图,得到11种抗生素的外标曲线。11种抗生素在0.5~200 ng·g-1的范围内线性良好,相关系数大于0.99。
2 结果与讨论(Result and discussion)
2.1 北江河水各类抗生素总体分布
北江表层水和沉积物中各类抗生素主要分布情况如图2所示。由图可见,5类共计12种抗生素在北江流域都有不同程度的检出。表层水和沉积物中总抗生素平均浓度分别为77.8 ng·L-1和3.6 ng·g-1。总体上看,表层水中抗生素下游含量高于中上游,含量总体水平随河流流向从上游向中下游逐步增高(图2a)。这与下游区域城镇工业区较为集中,城市和人口激增,药物使用和排放增加有关。然而,沉积物中抗生素的浓度高值却相对集中在中下游交汇段(图2b和图2c)。该情况与抗生素的环境行为有关,吸附性较强的抗生素如氧氟沙星、阿奇霉素和四环素等可通过河流悬浮物吸附并沉降。作为北江水源的长河水库和孔江水库,尽管受到一定程度的保护,但仍可检测到少量抗生素,这可能与周边村民的活动及地表径流有关。另外,广东三大河流之一的西江在佛山三水与北江汇合,青岐(#27)和金利(#28)属于西江中下游,其污染情况一定程度上可反映西江的抗生素污染情况,它们和连江支流(#17)、北江中游与北江的下游段相比,其污染情况皆与北江相似,但总值偏低。
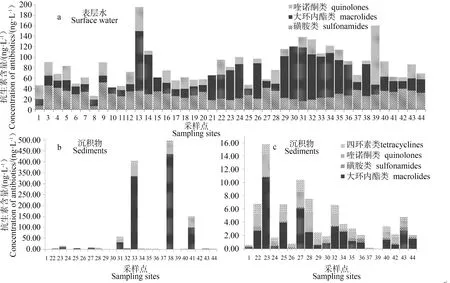
图2 各类抗生素分布示意图
表层水中,磺胺类、喹诺酮类和大环内酯类3类药物含量范围分别为6.7~41.5 ng·L-1,0~113.1 ng·L-1和11.7~114.6 ng·L-1。而在沉积物中,上述3类药物和四环素的含量范围则分别为0~1.3 ng·g-1,0~47.1 ng·g-1,0~435.3 ng·g-1和0~22.8 ng·g-1。虽然喹诺酮类药物的分配系数Kd明显高于其他3类化合物[16],但是喹诺酮类药物在沉积物中的浓度却偏低,说明在这几类药物当中,人类活动使用大环内酯类药物更为频繁,导致环境中大量残留。
表层水抗生素浓度检出最高的是#13和#39,经分析可能受#13附近的韶关,#39上游附近的佛山和广州城市未经处理的直排污水污染,沿途的点源污染和北江的水流动力因素等综合影响,抗生素在迁移过程中在此处达到最高值。下游含量最高的采样点集中在#29~#35之间,由图1可见,这些采样点紧邻佛山,污水处理厂分布较多,因此,可认为污水处理厂是北江下游的主要污染贡献源。北江的中下游中,大部分采样点的沉积物抗生素总含量都低于16 ng·g-1,但#31、#33、#38和#41等4个采样点的抗生素浓度较高,这与它们附近均有较大污染源有关。例如,#41、#33附近分布有医院和化工厂,而#38和#31采样点分别紧邻水产养殖场和生猪养殖场,表明点源污染可直接影响周边河流环境。然而,这4个采样点在表层水样品中浓度却未见明显升高,这与阿奇霉素本身的强吸附特性有关,且这些采样点所处地理位置位于主流和支流的交汇处,河流的弯道处或河道狭窄处,更有利于抗生素在沉积物中沉降富集。
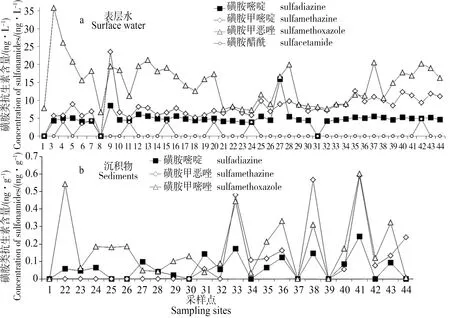
图3 磺胺类抗生素分布
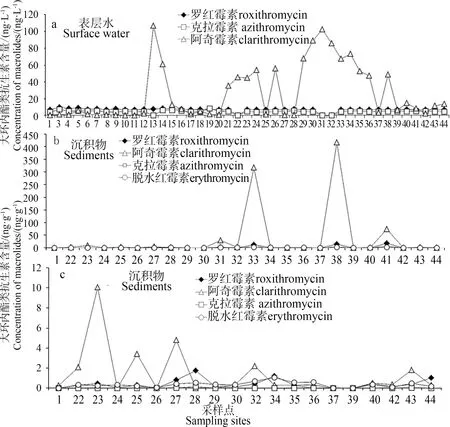
图4 大环内酯类抗生素分布
2.2 磺胺类抗生素分布
磺胺类抗生素是应用较早的一类人工合成广谱抗菌药物,具有对氨基苯磺胺结构,其稳定性强,价格低廉,所以不仅用于人类疾病治疗,更大量用于家畜、家禽和水产养殖疾病预防和饲料添加剂。由于磺胺类药物性质相对稳定,亲水性强,极易通过排泄和雨水冲刷等方式进入到水环境中,沉积物中含量低。从图3可以看出,表层水磺胺类药物总含量在7.8~51.5 ng·L-1范围之间,其中,以磺胺甲恶唑平均含量为最高(14.7 ng·L-1),检出率达100%,说明该药物在表层水污染最为广泛。相对而言,沉积物中磺胺类抗生素含量则较低,检出率也不高。
总体来看,表层水中,磺胺类中下游浓度略高但变化不大。个别采样点浓度略高,可能与邻近的直接污染源有关。例如,位于上游的梅田(#3)、坪石(#4)和水口(#9)等城镇区域有一些野猪和荷兰鼠养殖场。由于磺胺类抗生素的土壤水分配系数Kd低,水溶性良好,因此在表层土壤的吸附能力很弱,在北江中下游沉积物中的浓度很低[17],多数采样点未检出。
2.3 大环内酯类抗生素分布
图4为各采样点4种大环内酯类抗生素的分布情况,虽然大环内酯类抗生素多为碱性亲脂性化合物,水溶性小,但是在北江河水中仍能大量检出(11.7~114.6 ng·L-1)。由图4可见,它们在中下游含量水平明显高于上游,与人口密度和人类活动关系最为密切。在4种大环内酯类药物中以吸附特性最强的阿奇霉素(Kd=4.02)为主(表层水0.5~106.8 ng·L-1,沉积物0~415.5 ng·g-1),不同河段其浓度变化较大,且以点污染源为主。沉积物中除个别附近有水产和禽畜养殖场的#31、#33、#38和#41采样点含量不少于29.0 ng·g-1,其余采样点均低于10 ng·g-1(图4c)。
表层水中罗红霉素与克拉霉素分布变化不大,含量水平大多低于10 ng·L-1。相较以往北江河水中罗红霉素的含量水平[14],此次检测结果相对较低,可能是因为本次采样处于丰水期。沉积物中,罗红霉素、阿奇霉素、脱水红霉素和克拉霉素的检出率分别为83.3%、75.0%、87.5%和33.3%。
2.4 喹诺酮类抗生素分布
氧氟沙星和诺氟沙星为喹诺酮类最主要的用药,二者在北江流域的检出率均较高,在表层水和沉积物中的浓度范围分别为25.5~101.3 ng·L-1及0~44.0 ng·g-1。
表层水中,除附近有制药厂的潭村(#39)检出氧氟沙星浓度较高(101.3 ng·L-1),其余采样点氧氟沙星均在27.6 ng·L-1以下;诺氟沙星分布较为平均,除太平(#10)、望埠(#15)和石角(#21)3个采样点未检出喹诺酮类药物之外,其余各采样点总含量在3.5~45.8 ng·L-1之间。相比而言,由于沉积物、悬浮物等颗粒物质对喹诺酮类药物具有强吸附并促进其降解的特性,因此,在沉积物样品中,除#31、#33、#38和#41采样点受明显点源污染外,其余地方分布较均匀,且浓度均低于3.0 ng·g-1。
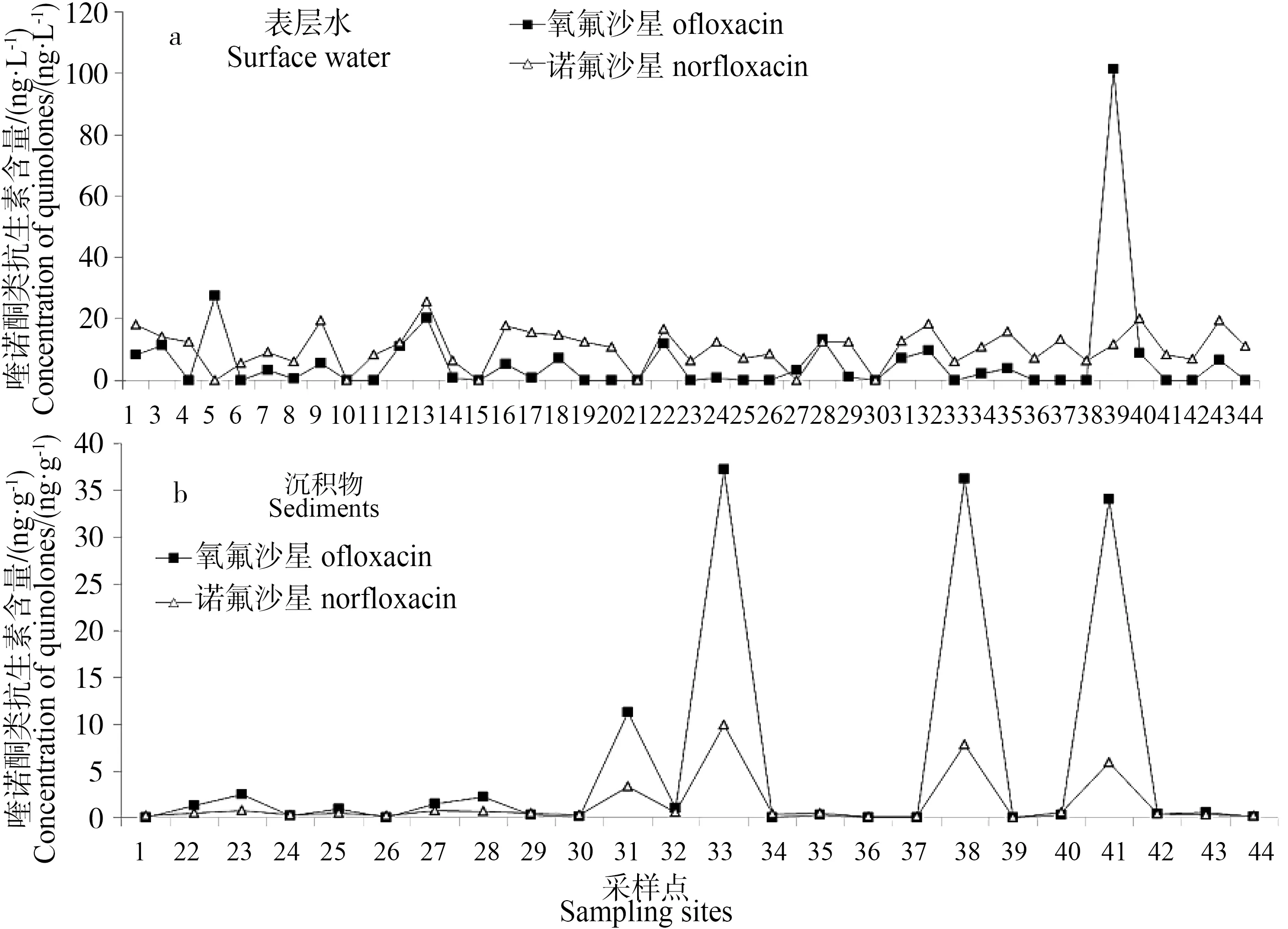
图5 喹诺酮类抗生素分布图
2.5 氯霉素和四环素抗生素分布情况
虽然我国在2002年就禁止了氯霉素作为食用动物用药,但在北江流域中其检出率仍高达100%(图6),但含量相对较低,约在2.4~3.8 ng·L-1范围内。环境中氯霉素的普遍检出的原因,可能源于其残留,或者目前在养殖业中仍存在少量非法使用的情况。从图6可看出,上游氯霉素略高于中下游,可能是因为上游径流量小,人口分布较为集中,禽畜养殖场密集,而下游河流水道错综复杂,稀释作用较为明显所致。
由于四环素类化合物与土壤颗粒和土壤有机质都有很强的吸附作用力,且在水体中易光解[18],因此其环境归趋主要是在土壤和河流沉积物残留。本研究中,四环素在北江沉积物中浓度较高(最高达22.8 ng·g-1),检出率也高达95.8%。由图6可见,北江下游四环素含量很高,#31、#33、#38和#41附近广泛分布的水产养殖业,为河流环境中四环素主要的贡献源。
2.6 污水处理厂各类抗生素
除沿北江采集的43个河流采样点外,我们也采集了位于上游的临武污水处理厂出水口样品(#2)。从图7可见,该样品除磺胺类和大环内酯类外,各抗生素浓度值远高于其他采样点。说明污水排放作为污染点源对抗生素的排放和分布有着重大影响。与北江水环境情况不同,喹诺酮类抗生素是污水处理厂的主要污染物,这一方面说明喹诺酮类抗生素难以降解。另一方面,由于样品采集于出水口,结果远低于其他研究中污水处理厂入水口的含量[19],这表明污水处理厂工艺如活性污泥法[20- 21]等,对部分抗生素的去除有一定效果,但对喹诺酮类抗生素去除效率较低[21]。而且,经污水处理厂处理过后的磺胺类和大环内酯类抗生素浓度仍低于北江水的这2种抗生素平均浓度,显示出人类活动强度造成的点污染源污染是影响抗生素在环境中分布的主要原因。
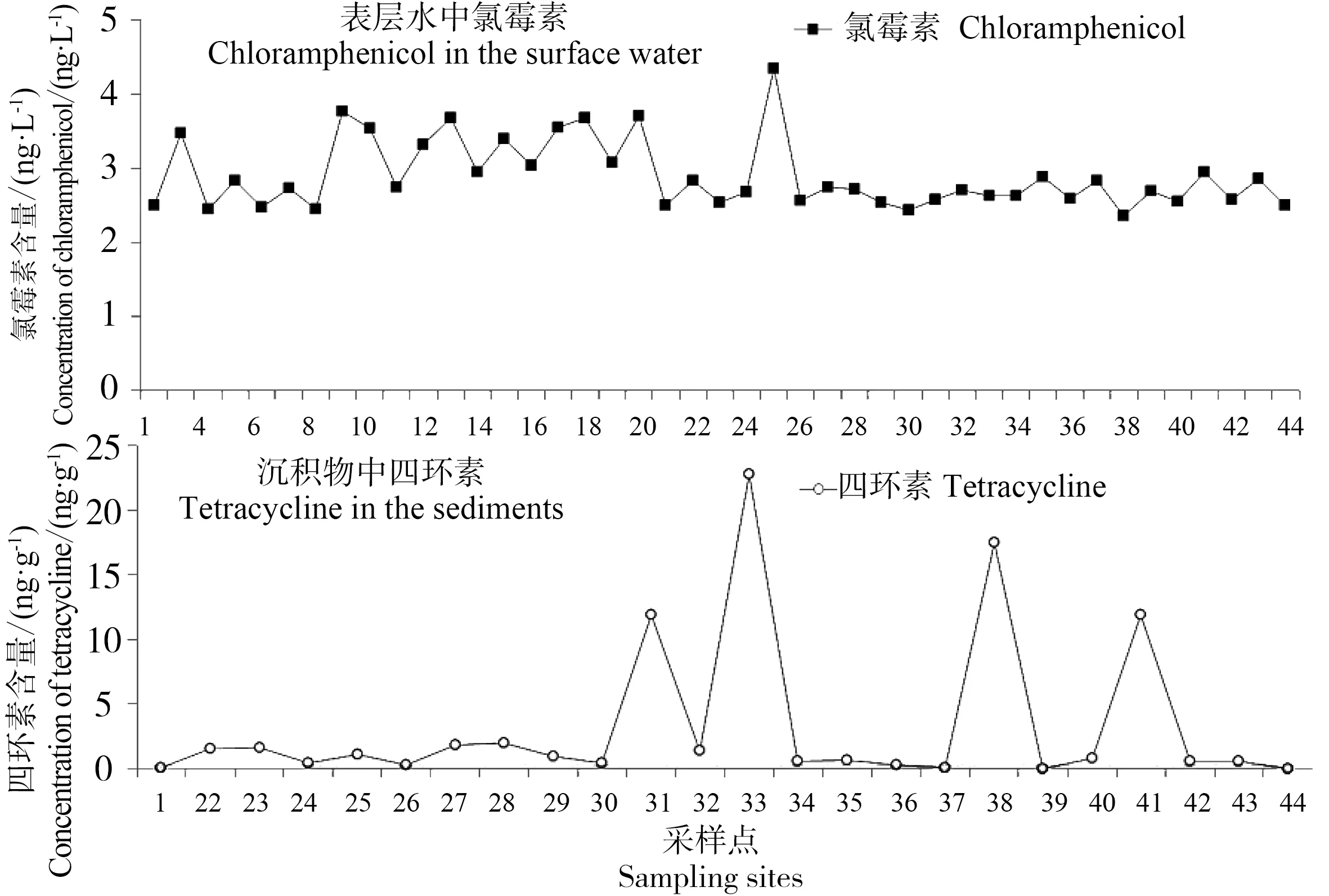
图6 氯霉素和四环素分布
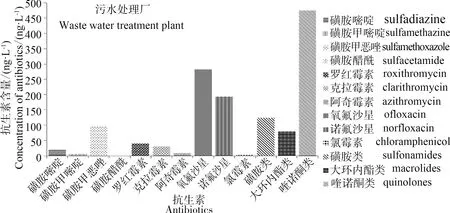
图7 污水处理厂抗生素检出情况
致谢:感谢广东省佛山南海出入境检验检疫局邹永德博士团队在抗生素测定中给予的帮助。
[1] Andersson D I, Hughes D. Antibiotic resistance and its cost: Is it possible to reverse resistance? [J]. Nature Reviews Microbiology, 2010, 8(4): 260-271
[2] D'Costa V M, King C E, Kalan L, et al. Antibiotic resistance is ancient [J]. Nature, 2011, 477(7365): 457-461
[3] Xu W H, Zhang G, Li X D, et al. Occurrence and elimination of antibiotics at four sewage treatment plants in the Pearl River Delta (PRD), South China [J]. Water Research, 2007, 41(19): 4526-4534
[4] Kuemmerer K. Antibiotics in the aquatic environment - A review - Part I [J]. Chemosphere, 2009, 75(4): 417-434
[5] Kuemmerer K. Antibiotics in the aquatic environment - A review - Part II [J]. Chemosphere, 2009, 75(4): 435-441
[6] Dalsgaard I, Bjerregaard J. Enrofloxacin as an antibiotic in fish [J]. Israel Journal of Entomology, 1991, 87: 300-302
[7] Batt A L, Aga D S. Simultaneous analysis of multiple classes of antibiotics by ion trap LC/MS/MS for assessing surface water and groundwater contamination [J]. Analytical Chemistry, 2005, 77(9): 2940-2947
[8] Yiruhan, Wang Q J, Mo C H, et al. Determination of four fluoroquinolone antibiotics in tap water in Guangzhou and Macao [J]. Environmental Pollution, 2010, 158(7): 2350-2358
[9] Davies J, Davies D. Origins and evolution of antibiotic resistance [J]. Microbiology and Molecular Biology Reviews, 2010, 74(3): 417-433
[10] Wang M, Shen Y U, Hong Y W, et al. Residual characterization of multi-categorized antibiotics in five typical aquaculture waters [J]. Ecology and Environmental Sciences, 2011, 20(5): 934-939
[11] 秦延文, 张雷, 时瑶, 等. 大辽河表层水体典型抗生素污染特征与生态风险评价[J]. 环境科学研究, 2015, 28(3): 361-368
Qin Y W, Zhang L, Shi Y, et al. Contamination characteristics and ecological risk assessment of typical antibiotics in surface water of the Daliao River, China [J]. Research of Environmental Sciences, 2015, 28(3): 361-368 (in Chinese)
[12] Wang Q J, Liu H, Mo C H, et al. The concentration characteristics of fluoroquinolone antibiotics in the aquatic environment of Guangzhou [J]. Ecologic Science, 2009, 28(3): 276-280
[13] Zhang R J, Tang J H, Li J, et al. Occurrence and risks of antibiotics in the coastal aquatic environment of the Yellow Sea, North China [J]. Science of the Total Environment, 2013, 450: 197-204
[14] 林殷. 水中典型抗生素测定及其在黄河和北江河段的污染现状研究[D]. 广州: 中山大学, 2008: 25-34
Lin Y. Concentrations and distribution of several selected antibiotics in water environments [D]. Guangzhou: Sun yat-sen University, 2008: 25-34 (in Chinese)
[15] 张瑞杰. 黄渤海区域及东江流域环境中典型抗生素污染研究[D]. 广州: 中国科学院广州地化所, 2011: 31-35
Zhang R J. Selected antibiotics in North China coastal zones and Dongjiang River catchment [D]. Guangzhou: Guangzhou Institute of Geochemistry, CAS, 2011: 31-35 (in Chinese)
[16] 徐维海. 典型抗生素类药物在珠江三角洲水环境中的分布、行为与归宿[D]. 广州: 中国科学院广州地化所, 2007: 97-102
Xu W H. Occurrence and envrironmental fate of selected antibiotics in the aquatic environment of the Pearl River Delta [D]. Guangzhou: Guangzhou Institute of Geochemistry, CAS, 2007: 97-102 (in Chinese)
[17] Thiele S. Adsorption of the antibiotic pharmaceutical compound sulfapyridine by a long-term differently fertilized loess Chernozem [J]. Journal of Plant Nutrition and Soil Science-Zeitschrift Fur Pflanzenernahrung Und Bodenkunde, 2000, 163(6): 589-594
[18] 李华. 水体中四环素类抗生素的光化学行为研究[D]. 武汉: 华中科技大学, 2011: 7-41
Li H. Photochemical behavior of tetracyclines in aquatic system [D]. Wuhan: Huazhong University of Science and Technology, 2011: 7-41 (in Chinese)
[19] Rodriguez M S, Chamorro S, Marti E, et al. Occurrence of antibiotics and antibiotic resistance genes in hospital and urban wastewaters and their impact on the receiving river [J]. Water Research, 2015, 69: 234-242
[20] Carvalho P N, Pirra A, Basto M C P, et al. Activated sludge systems removal efficiency of veterinary pharmaceuticals from slaughterhouse wastewater [J]. Environmental Science and Pollution Research, 2013, 20(12): 8790-8800
[21] Xu J, Xu Y, Wang H M, et al. Occurrence of antibiotics and antibiotic resistance genes in a sewage treatment plant and its effluent-receiving river [J]. Chemosphere, 2015, 119: 1379-1385
◆
Occurrence and Potential Sources of Antibiotics in Beijiang River, Southern China
Jiang Haoyu1,2, Zhang Mengdi1, Zhou Renjun1, Yang Ying1, Li Jun2, Zhang Chang3, Zou Shichun1,*, Zhang Gan2,#
1. School of Marine Sciences, Sun Yat-sen University, Guangzhou 510006, China 2. Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China 3. Shandong Bonaray Analytical Instrument and Technology Co., Ltd., Jining 272000, China
Received 31 May 2015 accepted 25 August 2015
The Beijiang River is one of the three major rivers which flow across the Pearl River Delta Region, southern China. It serves one of the most densely urbanized regions in China and was heavily impacted by agricultures and aquacultures in recent 30 years. As emerging pollutants, there are less complete database on antibiotics and their pollution sources in the river environments. To gain insight into the occurrences, distributions and possible sources of antibiotics in the whole Beijiang River, 44 water samples and 23 sediment samples were collected along the river from source to estuary. Total 12 common antibiotics including 4 sulfonamides (sulfadiazine, sulfamethazine, sulfamethoxazole and sulfacetamide), 2 quinolones (norfloxacin and ofloxacin), 4 macrolides (roxithromycin, erythromycin, azithromycin and clarithromycin), chloramphenicol and tetracycline were investigated in these samples. The selected compounds in the samples were pretreated using solid phase extraction (SPE) followed by the determinations of high performance liquid chromatography-tandem electrospray ionization mass spectrometer (HPLC-MS/MS). The results showed that most of the antibiotics could be detected in all the samples including those from headwater areas less impacted by human activities indicating that the antibiotics were ubiquitous in the environments of the Beijiang River. The average concentrations of all antibiotics were 77.8 ng·L-1in the surface water and 3.6 ng·g-1in the sediments, respectively. The macrolides were the dominant pollutants with their concentration ranging from 11.7 to 114.6 ng·L-1in the surface water and 0~22.8 ng·g-1in the sediments, followed by quinolones (0~113.1 ng·L-1, 0~47.1 ng·g-1) and sulfonamides (6.7~41.5 ng·L-1, 0~1.3 ng·g-1). Generally, there were higher levels of antibiotics detected in the water samples adjacent to downstream and in the sediment samples between mid- and downstream than those in the upstream river. The total concentrations of most of the sediment samples were below 16 ng·g-1excluding several sites close to obvious pollution sources such as hospital, intensive feeding swine farm and aquaculture ponds. Moreover, some antibiotics like sulfamethoxazole and chloramphenicol could be frequently detected in all the water samples, though the uses of chloramphenicol have been limited for many years due to its adverse effects. It could be considered to be related to the illegal uses in livestock breeding. Furthermore, sulfamethoxazole (14.7 ng·L-1) and azithromycin (25.0 ng·L-1) were predominant in the surface water, and azithromycin (35.9 ng·g-1), ofloxacin (5.5 ng·g-1) and tetracycline (3.3 ng·g-1) in the sediment samples depending on their differences in source emissions and physicochemical properties like hydrophobicity and/or absorptivity on the suspend particles. Additionally, the spatial distributions of the target antibiotics could be effected by complex hydrodynamic conditions, locations and dilution effect in the river environments. However, higher levels of antibiotics appeared at most sampling sites adjacent to the big cities such as Shaoguan, Qingyuan, Foshan and Guangzhou. The emissions from waste water treatment plant (WWTP), and other complex human activities highlighted the anthropogenic impacts on the dissemination of antibiotics in the river environments.
antibiotics; Beijiang River; water; sediments; sources
国家自然科学基金项目(批准号21177162);广东省海洋渔业科技推广专项(A201301D01)
蒋昊余(1988—),女,博士研究生,研究方向为抗生素抗性基因污染及其形成机制,E-mail: sysu.leavefish@gmail.com
*通讯作者(Corresponding author), E-mail: ceszsc@mail.sysu.edu.cn
(Co-corresponding author), E-mail: zhanggan@gig.ac.cn
10.7524/AJE.1673-5897.20150531001
2015-05-31录用日期:2015-08-25
1673-5897(2015)5-132-08
X171.5
A
邹世春(1965—),男,环境分析化学博士,教授,主要研究方向环境分析化学、环境污染与控制研究及仪器研发,发表学术论文60余篇。
张干(1967—),男,环境有机地球化学博士,研究员,主要研究方向毒害污染物的区域地球化学过程、控制原理和技术,发表学术论文230余篇。
# 共同
蒋昊余, 张孟迪, 周仁钧, 等. 北江流域抗生素污染水平和来源初探[J]. 生态毒理学报,2015, 10(5): 132-140
Jiang H Y, Zhang M D, Zhou R J, et al. Occurrence and potential sources of antibiotics in Beijiang River, Southern China [J]. Asian Journal of Ecotoxicology, 2015, 10(5): 132-140 (in Chinese)

