超声辅助酶法去抗原处理猪异种骨的实验研究*
田家亮,简月奎,李建扬
(贵州省人民医院骨科,贵阳550001)
骨缺损是骨外科手术中经常遇到的难题,自体骨移植具有取材有限、取材部位易发生并发症的缺点。异体骨移植来源受限,且有传播疾病的风险。因此,近年来,异种骨移植成为了研究热点,但由于异种骨具有抗原性,移植后可能产生较强的免疫反应,因此在使用前需要进行去抗原处理。在异种骨中的除抗原处理中,酶法脱蛋白处理已经成为近来研究的热点,胰蛋白酶是一种非特异性消化酶,可以消化异种骨表面的包括MHC-Ⅰ、MHC-Ⅱ抗原在内的异种骨抗原[1],相对于强氧化剂,酶的水解过程温和,不会对骨中无机成分的结构造成破坏[2]。传统的胰蛋白酶水解蛋白需要12h或更长的作用时间,近年来研究发现,超声波能在一定条件下增加胰蛋白酶的活性,增加其水解蛋白的速度[3]。可以将胰蛋白酶水解蛋白的作用时间缩短至数分钟,而且其分解较为完全。本研究采用超声波辅助胰蛋白酶的方法对猪异种骨去抗原处理,探讨其的影响。
1 材料与方法
1.1 实验设备 超声波细胞破碎仪(美国),超临界CO2流体设备 (德 阳 ),JSM-5900 型 扫 描 电 子 显 微 镜 (日 本 ),INSTRON8874生物力学测试系统 (美国)。
1.2 实验动物 近交系内江猪一头,雄性,8月龄。无菌条件下取股骨干骺端带皮质松质骨,制成0.5cm×0.5cm×0.5 cm大小颗粒骨,去除周围软组织及骨膜。
1.3 实验方法 根据骨材料处理方法的不同,分成4组。A组:超临界脱脂+深低温冷冻+超声辅助酶法。蒸馏水反复冲洗骨及髓腔内物质;用超临界CO2(16~18kg/h的CO2流动率,压力为25MPa,温度为50℃,时间为骨的10g/min)脱脂[4-6];双 蒸 水 冲 洗 12h;-80 ℃ 深 低 温 冷 冻 保 存 1 个月,-20℃、4℃梯度复温;37℃,pH值为8条件下,超声波辐照(功率1 200kW)下0.25%胰蛋白酶消化30min(超声波每工作30s,停止工作10s)[3-4]。B组:超临界脱脂+深低温冷冻+超声脱细胞。C组:超临界脱脂+深低温冷冻+胰蛋白酶。D组:新鲜骨;无菌生理盐水反复冲洗骨及髓腔内物质;无菌湿纱布包裹,放置-20℃冰箱中备用。A、B、C组标本处理完成后,真空低温冷冻干燥机冻干,真空包装袋密封,25kGy的Co60辐射消毒备用。
1.4 检测指标
1.4.1 材料的大体标本观察及切片组织形态学观察 肉眼观察所制备的各组异种骨移植材料的形貌特征和结构,并将材料用LEICA2500E型切片机制成5μm厚的硬组织切片,HE染色观察材料处理后骨组织学形态。
1.4.2 各组骨材料异种抗原的检测 分别检测各组骨材料a-Gal抗原、MHC-Ⅰ和 MHC-Ⅱ抗原的表达,细胞核苏木素复染,DAB显色,光镜下观察不同处理组a-Gal抗原、MHC-Ⅰ和MHC-Ⅱ抗原分布及强弱情况变化。
1.4.3 扫描电镜观察各组骨材料孔径大小和孔径率 用JSM-5900型电子显微镜对上述制备的材料进行扫描电镜观察,每种材料4个样品,并用JSM-5900型数字图像分析系统对其孔径大小和孔隙率进行测定,加速电压20kV。
1.4.4 材料的力学性能测定 INSTRON8874生物力学测试系统对所制备的各组材料分别进行轴向压缩。常温常压下,压缩实验加载速度0.5mm/min,应力下降25%~70%停止加载,函数记录仪记录载荷-变形曲线。
1.5 统计学处理 采用SPSS13.0统计软件分析数据,计量资料采用x±s表示,各组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 材料的大体标本及组织形态学观察
2.1.1 材料的大体标本比较 A组:骨材料呈白色,微孔壁光滑,具有天然骨的三维结构。B组:骨材料呈淡黄色,微孔壁欠光滑;C组:骨材料呈淡黄色,微孔壁光滑。D组:含有大量血细胞和脂肪组织,微孔壁大部分被血细胞和脂肪组织充填。
2.1.2 材料的组织形态学比较 A组:骨组织中骨小梁结构连续完整,骨陷窝和Harversian管周围无细胞存留。B组:骨陷窝和Harversian管周围仍可见较多细胞存留,细胞核蓝染。C组:骨陷窝和Harversian管周围可见少量细胞存留。D组:骨陷窝和Harversian管周围可见大量细胞存留。见图1。
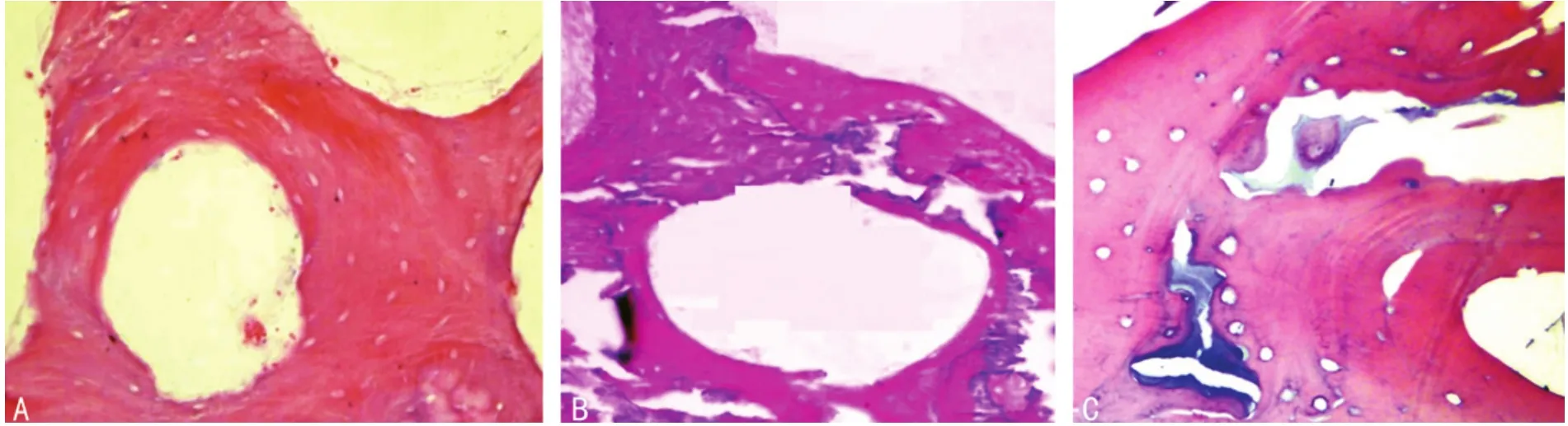
图1 各组形态学(HE×200)
2.2 扫描电镜观察 扫描电镜观察发现经处理后的各组材料均具有多孔的三维骨结构,新鲜骨孔隙被大量血细胞和脂肪组织所覆盖。各组间孔径大小比较差异有统计学意义(P<0.05)。各组孔隙率比较,从大到小顺序为A组、C组、B组、D组,A、C组相似(P>0.05),其余各组差异有统计学意义(P<0.05)。见表1。
2.3 免疫组织化学检测各组a-Gal抗原、MHC-Ⅰ和 MHC-Ⅱ抗原 A组无抗原阳性表达。B组骨细胞表面可见a-Gal抗原、MHC-Ⅰ和MHC-Ⅱ抗原的阳性表达,骨细胞、成骨细胞表面和Harversian管周围褐色的颗粒沉积。C组骨细胞表面可见少量a-Gal抗原、MHC-Ⅰ和 MHC-Ⅱ抗原的阳性表达。D组骨细胞表面可见大量a-Gal抗原、MHC-Ⅰ和 MHC-Ⅱ抗原的阳性表达,骨细胞、成骨细胞表面和Harversian管周围褐色的颗粒沉积。见图2。

表1 各组材料处理后的孔隙率和孔径大小(x±s)

图2 各组免疫组织化学检测(×200)
2.4 材料的生物力学性能 最大载荷A组明显小于B、C、D组(P<0.05),C组与B、D组间比较差异有统计学意义(P<0.05),而B、D组间差异无统计学意义(P>0.05)。最大应力A组最小,A组与B组、A组与D组之间最大应力差别明显(P<0.05),其余各组间差异无统计学意义(P>0.05)。弹性模量各组间差异无统计学意义(P>0.05)。见表2。
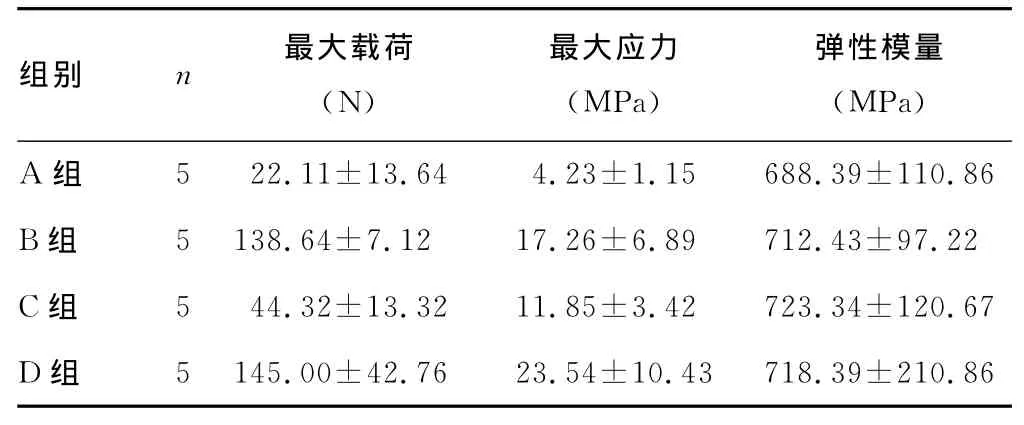
表2 各组材料生物力学性能比较(x±s)
3 讨 论
异种骨作为骨移植材料最大的障碍在于其抗原性,植入体内后可能会引发移植免疫排斥。在异种骨中的除抗原处理中,酸碱法因为破坏材料的生物力学性能,已较少使用,而酶法脱去抗原因为对材料的生物力学性能破坏较小,已经成为近来研究的热点,传统的胰蛋白酶水解蛋白需要12h或更长的作用时间,才能去除材料中的抗原成分,超声波能在一定条件下可以增加胰蛋白酶的活性,增加其水解蛋白的速度[3]。本研究按照Rial-Otero等[7]的方法采用超声波辅助胰蛋白酶消化异种骨蛋白的方法来去除异种骨中的抗原,经过免疫组织化学的方法检测其骨中的抗原,结果表明超临界CO2、深低温冷冻、超声辅助酶消化的异种骨中的抗原已完全被消化,其免疫原性最低,而经超临界CO2、深低温冷冻、超声波或胰蛋白酶处理的异种骨材料抗原性虽明显降低,但仍可检测到异种抗原。
除了免疫原性低以外,经超声辅助酶法处理后的异种骨材料,孔径、孔隙率均比其他组高,与文献报道的植入材料的最佳孔径为100~500μm,孔径相对大,孔隙率高的材料有利于直接成骨一致[8-10]。表明经本法处理的异种骨材料具有更好的成骨传导性。
另外,骨材料的生物力学特性也非常重要,在去抗原过程中,物理和化学的去抗原方法难免会影响到骨的生物力学性能。相对于强氧化剂,酶的水解对骨的生物力学影响小,不会对骨中无机成分的结构造成破坏[11-12]。本研究证实经超临界CO2、深低温冷冻、超声波处理的异种骨和新鲜骨比较,其生物力学性能无显著差异,表明超临界CO2、深低温冷冻、超声波处理对骨的生物力学性能无显著影响,而经超临界CO2、深低温冷冻、胰蛋白酶处理后的异种骨,其生物力学性能显著下降,表明酶处理对异种骨生物材料生物力学性能有显著影响,经超临界CO2、深低温冷冻、超声辅助酶法处理后的异种骨生物力学性能最差,表明超声辅助酶法对异种骨的生物力学性能的影响较大。
本研究结果表明,超声辅助酶法去抗原处理异种骨,可以有效地去除异种中的抗原,但同时材料的生物力学性能有明显的影响,还需要在进一步实验中优化参数,以达到既能去除异种抗原,又能使材料的生物力学性能获得最大的保留的目的,为异种骨的临床应用开辟广阔前景。
[1] Kim BS,Mooney DJ.Development of biocompatible syn-thetic extracellular matrices for tissue engineering[J].Trends Biotechnol,1998,16(5):224-230.
[2] 杨立华,王远亮.脱除异种骨中非胶原蛋白的研究[J].高技术通讯,2005,15(4):41-44.
[3] Opez-Ferrer DL,Capelo JL,Azquez JV,et al.Ultra-fast trypsin digestion of proteins by high intensity focused ultrasound[J].J Proteome Res,2005,4(5):1569-1574.
[4] Fages J,Marty A,Delga C,et al.Use of supercritical CO2 for bone delipidation[J].Biomaterials,1994,15(9):650-656.
[5] Rouquet N.Histological integration of allogeneic cancellous bone tissue treated by supercritical CO2implanted in sheep bone[J].Biomaterials,1998,19(24):2247-2253.
[6] Haimi S,Wahlman M,Mannila M,et al.Pulse-lavage washing is an effective method for defatting of morselized allograft bone in the operating theater[J].Acta Orthop,2008,79(1):94-97.
[7] Rial-Otero R,Carreira RJ,Cordeiro FM,et al.Ultrasonic assisted protein enzymatic digestion for fast protein identification by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry.Sonoreactor versus ultrasonic probe[J].J Chromatogr A,2007,28(2):101-107.
[8] Soicher MA,Christiansen BA.Remineralized bone matrix as a scaffold for bone tissue engineering[J].J Biomed Mater Res A,2014,102(12):4480-4490.
[9]Bakhshalian N,Nowzari H,Ahn KM,et al.Demineralized dentin matrix and bone graft:a review of literature[J].J West Soc Periodontol Periodontal Abstr,2014,62(2):35-38.
[10]Campana V,Milano G,Pagano E,et al.Bone substitutes in orthopaedic surgery:from basic science to clinical practice[J].J Mater Sci Mater Med,2014,25(10):2445-2461.
[11]Matter HP,Garrel TV,Bilderbeek U,et al.Biomechanical examinations of cancellous bone concerning the influence of duration and temperature of cryopreservation[J].J Biomed Mater Res,2001,55(l):40-44.
[12]Kang Q,An YH,Friedman RJ.Effects of multiple freezing-thawing cyeles on ultimate indentation load and stiffness of bovine caneellous bone[J].Am J Vet Re,1997,58(10):1171-1173.

