犬牙移入牵张成骨区龈沟液AST水平动态变化*
凌 宁,王银龙,李 峥
(1.安徽医科大学口腔医学院/安徽医科大学附属口腔医院/安徽省口腔疾病研究中心实验室,合肥230032
;2.安徽省第二人民医院口腔科,合肥230041)
骨组织在受到外界机械力刺激后其会出现再生长与重建过程[1],因此恰当的牵张力广泛应用于牵张成骨、正畸牙移动等临床治疗中。当正畸牙受到外力发生移动时,伴随着牙槽骨的不断改建是一种较为复杂且呈动态改变的生化反应[2],该过程则是急性炎症的表现,那么其外力对牙周组织的靶细胞产生作用后会形成相应的细胞因子,包括组织降解性酶及一些酸性产物等化学物质,这些物质正是导致牙槽骨发生改建的原因[3]。因此一些研究者发现龈沟液中存在大量不同种的化学物质,这些物质则来源于其牙周组织[4],而正畸力是导致龈沟液中天门冬氨酸氨基转移酶(AST)水平改变的因素,包括作用力值及时间[5]。因此,AST动态改变是反映正畸牙周健康状况的重要指标。本文拟研究牙齿移入新骨区后龈沟液内AST水平的变化,以了解牙周组织的改建情况。
1 材料与方法
1.1 实验对象 健康beagle犬8只(由安徽医科大学动物实验中心提供),雌雄各半,犬龄11~19个月,平均(14.9±2.5)个月。牙列中无乳牙,且牙周健康,圈养1周后进行下颌骨牵张成骨术,圈养期间培养进食软食。依据牙齿移入牵张成骨新骨区时分为两组(2周后移动牙齿,6周后移动牙齿),每组4只,每组实验牙均分在1、2、3、7、14、21、28d后进行龈沟液的AST水平分析。纳入及排除标准:每只犬下颌骨第3、4前磨牙之间行下颌骨牵张成骨,将第3前磨牙向远中移入牵张成骨新骨区内。排除犬只牙周呈非健康状态,第3前磨牙无缺损,冠折等。
1.2 牵张器原理 牵张成骨手术中的牵张器根据犬特点自行设计而成,材质为不锈钢,其原理是以牵张器螺旋杆转动带动牵张器滑动部件移动,达到下颌骨牵张成骨的目的。在牵张成骨中牵引的速率与频率直接影响了新骨形成的质量,孙溪饶[6]通过大量文献总结出以1.0mm/d牵引,每天2~4次的频率牵引能够形成较好质量的新骨。因此根据本实验自身特点设计行程为每旋转1周牵引0.5mm,最大行程为25.0mm。
1.3 实验方法 术前所有beagle犬禁食、水,根据体质量调整麻醉剂量,常规消毒铺巾,全身麻醉起效后在第3、4前磨牙平行前庭沟水平方向切开并翻瓣后充分暴露下颌骨体部,以在下颌第3、4前磨牙间纵形截开行成完全骨折状态,根据口腔情况安装并调整牵张器(图1),使得骨折两侧骨段紧密贴合并稳固固定,无活动性出血后予以分层对位缝合。术后流食,经过5d延迟期后每隔12h旋转牵张器1圈,待1周后第3、4前磨牙间形成约6.8mm新骨区。将两组犬分别在下颌骨牵张成骨后2周及6周后,分别将第3前磨牙向远中移入新骨区内并对该牙进行牙周护理。

图1 全身麻醉下犬下颌骨内安装牵张器
图2 牵张成骨前下颌第3、4前磨牙间距

图3 牵张成骨后牙体间距(箭头所指为新骨区)
李华等[7]学者对牵张成骨新生骨的评价方法进行了总结分析,本实验采用常规X线影像分析法,根据影像中新骨纹理的数量和粗细及其显微结构以判断新骨的形成质量,见图2、3;牵张成骨后利用正畸拉簧将实验牙移入新骨区内,见图4。
实验牙完成移动后,确保实验牙牙周及牙龈无菌斑,犬全身麻醉后运用吸潮纸尖法收集龈沟液[8],清洁并干燥实验牙的近远中两个检测位点,将滤纸条沿移动牙表面置入龈沟内,感到轻微阻力后停止深入。每间隔1min取2次龈沟液,放入消毒后的Ep管内,立即予以称质量后进行低温冷冻保存以备后用。
本实验的AST测量是将之前Ep管中冷冻的龈沟液解冻后并添加自制缓冲液-Tris(小牛血清 2.5%,Tween 20 0.05%,Nacl 0.1mol/L,Tris 12.0mmol/L),置于旋涡混合器(HQ-60)震荡1min后在10 000r/min速度的台式高速冷冻离心机(400R-LABOFUGE)将样本液体离心10min,其Ep管内样本分为两层,底层为悬浮于原溶液中通过离心后沉淀的杂质,上层为清澈液体,提取上清液放入另一Ep管中,利用SYSMEX自动生化分析仪对AST水平进行测量分析。
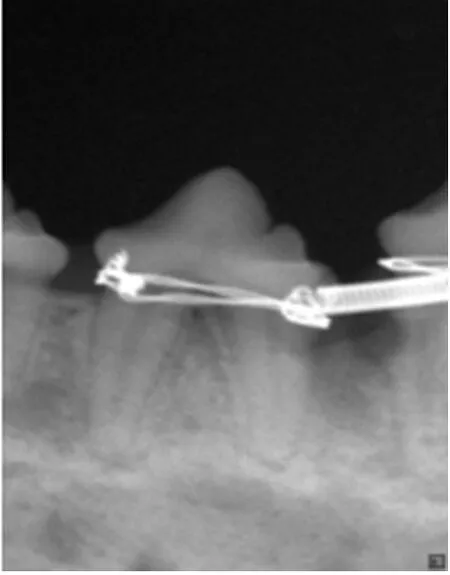
图4 利用正畸拉簧将牙移入新骨区
1.4 统计学处理 利用SPSS19.0统计软件对实验中数据进行统计学处理,计量资料以x±s表示,t检验;其计数资料中AST水平变化采用方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同时机犬牙移入成骨新区牙周AST水平比较 牵张成骨2周、6周后移动牙龈沟液中AST水平的比较分析发现两组实验牙受力3dAST水平呈持续上升趋势,且2周组上升较6周组上升明显;7d时表现为下降趋势,在21d达最低,并逐渐恢复;当28d时AST水平再次出现较高水平,见表1。
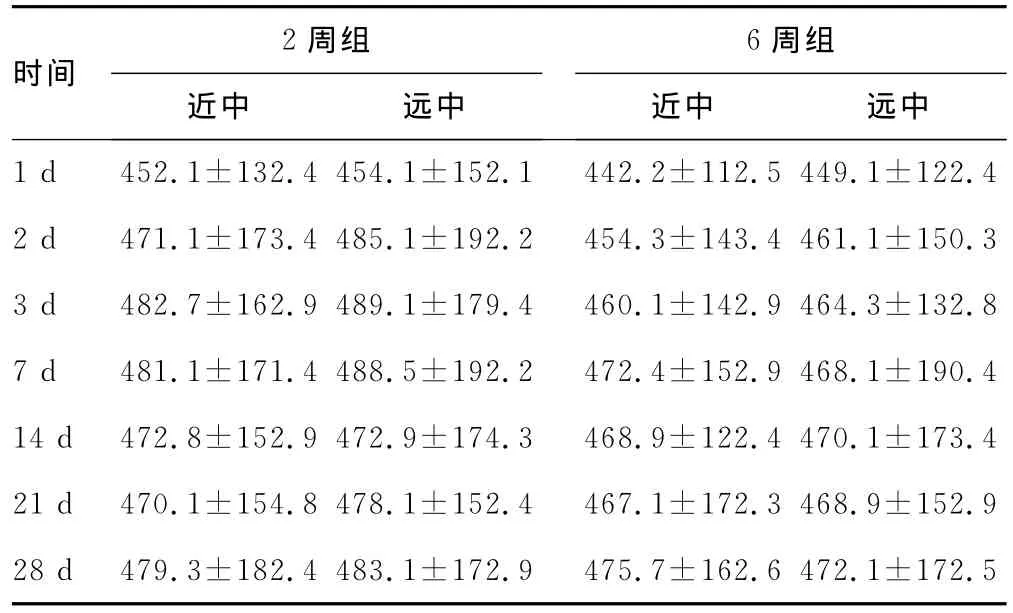
表1 不同时机犬牙移入成骨新区牙周AST水平比较(x±s)
2.2 不同时间各组不同位置下AST的动态改变的方差分析
在不同时间实验牙移入牵张成骨区内不同时间及位置的实验牙龈沟液中AST水平变化相比较,差异有统计学意义(P<0.01)。而对实验牙近、远中方向龈沟液中的AST水平变化相比较,差异无统计学意义(P>0.05),见表2。
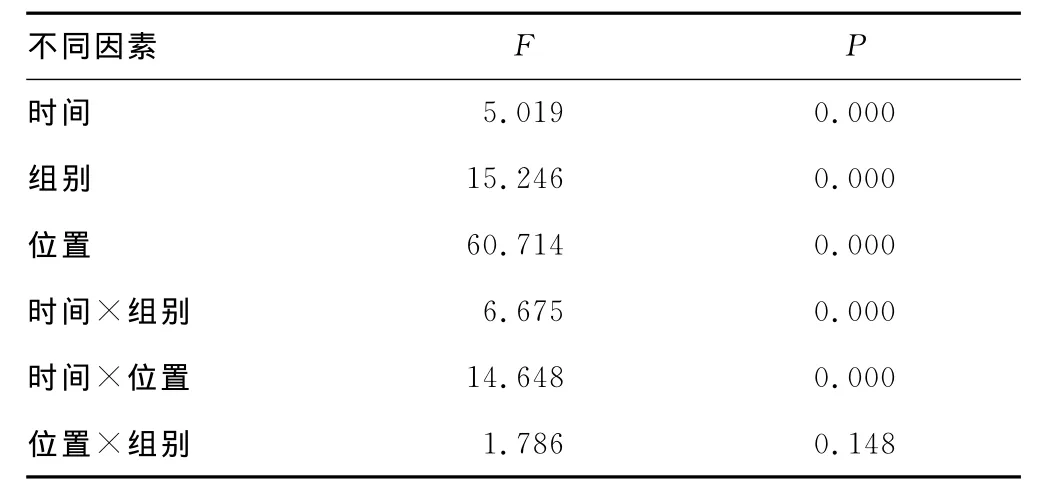
表2 不同因素下犬牙移入成骨新区龈沟液中AST的动态改变方差分析
3 讨 论
龈沟液因含有大量的酶和一些具有破坏牙周组织的因子及其产物,是判断牙龈炎症程度的客观指标,与其相应部位牙龈组织炎症程度呈正比关系[9]。龈沟液中AST是目前公认与牙周组织改建相关的成分,它是一种细胞内酶,在相应组织细胞出现破坏甚至死亡时便被释放出来[10],一旦在细胞外环境AST水平值较高则不排除该组织细胞出现破坏的可能[11]。
健康的牙周环境是其牙周膜内多细胞通过某种途径相互作用使得数量与位置相互调控而达到一种生理与代谢的相对平衡状态[12]。Perinetti等[13]学者认为龈沟液中 AST的水平变化直接反映了矫正牙在移动过程中该牙周组织的改建状况。王辉等[14]在对正畸治疗研究也发现龈沟液AST可作为牙周组织炎性改变的重要衡量指标。
颌骨通过牵张成骨形成一段新骨后,由于组织结构不完全等同于正常骨组织,因此在成骨后不同时机将牙齿移入新骨区,其牙周组织的改建也会有所不同。本研究对犬牙移入成骨新区龈沟液中AST水平的动态分析其变化,结果表明1周内AST水平呈逐渐上升趋势,说明在牙齿移动初期牙周组织破坏较为严重,且牵张成骨2周后即刻移动牙齿其AST值较高,说明较早移入新骨区对牙周组织的破坏更为严重。
犬牙向远中移入成骨新区后,远中侧牙槽骨出现明显吸收,牙周出现明显炎症,随着牙周炎症的加重,牙槽骨吸收量增多,其附着丧失也增加,而龈沟液中的ALP、AST水平也随之升高[15]。本研究中由于牵张成骨后2周较6周骨组织尚未完全形成,因此成骨区新骨牙周组织更易受到破坏,从而发生缺血坏死导致牙槽骨严重吸收,因此移动牙的远中AST水平相对近中较高。由于本实验采用钢丝结扎法利用拉簧将牙体向远中牵引入成骨区,难免出现钢丝及拉簧处较易残留食物而导致远中牙周组织破坏较近中严重,这也成为移动牙的远中AST水平相对近中较高的原因之一。
另外当牙移入2周后AST水平逐渐降低并趋于稳定,主要原因可能是随着时间的延长,牵引牙体的力值逐渐削弱,同时成骨新区骨组织逐渐成熟稳定,表明该时间牙齿施力的强度恰到好处,能促进牙周血管血运处于最佳状态,从而牙槽骨也保持在积极改建中。但在4周后AST再次出现小幅度升高,当时间持续时其早期良好的口腔环境也发生变化。
AST作为相对独立客观的反映牙周组织改建指标,其水平的变化直接反映出牙周组织的破坏程度,而且AST水平也对牙周组织不同时期及状态的改建情况也能充分体现。特别是在本研究中不同时机移入成骨新区AST水平的变化对今后临床研究有一定的指导意义,虽然一些学者认为成骨2周后移动牙齿较6周移动速度较快,但本研究发现AST水平的变化提示其牙周组织的破坏相对也较为严重。
[1] 李菲菲,丁寅,陈富林,等.机械牵张应力对成骨细胞增殖和分化影响的初步研究[J].口腔医学研究,2012,28(6):507-512.
[2] 赵玺,米丛波,居曼江·买买提,等.牙周膜牵张成骨术快速移动尖牙的三维有限元模型建立[J].中国组织工程研究与临床康复,2010,14(22):4014-4017.
[3] 苏寒,闫翔,毛钊.成人牙周病正畸治疗进展[J].医学研究生学报,2011,24(12):1329-1331.
[4] Offenbacher S,Barros SP,Singer RE,et al.Periodontal disease at the biofilm-gingival interface[J].J Periodontol,2007,78(10):1911-1925.
[5] 张黎,符起亚,魏世民,等.3种不同扩弓方式对龈沟液AST、ALP水平影响的研究[J].重庆医学,2011,40(26):2606-2607,2610.
[6] 孙溪饶.牵引速率及频率对牵张成骨的影响[J].中国组织工程研究与临床康复,2010,14(41):7727-7730.
[7] 李华,周诺.牵张成骨新生骨评价方法的研究及应用进展[J].山东医药,2012,52(14):94-96.
[8] 陈智滨,孙晓军,栾庆先.滤纸条与吸潮纸尖采集龈沟液样本比较[J].现代口腔医学杂志,2008,22(2):137-140.
[9] McCulloch CA.Host enzymes in gingival crevicular fiuid as diagnosyic indicators of periodontitis[J].J Clin Periodontol,1994,21(7):497-506.
[10]彭鹏.生长因子在正畸牙移动牙周组织改建中的作用[J].国际口腔医学杂志,2012,3(2):252-256.
[11]Chambers DA,Imrey PB,Cohen RL,et al.A longitudinal study of aspartate aminotransferase inhuman gigival crevicular[J].Periodont Res,1991,26(2):65-74.
[12]Hoshi N,Negishi H,Okada S,et al.Response of human fibroblasts to implant surface coated with titanium dioxide photocatalytic films[J].J Prosthodont Res,2010,54(4):185-191.
[13]Perinetti G,paolanotonio M,D`Archivio M,et al.Alkaline phosphatase activity in gingival crevicular fluid during human orthodontic tooth movement[J].Am J Orthod Dentofacialorthop,2002,122(5):548-556.
[14]王辉,王旭,成洲.正畸治疗中龈沟液天冬氨酸转氨酶水平的变化研究发现[J].泰山医学院学报,2013,34(5):327-329.
[15]胡赟,郑蕾蕾,唐甜,等.正畸微种植体周围炎对骨结合界面影响的研究[J].华西口腔医学杂志,2011,29(1):17-20. doi:10.3969/j.issn.1671-8348.2015.32.006

