心肺复苏术后大鼠海马组织高迁移率族蛋白B1和NF-κB的表达及相关性分析*
侯安然,康秀文,陈晓兵,王言理,刘克喜
(徐州医学院附属连云港医院重症监护室,江苏连云港222002)
心搏骤停(sudden cardiac arrest,SCA)一直是威胁人类生命健康的重大问题[1]。随着医疗体系的完善与心肺复苏技术的规范化,院外及院内的SCA患者心肺复苏成功率得到一定的提高,但在自主循环恢复后的患者中大约仍有68%的院外和23%院内SCA患者死于脑损伤[2]。近年来关于心肺复苏术后全脑缺血损伤研究涉及了能量代谢异常、炎性反应、钙离子超载、神经细胞凋亡等诸多方面,其中心肺复苏术后脑组织内炎症瀑布效应 备 受 关 注[3-4]。研 究 报 道 胞 外 高 迁 移 率 族 蛋 白 B1(HMGB1)表现炎性因子样作用与多种炎性介质共同参与炎性反应[5-6]。既往研究证实,在脑出血、脑卒中及脑膜炎患者的外周血和脑脊液中HMGB1水平均显著升高[7-9]。近年来发现在心肺复苏术后患者脑脊液和血液中HMGB1水平亦显著升高[10]。但是,对心肺复苏术后脑组织HMGB1表达规律尚未见相关研究报道。本研究通过窒息法制备大鼠SCA模型,检测心肺复苏术后大鼠不同时间点海马组织内HMGB1和核转录因子(NF-κB)表达及其相关性,同时观察病理形态学改变,初步探讨HMGB1和NF-κB在心肺复苏术后脑炎性损伤中的作用,为临床治疗心肺复苏术后脑炎性损伤寻求潜在的治疗新靶点。
1 材料与方法
1.1 材料 清洁级、雄性SD大鼠40只,体质量200~280g(徐州医学院动物实验中心,合格证号:苏SCXK2010-0003);Trizol试剂和逆转录试剂盒(北京天根公司);HMGB1和NF-κB PCR引物(上海生物工程公司);RIPA裂解液、BCA蛋白浓度测定试剂盒、蛋白质分子量标准、碱性磷酸酶标记山羊抗兔鼠IgG和BCIP/NBT显色试剂盒(中国碧云天生物技术研究所);兔抗大鼠 HMGB1抗体(美国Abcam公司),兔抗鼠NF-κB抗体(武汉三鹰生物技术有限公司),兔抗大鼠β-actin抗体(巴傲德生物技术有限公司);呼吸机(BW动物呼吸,上海软隆有限公司制造)。
1.2 方法
1.2.1 分组 采用随机数字表法分为假手术组(n=6)、复苏组(按复苏后自由循环恢复后2、6、12、24和48h各时间点分为5亚组,n=6)。
1.2.2 模型制备 在实验大鼠腹腔注射10%水合氯醛3 mL/kg麻醉,将大鼠仰卧位固定于手术台上,四肢接心电导联,监测标准肢体Ⅱ导联。颈部正中切口,气管切开置管固定,接呼吸机。行右侧股动、静脉置管,动脉导管接压力传感器,显示动脉压波形,待大鼠血压和心率稳定后,假手术组开始计时实验。复苏组继续于呼气末夹闭大鼠气管导管制备窒息性SCA模型,并给予心肺复苏,在自主循环恢复后开始计时实验。初始继续以纯氧机械通气60min,后剪断气管导管(体外留1cm供通气),结扎股动、静脉,缝合皮肤切口,送回鼠笼饲养。
1.2.3 标准 SCA判断标准:心电图呈室颤、停搏,收缩压小于或等于25mm Hg。心肺复苏标准方法:在出现SCA,且夹闭气管插管8min后开放气道,呼吸机控制通气(纯氧),频率每分钟80次,潮气量6mL/kg,吸/呼比1∶2,并快速行人工胸外按压,按压频率为每分钟200次,按压深度为大鼠胸廓前后径1/3,同时经股静脉快速推注肾上腺素0.02mg/kg,必要时追加1次。主自循环恢复判断标准:心电图出现自主节律,收缩压大于60mm Hg,持续10min以上。复苏无效判定:持续复苏30min无效终止抢救。大鼠补充标准:假手术组、复苏组在留取标本之前发生死亡的,该动物的实验数据无效,则另进行补充实验,以满足每个亚组实验数据6只。
1.2.4 标本留取 假手术组大鼠操作成功20min后留取静脉血5mL,断头留取脑组织。复苏组在模型制备成功后于各时间点留取标本:麻醉后取下腔静脉血5mL,并断头处死,取左侧海马,-80℃保存;取右侧海马放4%多聚甲醛固定备用。
1.2.5 光镜下观察海马组织病理变化 海马(右)常规进行HE染色。以假手术组海马组织病理变化为参照,观察各时间点复苏组海马组织病理变化。
1.2.6 RT-PCR法检测大鼠海马组织 HMGB1、NF-κB mRNA表达 按照RT-PCR试剂盒操作说明,HMGB1mRNA反应条件为:94℃预变性5min,94℃变性30s,退火59℃30s,延伸72℃60s,共进行27个循环,最后72℃延伸10min。NF-κB mRNA反应条件为:94℃预变性5min,94℃变性50 s,退火53℃45s,延伸72℃60s,共28个循环,最后72℃延伸8min。引物序列及PCR条件见表1。扩增的PCR产物在2%琼脂糖电泳后,采用凝胶成像分析系统观察电泳结果,Quantity One分析软件进行分析,以目的基因/GAPDH为本基因表达的相对值。
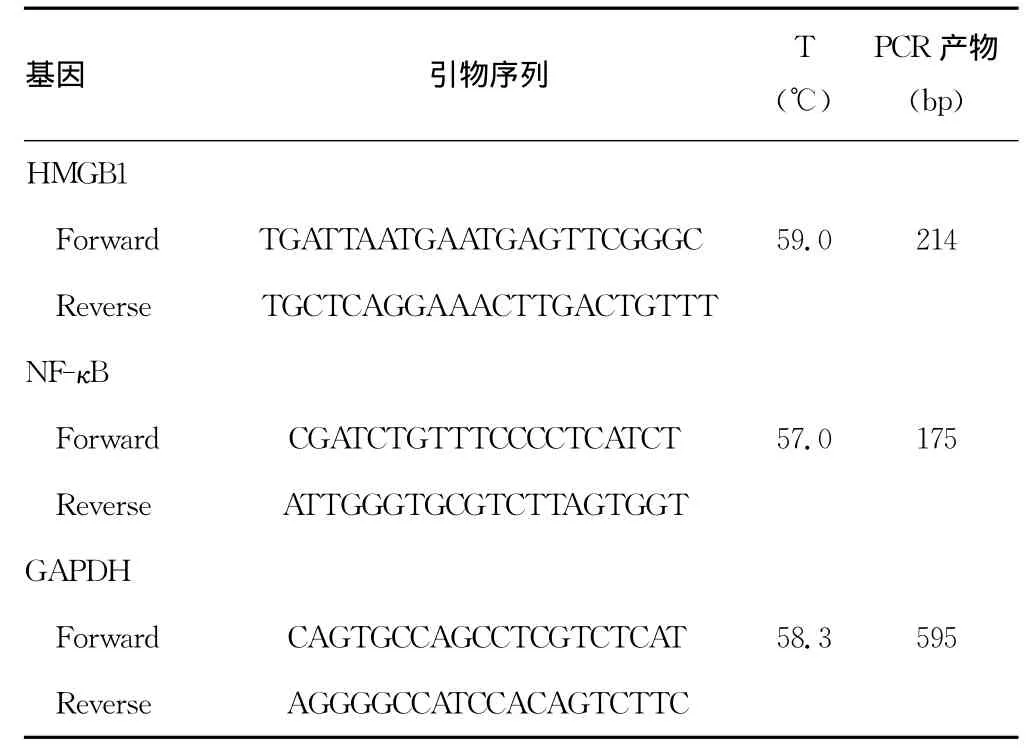
表1 RT-PCR引物序列及条件
1.2.7 Western Blot检测大鼠海马组织 HMGB1、NF-κB表达按照RIPA裂解液说明书提取蛋白,BCA法定量蛋白,配制12%分离胶,5%浓缩胶,样品上样量为5μL(约30μg),80V下电泳30min,120V下电泳至溴酚蓝到胶底,转膜300mA(60min),室温下封闭90min,加一抗4℃孵育过夜,碱性磷酸酶标记山羊抗兔二抗 (1∶1 000)室温下孵育90min,洗膜、BCIP/NBT显色。扫描后将目的蛋白条带与内参蛋白(β-actin)条带吸光度比值以x±s表示。
1.3 统计学处理 采用SPSS 16.0统计软件进行实验数据分析处理。计量资料用x±s表示,两样本均数比较采用t检验,多个样本均数比较采用单因素方差分析,多组计量资料间的多重比较采用LSD-q检验;若方差不齐采用随机区组设计的秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 海马组织病理切片结果 假手术组神经细胞排列整齐,形态完好,圆形或椭圆形,核染色较淡,染色质分布较均匀,尼氏体分布正常,未见细胞肿胀及变性坏死等病理改变。复苏组海马组织存在缺血性病理改变,随着自主循环恢复延长光镜下细胞周围间隙出现增宽,形态不规则,组织结构疏松,间质水肿,胞质结构不清,尼氏体边聚或消失,核固缩,神经细胞出现变性坏死,以自主循环恢复后24h最为显著,自主循环恢复后48h水肿减轻,但损伤仍较重,间质胶质纤维增多,见图1。
2.2 大鼠海马组织 HMGB1、NF-κB mRNA表达变化 与假手术组比较,复苏组自主循环恢复后2、6、12、24和48h的海马HMGB1、NF-κB mRNA表达量均明显增高,差异有统计学意义(P<0.01),其中24h为峰值(P<0.01),在48h略下降(P<0.01),见图2。
2.3 大鼠海马组织HMGB1、NF-κB蛋白表达变化 与假手术组比较,海马组织HMGB1在复苏组自主循环恢复后2h蛋白表达显著降低(P<0.01),24h达到峰值(P<0.01),48h稍下降(P<0.01)。与假手术组比较,复苏组自主循环恢复后2、6、12、24和48h的NF-κB蛋白表达量均明显增高,差异有统计学意义(P<0.01),其中24h为峰值(P<0.01),48h略下降(P<0.01),见图3。
2.4 HMGB1和NF-κB蛋白表达间的相关性分析 复苏组各时间点海马组织HMGB1与NF-κB蛋白表达趋势相同,相关性分析显示二者呈正相关(r=0.978,P=0.000)。
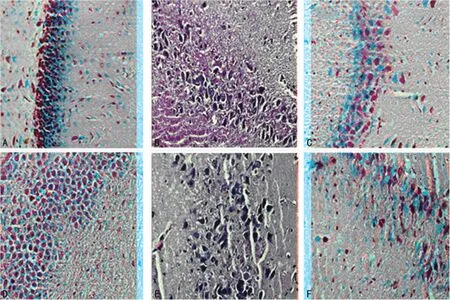
图1 各组海马组织病理形态学变化(HE×400)
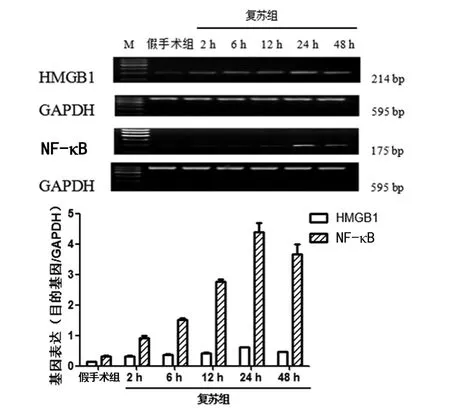
图2 各组海马组织 HMGB1、NF-κB mRNA表达比较
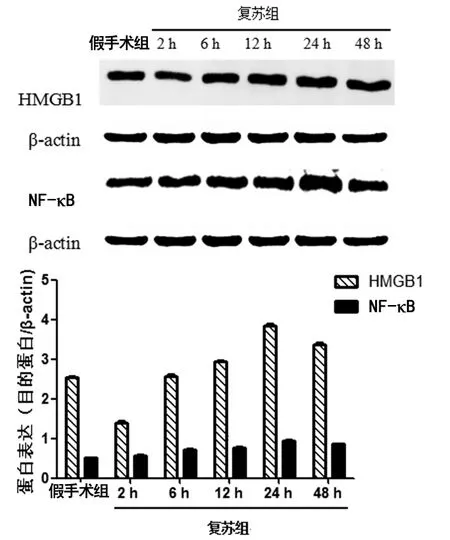
图3 各组海马组织HMGB1、NF-κB蛋白表达比较
3 讨 论
HMGB1是一种高度保守的非组DNA结合蛋白,广泛存在于真核细胞胞核,参与基因转录、修复和核酸结构稳定等多种生物学过程。近年来研究表明胞内HMGB1释放到胞外则作为一种炎性因子在炎性反应瀑布中处于核心地位,在启动早期炎性反应、扩大和维持晚期炎性反应过程中均发挥重要作用[11]。又有研究表明HMGB1作为一种重要的炎症因子在脑梗死病情发展转归过程中能激活其他炎症介质,放大炎性反应,加剧脑损伤[12]。
本研究显示心肺复苏术后大鼠海马组织HMGB1蛋白表达水平于2h降低,而后逐渐上升,24h达到高峰,在48h略下降,但仍高于正常水平。本研究与 Wang等[13]报道类似,但不同之处为本研究自主循环恢复后2hHMGB1蛋白表达量降低,而Wang等[13]研究则为2h时升高,原因可能为制作动物模型方式不同和缺血时间长短不同。SCA所致为全脑缺血缺氧,其缺血面积及损伤程度更为显著,在心肺复苏术后早期阶段,神经细胞、胶质细胞及内皮细胞等出现缺血受损或坏死,HMGB1迅速从胞核转移至胞质被动释放至胞外、耗竭,而后释放出来的HMGB1进一步激活小胶质细胞和其他免疫细胞主动分泌HMGB1、炎性因子共同介导心肺复苏术后脑炎性损伤。从而出现心肺复苏术后海马组织HMGB1表达呈现明显的早期降低、晚期升高的趋势,有关研究也得到类似观点[14]。以上研究均提示HMGB1是触发心肺复苏术后脑缺血早期炎性反应的上游始动因子。HMGB1基因表达呈现持续升高趋势,在48h略下降,与蛋白表达趋势类似。
NF-κB是一种功能多样的核转录因子,基础状态下主要存在于真核细胞胞质,在活化因素的激活下可迅速从细胞质转移至胞核与相应的DNA结合位点特异性结合,随后启动、调控炎性因子的表达,造成组织损伤。然而升高的炎性因子反过来可充当活化因素再次激活NF-κB形成一种正反馈途径不断地促进炎症的发生、发展,可见NF-κB是炎性反应的中心环节。脑缺血能诱导NF-κB的激活,激活的NF-κB在脑缺血无菌性炎性损伤[15]、脑水肿、神经细胞凋亡等方面均发挥着重要作用。本研究得出NF-κB在心肺复苏术后海马组织蛋白表达随着自主循环恢复时间延长逐渐上升,24h为峰值,后缓慢下降,其基因表达与蛋白表达一致,与 Wang等[13]的研究结果一致。NF-κB与HMGB1蛋白表达相关性分析显示二者呈显著正相关(r=0.978,P=0.000)。HE染色观察大鼠心肺复苏术后脑缺血病理改变与海马组织中HMGB1、NF-κB表达变化趋势基本一致,从病理形态学方面支持以上结论。另外研究发现胞外的HMGB1可与受体RAGE、TLR2/4等结合通过不同信号通路介导 NF-κB活化[16]。以上提示 HMGB1位于 NF-κB上游,进而推测在心肺复苏术后早期由受损、坏死的细胞被动释放的HMGB1是启动心肺复苏术后早期脑炎性反应的主要炎性因子。综上所述,HMGB1和NF-κB在心肺复苏术后大鼠海马组织中变化趋势一致,并且二者之间呈显著正相关性,表明HMGB1/NF-κB信号通路可能参与了心肺复苏术后早期脑炎性损伤,进而加剧脑组织损害。若在此时间窗内给予针对HMGB1/NF-κB信号通路的靶向治疗有望减轻心肺复苏术后脑炎性损伤、改善神经功能预后。但本研究仍需延长观察时间,扩大样本量,设计通道“分子开关”做进一步地研究探索、证实。
[1] Lloyd-Jones D,Adams RJ,Brown TM,et al.American Heart Association Statistics Committee and Stroke Statistics Subcom-mittee[J].Circulation,2010,121(7):948-954.
[2] Wang Q,Tang XN,Yenari MA.The inflammatory response in stroke[J].J Neuroimmunol,2007,184(1/2):53-68.
[3] Xia W,Han J,Huang G,et al.Inflammation in ischemic brain injury:current advances and future perspectives[J].Cline Exp Pharmacol Physiol,2010,37(2):253-258.
[4] 梁璐,于学忠.脑复苏的临床研究进展[J].中国全科医学,2006,9(20):1664-1667.
[5] Qiu J,Nishimura M,Wang Y,et al.Early release of HMGB1from neurons after the onset of brain ischemia[J].J Cereb Blood Flow Metab,2008,28(5):927-938.
[6] 杨丽萍,姚永明,李杰萍,等.高迁移率族蛋白B1真核表达载体的构建及其对肿瘤坏死因子-α报告基因活性的影响[J].中国中西医结合急救杂志,2008,15(3):171-174.
[7] Kentaro M,Masayo K,Travis M,et al.Subarachnoid hemorrhage induces gliosis and increased expression of the pro-inflammatory cytokine high mobility group box 1protein[J].Transl Stroke Res,2011,2(1):72-79.
[8] Kim ID,Shin JH,Lee HK,et al.Intranasal delivery of HMGB1-binding heptamer peptide confers a robust neuroprotection in the post ischemic brain[J].Neurosci Lett,2012,525(2):179-183.
[9] Tang D,Kang R,Cao L,et al.A pilot study to detect high mobility group box1and heat shock protein 72in cerebrospinal fluid of pediatric patients with meningitis[J].Crit Care Med,2008,36(1):291-295.
[10]Yasutaka O,Resume T,Fujita M,et al.Prediction of the neurological outcome with intrathecal high mobility group box1and S100Bin cardiac arrest victims:A pilot study[J].Resuscitation,2012,83(8):1006-1012.
[11]Wang H,Bloom O,Zhang M,et al.HMG-1as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248-251.
[12]Zhang J,Takahashi HK,Liu K,et al.Anti-high mobility group box-1monoclonal antibody protects the blood-brain barrier from ischemia-induced in rats[J].Stroke,2011,42(5):1420-1428.
[13]Wang L,Zhang X,Liu L,et al.TanshinoneⅡ A downregulates HMGB1,RAGE,TLR4,NF-κB expression,ameliorates BBB permeability and endothelial cell function,and protects rat brains against focal ischemia[J].Brain Res,2010,132(1):143-151.
[14]Kim JB,Siq Choi J,Yu YM,et al.HMGBl,a novel cytokine-like mediator Linking cute neuronal death and delayed neuroinflammation in the postischemic brain[J].J Neurosci,2006,26(24):6413-6421.
[15]Ridder DA,Schwaninger M.NF-kappa B signaling in cerebral ischemia[J].Neuroscience,2009,158(3):995-1006.
[16]Yang QW,Wang JZ,Li JC,et al.High-mobility group protein box-1and its relevance to cerebral ischemia[J].J Cereb Blood Flow Metab,2010,30(2):243-254.

