PCI术中对比剂剂量与患者血肌酐、肾小球滤过率、肌酐清除率的相关性及对近中期不良事件的影响
谢建伟,朱皓,黄榕翀
论著·临床
PCI术中对比剂剂量与患者血肌酐、肾小球滤过率、肌酐清除率的相关性及对近中期不良事件的影响
谢建伟,朱皓,黄榕翀
目的 观察经皮冠状动脉介入治疗(PCI)术中对比剂剂量与患者血肌酐(SCr)、肾小球滤过率(eGFR)水平变化及近中期不良事件的关系。方法PCI术后患者462例按对比剂剂量分为2组,即剂量<150ml组103例(对照组)和剂量150~300ml组359例(观察组)。记录2组患者PCI术前及术后1周、1个月、3个月、9个月的SCr、eGFR及肌酐清除率(CCr),同时记录2组患者术后对比剂肾病(CIN)发生率,再次心肌梗死、PCI术、冠状动脉搭桥及猝死等近中期不良心血管事件(MACE)的发生情况。结果 2组患者术前、术后SCr、eGFR、CCr比较差异均无统计学意义(P>0.05)。CIN发生率:对照组5例(4.9%)低于观察组19例(5.3%)(χ2=0.031,P=0.86 )。MACE发生率:对照组13例(12.6%)低于观察组41例(11.4%)(χ2=0.112,P=0.738)。eGFR是发生CIN的独立危险因素(OR=0.931,95%CI=0.910~0.952,P<0.01)。结论 在对比剂使用剂量低于300ml情况下,随着对比剂剂量的增加,其对肾功能的损伤严重程度未增加;对近中期不良事件的发生率无影响。
对比剂;剂量;PCI术;肾小球滤过率;肌酐;不良事件
【DOI】 10.3969 /j.issn.1671-6450.2015.04.003
随着放射学和心脏病学的发展,将会有越来越多的患者应用碘对比剂。以诊断和介入治疗为目的、血管内利用碘对比剂的心导管检查正在被广泛应用, 致使与手术相关的对比剂肾病(contrast induced nephro-pathy,CIN)的发生率增加[1,2]。虽然冠状动脉造影(coronary angiography,CAG)和经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)后需血液透析的CIN发生率较低[3],但其与住院时间延长和在院及1年不良结果相关[4,5],是院内获得性肾功能衰竭的第3位最重要原因,占所有病例的12%[6],与高发病率和病死率相关[7]。新近又提出了对比剂引起的急性肾功能损害(contrast-induced acute kidney injury, CI-AKI)的概念[8],其诊断标准比CIN更为严格。在临床上,常以应用碘对比剂后48 h内血清肌酐(SCr)水平升高5 mg/L(44.2 μmol/L)或比基线值升高25%来定义CIN。CI-AKI定义为血管内应用碘对比剂24~48 h内发生的无其他原因可以解释的急性肾功能衰竭, SCr较基线值升高50%或3 mg/L(26.5 μmol/L)。国内外大量临床研究已经证实,对比剂剂量>5 ml/kg时对肾功能的损害是明确的,但<300 ml的对比剂对肾功能是否有影响目前无进一步研究报道。现以150 ml为分组界限,旨在阐明不同组间对比剂剂量对肾功能的影响程度,以及对近中期不良心血管事件发生率的影响,指导介入治疗工作中对比剂的合理使用。
1 资料与方法
1.1 临床资料 2009年7月—2010年6月大连医科大学附属第一医院心内科行PCI患者462例。入选条件:均为稳定型心绞痛、不稳定型心绞痛、心肌梗死。排除标准:对比剂用量超过300 ml,碘剂过敏,妊娠,血流动力学不稳定(如心力衰竭、休克)。其中男345例,女117例;年龄34~91(62.4±10.8)岁。合并高血压295例,糖尿病136例,高血脂258例,慢性肾脏疾病28例。左室射血分数(LVEF)<50%74例,贫血28例。入选患者按对比剂剂量150 ml为界限分为2组:剂量<150 ml组103例(对照组)和剂量150~300 ml组359例(观察组)。对比剂为优维显370(拜耳医药保健有限公司),呈非离子型、低渗性。PCI术中对比剂用量100~300(175.5±61.6)ml。本研究经医院伦理委员会批准,全部患者及家属知情同意并签署协议书。
1.2 观察指标 记录患者性别、年龄、体质量、高血压、糖尿病、高血脂、心力衰竭、慢性肾病及贫血等疾病史以及吸烟史、心血管疾病家族史。记录患者术前肌酐(SCr)水平(采血时间为晨空腹, 于肘关节正中静脉抽血2~4 ml,SCr检测采用肌氨酸氧化酶法,试剂盒由罗氏公司提供)、对比剂剂量、手术操作持续时间,随访患者术后1、3、9个月SCr水平及近中期不良心血管事件(MACE)发生情况(再发心绞痛、心肌梗死、血管重建术及猝死)。术前及术后估算肾小球滤过率(eGFR)值,eGFR=175×[SCr(mg/dl)]-1.234 ×[年龄(岁)]-0.179 ×性别(男性=1,女性=0.79)。术后1、3、9个月肌酐清除率(CCr)值由CCr,CCr=[(140-年龄)×体质量(kg)]/[0.818×SCr(μmol/L)],女性按计算结果×0.85。

2 结 果
2.1 基线特征 2组性别、年龄、高血压、糖尿病、高血脂、吸烟史、心血管疾病家族史、LVEF、贫血、慢性肾脏疾病史等临床基线特征比较差异均无统计学意义(P>0.05)。见表1。
2.2 实验室检查 2组术前、术后各时点SCr、eGFR、CCr比较差异均无统计学意义(P>0.05)。见表2。
2.3 心血管不良事件 术后CIN发生率、心血管不良事件(包括猝死、再发心肌梗死及再次PCI、冠脉搭桥等)发生率2组间比较差异均无统计学意义(P>0.05)。见表3。
2.4 多元回归分析 对可能影响患者CIN发生的危险因素进行多因素Logistic回归分析。结果显示,eGFR是发生CIN的独立危险因素(OR=0.931,95%CI0.910~0.952,P<0.01),对比剂剂量是PCI术后CIN发生的主要因素(OR=1.005,95%CI0.997~1.013,P=0.237)。见表4。

表1 2组患者临床基线的比较

表2 2组SCr、eGFR、CCr比较
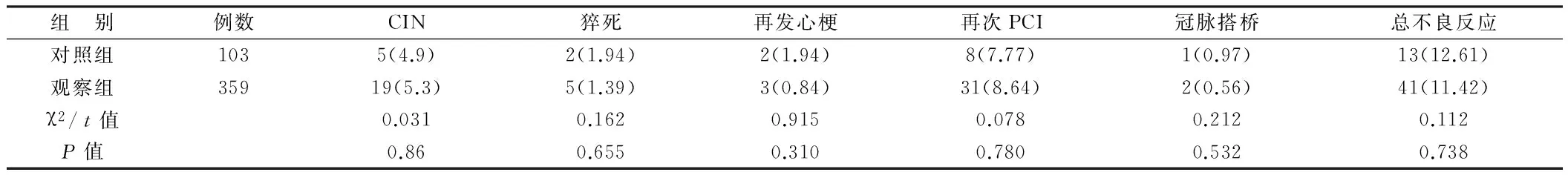
表3 2组心血管不良事件比较 [例(%)]

表4 CIN发生危险因素的Logistic回归分析结果
3 讨 论
近年来,随着医学影像学的发展以及介入治疗的广泛应用,碘对比剂的使用日趋广泛,与之相关的CIN也逐渐增加,CIN是医源性肾功能衰竭的常见病因[9,10]。CIN患者有更多的并发症,更高的近期及远期病死率,住院时间延长,治疗总费用增加[11,12]。对比剂对肾脏的损害与剂量相关。一般人群CIN发生率<3%, 但合并有多种危险因素的患者CIN发生率高达50%甚至更高。目前CIN已成为临床医师的重要挑战。有关报道显示,如果对比剂用量<5ml/kgCIN发生减少,如果用量>5ml/kg, 则发生率将升高。
3.1 对比剂对肾功能的影响 对比剂已被认定能使肾血管收缩,细胞外钙内流,肾血流量减少和NO生成减少,导致肾外髓自身调节缺失和急性肾小管坏死[13,14]。Romano等[15]证实低渗和等渗对比剂使肾髓质缺氧,肾细胞DNA裂解而细胞凋亡。对比剂的渗透性负荷会增加肾脏的代谢活性,从而改变肾脏的血流动力学,减少皮质—髓质和外层髓质的灌注,使得在正常情况下,原本缺氧的外层髓质缺氧加重,发生氧化应激和损伤,从而可能导致肾小管内皮功能不全和微循环损伤。本结果发现,对比剂对术后肾功能的影响是肯定的,术后1周SCr较术前明显升高,术后eGFR较术前降低。至于eGFR的标准差偏大,与所选病例个体差异大有关,可能对结果有一定的影响。术前SCr与术后1个月、3个月比较,差别无统计学意义。说明对比剂对肾功能的损害大部分患者是可以恢复的。对比剂可引起肾小管细胞剥离,细胞内ATP减少及钙浓度增加,细胞膜通透性减低和细胞间紧密连接重新分布。细胞外高渗环境通过氧自由基引起的氧化应激,诱导肾小管上皮细胞凋亡,凋亡细胞通常不引起周围组织的炎性反应,并使再生时所需的组织构架得以保存,与对比剂所致急性肾衰竭的可逆性有关。众所周知,对比剂引起血清肌酐的变化在应用24~72h内升高,其中80%的患者是在24h内升高,3~5d达高峰,常于2周内降至基线水平,大约25%的患者会遗留永久性的肾功能损害,只有少数人需要透析治疗。本结果发现,术前肌酐水平与术后9个月比较,差异有统计学意义,但对比剂对肾功能的长期影响没有进一步的随访资料,无法作出进一步的评价,需要进一步的观察研究。
对比剂对肾脏的损害与对比剂的使用剂量相关。对比剂剂量是CIN的独立预测因子,每增加100ml对比剂,CIN危险性增加12%,但未明确安全限量[16]。一般情况下对比剂用量在100~140ml时CIN发生率最低,而用量超过5ml/kg时将会增加对比剂肾病并需透析治疗风险。中国对比剂肾病专家组共识(CINconsensusworkingpanel,CINCWP)推荐的最大对比剂用量(maximumallowablecontrastdose,MACD)=5ml×体质量(kg)/基础血清肌酐(mg/dl)。有研究认为,对比剂<30ml对于任何患者都是安全的,但对于高危人群这个剂量仍有诱发CIN的可能[17]。上述现象提示CIN发生没有阈值效应。慢性肾脏疾病是发生CIN的高危因素,表现为eGFR<60ml·min-1·1.73m-2。这些患者虽然血清肌酐值可能在正常范围内,其实一部分肾单位已受损。在肾灌注压降低、应用肾毒性药物和对比剂等情况下,残留的肾单位极易受损害,诱发急性肾功能不全。故对肾功能差的患者,一般的原则是以毫升(ml)为单位,对比剂的用量不得超过eGFR值的2倍[18]。对于eGFR<60ml·min-1·1.73m-2的患者对比剂剂量应限制在100ml以内。故合并有高危因素的患者PCI术前应进行危险评估,以便限制对比剂用量。应用较大剂量对比剂能直接增加发生CIN的可能性[19~21]。有研究[22]发现当对比剂剂量<100ml时,冠状动脉造影患者无CIN发生。
现在多数PCI治疗对比剂用量在300ml以下,少数复杂冠状动脉病变对比剂用量超过300ml,甚至更高[23]。对比剂剂量>300ml对肾功能的损害是明确的;低于300ml对肾功能的影响目前并无进一步的研究。在对比剂剂量低于300ml的患者群中,不同剂量组间对肾功能的影响有多大,目前临床研究无相关报道。一般临床上以<150ml称为中—小剂量,单支病变介入术中对比剂使用剂量一般不超过150ml,而多支复杂冠状动脉病变多半超过150ml。本研究以对比剂剂量<150ml、150~300ml分组,观察表明2组对比剂对肾功能损害严重程度无差别。但不能否认对比剂对肾功能的损害。Brown等[24]证实,对比剂剂量超过MACD临界值,CI-AKI风险呈直线上升,而对比剂剂量在MACD临界值之下,CI-AKI风险在较低水平。Cigarroa等[25]研究显示,接受对比剂剂量在MACD临界值之下的患者,只有2%发生CI-AKI,而对比剂剂量超过MACD临界值的患者,有38%发生CI-AKI。有研究显示[26],对比剂剂量超过MACD,发生需血液透析的肾病风险增加6倍。Silva等[27]确定,STEMI患者行PCI治疗,对比剂剂量超过MACD,CI-AKI风险增加2倍。这些研究均提示对比剂对肾脏的损害与对比剂剂量相关。
针对每一个PCI患者,应计算其MACD,指导PCI时对比剂用量,以减少CIN或CI-AKI的发生。按体质量和SCr制定对比剂限制量可能提供更为精确的发生CI-AKI的临界值,高于此值,CI-AKI风险就会明显增加[28~30]。在一项STEMI患者行PCI的研究中,对比剂剂量超过MACD患者组CI-AKI发生率是低于MACD患者组的3倍(29%vs. 10%,P=0.001)[31]。对比剂剂量能影响CI-AKI风险,对于所有的患者,不论是否增加CIAKI风险,都应应用最低的与诊断结果一致的对比剂剂量。
对比剂剂量影响对比剂的肾毒性,两者之间存在相关性,应用对比剂剂量增加,CIN发生率升高[32]。然而有一项研究却得出相反的结论,该研究纳入5 256例行冠状动脉造影的患者,发现随着对比剂剂量增加,CIN发生率反而下降,接受对比剂<115ml患者组CIN发生率为16%,接受对比剂115~160ml患者组CIN发生率为14%,接受对比剂161~225ml患者组CIN发生率为8%,而接受对比剂>225ml患者组CIN发生率只有7%,这些差异无统计学意义,此研究提示对比剂剂量可能不干扰CIN的发生[33]。但有待于进一步研究证实。
3.2 对比剂剂量对近中期不良事件发生率的影响 本结果发现,以对比剂剂量<150ml、150~300ml分组,结果未发现2组患者术中对比剂剂量对术后SCr、eGFR影响的差异,同时也未发现2组术中对比剂剂量与近中期不良事件发生存在相关性。这可能与病例数少、随访资料不全等因素有关。但有研究显示,PCI患者CIN和死亡风险增高与对比剂剂量相关[34]。随着对比剂剂量的增加,术后SCr升高的危险性增加,而术后SCr升高者心肌梗死或死亡风险增加16%,1年靶血管重建率为28.8%。这都与对比剂剂量相关。
本文24例CIN患者中需要血液透析的只有1例,发生率为4.17%,该患者术前存在肾功能不全(CKDII期,高血压病)。在CIN预防小组制定的共识中,需要透析治疗的CIN患者与应用对比剂时本身潜在危险因素有关,通常发生率不超过1%。在对比剂肾病中国专家组共识中提到,在需要透析的CIN患者中,既往肾功能不全患者的比率大约为4%。虽然需要透析的CIN患者相对较少,但是对患者预后的影响却是深远的。
对比剂越来越普遍的应用增加了医源性CIN的风险。在目前发生机制尚未完全明确的情况下,临床医师应对准备造影的患者进行认真的危险评估,针对高危患者采取积极的预防措施,尽量减少对比剂用量,以降低介入术后CIN或CI-AKI的发生率。
1CarusoM,BalasusF,IncalcaterraE,etal.Contrast-inducednephropathyafterpercutaneouscoronaryinterventioninsimplelesions:riskfactorsandincidenceareaffectedbythedefinitionutilized[J].InternalMedicine,2011,50(9):983-989.
2BartorelliAL,MarenziG.Contrastinducednephropathy[J].JIntervenCardiol,2008, 21(1):74-85.
3FreemanRV,O’DonnellM,ShareD,etal.Nephrophyrequiringdialysisafterpercutaneouscoronaryinterventionandthecriticalroleofanadjustedcontrastdose[J].AmJCardiol,2002, 90(10):1068-1073.
4LindsayJ,AppleS,PinnowEE,etal.Percutaneouscoronaryintervention-associatednephropathyforeshadowsincreasedriskoflateadverseeventsinpatientswithnormalbaselineserumcreatinine[J].CatheterizationandCardiovascularInterventions,2003,59(3):338-343.
5LindsayJ,CanosDA,AppleS,etal.Causeofacuterenaldysfunctionafterpercutaneouscoronaryinterventionandcomparisonoflatemortalityrateswithpostprocedureriseofcreatinekinase-MBversusriseofserumcreatinine[J].AmJCardiol,2004, 94(6):786-789.
6NashK,HafeezA,HouS.Hospital-acquiredrenalinsufficiency[J].AmJKidneyDis,2002,39(5):930-936.
7LevyEM,ViscoliCM,HorwitzRI.Theeffectofacuterenalfailureonmortality-Acohortanalysis[J].JAMA,1996,275(19):1489-1494.
8BellomoR,KellumJA,RoncoC.Definingandclassifyingacuterenalfailure:fromadvocacytoconsensusandvalidationoftheRIFLEcriteria[J].IntensiveCareMed,2007,33(3):409-413.
9BrownJR,DevriesJT,PiperWD,etal.Seriousrenaldysfunctionafterpercutaneouscoronaryinterventionscanbepredicted[J].AmHeartJ,2008,155(2):260-266.
10MarenziG,MaranaI,LauriG,etal.Thepreventionofradiocontrast-agent-inducednephropathybyhemofiltration[J].NEnglJMed,2003,349(14):1333-1340.
11BartorelliAL,MarenziG.Contrast-inducednephropathy[J].JIntervCardiol,2008,21(1):74-85.
12MehranR.Contrast-inducednephropathyremainsaseriouscomplicationofPCI[J].JIntervCardiol,2007,20(3):236-240.
13TumlinJ,StaculF,AdamA,etal.Pathophysiologyofcontrast-inducednephropathy[J].AmJCardiol,2006,98(6A):14K-20K.
14SolomonR.Contrast-inducedacutekidneyinjury:isthereariskafterintravenouscontrast[J].ClinJAmSocNephrol,2008,3(5):1242-1243.
15RomanoG,BriguoriC,QuintavalleC,etal.Contrastagentsandrenalcellapoptosis[J].EurHeartJ,2008,29(20):2569-2576.
16RihalCS,TextorSC,GrillDE,etal.Incidenceandprognosticimportanceofacuterenalfailureafterpercutaneouscoronaryintervention[J].Circulation,2002,105(19):2259-2264.
17LaskeyWK,JenkinsC,SelzerF,etal.Volume-to-creatinineclearanceratio-Apharmacokineticallybasedriskfactorforpredictionofearlycreatinineincreaseafterpercutaneouscoronaryintervention[J].JAmCollCardiol,2007,50(7):584-590.
18LavilleM,JuillardL.Contrast-inducedacutekidneyinjury:howshouldat-riskpatientsbeidentifiedandmanaged?[J].JNephrol,2010,23(4):387-398.
19SolomonR,DerayG,ConsensusPC.Howtopreventcontrast-inducednephropathyandmanageriskpatients:practicalrecommendations[J].KidneyInt,2006,69(10):S51-S53.20MehranR,NikolskyE.Contrast-inducednephropathy:Definition,epidemiology,andpatientsatrisk[J].KidneyInt,2006,69(10):S11-S15.21NikolskyE,MehranR,TurcotD,etal.Impactofchronickidneydiseaseonprognosisofpatientswithdiabetesmellitustreatedwithpercutaneouscoronaryintervention[J].AmJCardiol,2004,94(3):300-305.
22CroninRE.Contrast-inducednephropathy:pathogenesisandprevention[J].PediatrNephrol.2010,25(2):191-204.
23RihalCS,TextorSC,GrillDE,etal.Incidenceandprognosticimportanceofacuterenalfailureafterpercutaneouscoronaryintervention[J].Circulation,2002,105(19):2259-2264.
24BrownJR,RobbJF,BlockCA,etal.Doessafedosingofiodinatedcontrast-inducedacutekidneyinjury[J].CircCardiovascInterv,2010,3(4):346-350.
25CigarroaRG,LangeRA,WilliamsRH,etal.Dosingofcontrastmaterialtopreventcontrastnephropathyinpatientswithrenaldisease[J].AmJMed,1989,86(6Pt1):649-652.
26 陈永利,姜华,陈闽荔,等.贫血与经皮冠状动脉介入术后对比剂诱导的急性肾损伤的关系研究[J].中国全科医学,2014,17(23):2722-2725.
27SilvaRG,SilvaNG,LucchesiF,etal.Preventionofcontrast-inducednephropathybyuseofbicarbonatesolution-preliminaryresultsandliteraturereview[J].JBrasNefrol,2010,32(3):288-297.
28CigarroaRG,LangeRA,WilliamsRH,etal.Dosingofcontrastmaterialtopreventcontrastnephropathyinpatientswithrenaldisease[J].AmJMed,1989,86(6Pt1):649-652.
29 胡晖,杨希立,周昭仑,等.经皮冠状动脉介入术围手术期大剂量阿托伐他汀钙强化治疗对急性冠状动脉综合征患者预后的影响[J].中国医药,2011,6(12):1487-1488.
30NymanU,BjorkJ,AspelinP,etal.Contrastmediumdose-to-GFRratio:Ameasureofsystemicexposuretopredictcontrast-inducednephropathyafterpercutaneouscoronaryintervention[J].Actaradiol,2008,49(6):658-667.
31MarenziG,AssanelliE,CampodonicoJ,etal.Contrastvolumeduringprimarypercutaneouscoronaryinterventionandsubsequentcontrast-inducednephropathyandmortality[J].AnnInternMed,2009,150(3):170-177.
32MadsenTE,PearsonRR,MuhlesteinJBetal.IntermountainHeartCollaborative(IHC)StudyGroup.Riskofnephropathyisnotincreasedbytheadministrationoflargervolumeofcontrastduringcoronaryangiography[J].CritPathwCardiol,2009,8(4):167-171.
33MarenziG,AssanelliE,CampodonicoJ,etal.Contrastvolumeduringprimarypercutaneouscoronaryinterventionandsubsequentcontrast-inducednephropathyandmortality[J].AnnInternMed,2009,150(3):170-177.
34CarusoM,BalasusF,IncalcaterraE,etal.Contrast-inducedNephropathyafterPCIinsimplelesions:riskfactorsandincidenceareaffectedbythedefinitionutilized[J].InternMed,2011,50(9):983-989.
Correlation among PCI contrast agent dose and serum creatinine, estimated glomerular filtration rate, creatinine clearance rate and adverse events in short and middle time points
XIEJianwei*,ZHUHao,HUANGRongchong.
*DepartmentofInterventionalRadiology,DashiqiaoCentralHospitalofLiaoningProvince,Dashiqiao115100,China
Objective To observe the relationship between percutaneous coronary intervention (PCI) contrast agent dose and serum creatinine (SCr), glomerular filtration rate (eGFR) and the adverse events in the short, middle time points.Methods According to the dose of contrast agent, 462 patients after PCI were divided into 2 groups, the dose <150 ml group with 103 cases (control group) and the dose of 150-300 ml group of 359 cases (observation group). Recorded the SCr, eGFR and creatinine clearance rate (CCr) before and after the operation at 1 week, 1 month, 3 months, 9 months, also recorded contrast induced nephropathy (CIN) incidence, re-infarction after PCI operation, main adverse cardiovascular events (MACE)such as PCI,coronary artery bypass graft and sudden death’s occurrence.Results There were no significant differe-nces of preoperative and postoperative SCr, eGFR and CCr in the 2 groups of patients (P>0.05).TheincidenceofCIN: 5cases(4.9%)inthecontrolgroup,whichwaslowerthantheobservationgroupof19cases(5.3%) (χ2=0.031,P=0.86).TheincidenceofMACE: 13cases(12.6%)inthecontrolgroup,whichwaslowerthantheobservationgroupof41cases(11.4%) (χ2=0.112,P=0.738).eGFRisanindependentriskfactorforCIN(OR=0.931, 95%CI0.910-0.952,P<0.01).Conclusion Less than 300 ml, with increasing the dose of contrast agent, the function of kidney injury severity is not increased; the near and middle term incidence of adverse events was not affected by the dose of contrast agent.
Contrast agent; Dosage; Percutaneous coronary intervention; Glomerular filtration rate; Creatinine; Adverse events
115100 辽宁省大石桥市中心医院介入科(谢建伟); 116011 大连医科大学附属第一医院心内科(朱皓、黄榕翀)
2014-11-24)

