东海低氧区及邻近水域浮游植物的季节变化
赵其彪,孙 军,*,李 丹,宣基亮
1 天津科技大学海洋科学与工程学院, 天津 300457 2 国家海洋局, 第二海洋研究所, 卫星海洋环境动力学国家重点实验室, 杭州 310012
东海低氧区及邻近水域浮游植物的季节变化
赵其彪1,孙 军1,*,李 丹1,宣基亮2
1 天津科技大学海洋科学与工程学院, 天津 300457 2 国家海洋局, 第二海洋研究所, 卫星海洋环境动力学国家重点实验室, 杭州 310012
根据2011年5月、8月、11月在东海低氧区及邻近水域 (25°00′—33°30′N, 120°00′—127°30′E) 进行的多学科综合调查,对东海低氧区及邻近水域浮游植物群落结构特征及季节变化进行了相关研究。经Utermöhl方法初步分析共鉴定出浮游植物4门74属248种(含变种、变型,不含未定种),主要由硅藻和甲藻组成,此外还有少量的金藻和蓝藻。春季优势种主要为具齿原甲藻(Prorocentrumdentatum)、柔弱伪菱形藻(Pseudo-nitzschiadelicatissim)、骨条藻(Skeletonemasp.)和具槽帕拉藻(Paraliasulcata);夏季主要是中肋骨条藻(Skeletonemacostatum)和海链藻(Thalassiosirasp.);秋季主要是具槽帕拉藻、圆筛藻(Coscinodiscussp.)和柔弱伪菱形藻。调查区浮游植物平均细胞丰度在夏季最高,达到85.002×103个/L,春季次之,秋季最低。在水平方向上,春、夏两季,表层浮游植物细胞丰度在近岸出现高值,由近岸到外海细胞丰度逐渐降低;而在秋季则相反,在调查海域的东北部出现高值,随离岸距离的增加细胞丰度逐渐增加。在垂直方向上,春、夏两季,浮游植物细胞丰度在表层出现最大值,随着深度的增加细胞丰度逐渐降低;而在秋季细胞丰度分布比较均匀,随水深变化不明显。调查区表层浮游植物 Shannon-Wiener 多样性指数和 Pielou 均匀度指数的平面分布基本一致,并且与细胞丰度的分布大致呈镶嵌分布。调查浮游植物群落的演替规律是:从春季的甲藻(具齿原甲藻、微小原甲藻(Prorocentrumminimum)等)为主,硅藻(柔弱伪菱形藻、骨条藻等)为辅;演替至夏季的硅藻(中肋骨条藻、海链藻等)为主,甲藻(主要是梭状角藻(Ceratiumfusus)和叉状角藻(Ceratiumfurca))为辅,到秋季进一步演替为硅藻(具槽帕拉藻、圆筛藻、柔弱伪菱形藻等)为主,铁氏束毛藻(Trichodesmiumthiebaultii)为辅。浮游植物物种组成、优势种、细胞丰度及多样性指数均表现出明显的时空变化。低氧区与非低氧区浮游植物群集存在明显差异。
浮游植物; 群落结构; 季节变化; 低氧区; 东海
Seasonal changes of the phytoplankton along hypoxia area and adjacent waters in the East China Sea
海水中的溶解氧与海洋生物的生长繁殖有着密切的关系,随着社会的发展,在人类影响较大的河口与近岸区域低氧已成为一种普遍现象[1- 4]。诸多研究表明,东海长江口外也存在着大面积低溶氧区,该低氧区从20世纪中叶的1800 km2增加到本世纪初的20000 km2,低氧面积呈增大趋势且低氧中心渐向北移[5- 11](图1),这必然对东海生态系统和渔业发展产生不可预计的后果。
浮游植物是海洋生态系统中最重要的初级生产者。对于东海浮游植物群落的研究从20世纪50年代开始,已开展了大量的工作[12- 22],但针对东海低氧区浮游植物群落的研究还较少[23],本文通过对东海低氧区及邻近水域2011年浮游植物群落及其动态变化等进行研究,以期为探明低氧区形成机制及改善其溶氧环境提供基础资料。
1 材料与方法
1.1 调查海域和站位
2011年5月(春季航次)、8月(夏季航次)和11月(秋季航次)在东海低氧区及邻近水域(25°00′—33°30′N, 120°00′—127°30′E)进行了海洋水文、化学和生物参数的综合外业调查,分别设置调查站位53、54和22个。由于3个航次调查范围不同,为增强可比性并能更好的研究低氧区浮游植物群落,本文综合考虑调查区历史低氧发生位置和3个航次调查范围,以低氧区(28°30′—32°10′N, 122°00′—125°00′)作为研究重点,并从该海域每个航次中选取过31°00′N的断面进行更进一步的研究(图1)。

图1 东海低氧区历史边界及2011年调查海域站位(其中历史低氧区边界分别重绘于1999年8月和2003年9月观测[8, 10])Fig.1 Historical boundary of hypoxia zone in East China Sea and sampling stations in 2011 (The boundaries were respectively redrew according to the observations in August 1999 and September 2003[8, 10])
1.2 样品采集与分析
浮游植物采样按照《海洋调查规范》[24]进行。根据水深设定标准采样层次采集各站位水样,取250 mL水样置于大口聚乙烯(PE)瓶中,立即加入中性甲醛溶液固定(终体积浓度为1%)。样品带回实验室后利用Utermöhl方法[25- 26]进行物种分类和数量统计。取25 mL浮游植物亚样品于Hydro-bios的Utermöhl计数框,静置沉降24 h后,在AO倒置显微镜200或400倍下进行物种鉴定与计数。细胞丰度的统计和误差处理参考孙军等[26]。温度、盐度等环境参数由Seabird 917plus CTD现场测得。浮游植物中文及拉丁文种名更改参考孙军等[27]。
1.3 浮游植物群落计算方法
浮游植物群落结构分析采用 Shannon-Wiener 多样性指数(H′)、 Pielou 均匀度指数(J)和优势度(Y),其计算公式如下[28- 31]:
Shannon-Wiener 多样性指数计算公式
式中,Pi是样品中第i种的个数与该样品总个数之比值;S为该样品物种数。
Pielou 均匀度指数计算公式
式中,S为样品物种数。
优势度计算公式
式中,ni为第i个种在所有样品中的个数;N为所有物种的个数;fi为该物种在各站位出现的频率。
2 结果与讨论
2.1 海区温盐特征
调查海区春季表层温度介于14.83—26.21 ℃之间,平均为19.84 ℃;表层盐度介于24.30—34.59之间,平均为32.31。调查海区温、盐参数主要受长江冲淡水等沿岸径流和黑潮等外海水系的共同影响,其中,近岸区域受长江冲淡水影响较显著,外海区特别是调查区东南部主要受黑潮等暖流水的影响。总体来说,温度呈南高北低的趋势,盐度呈东高西低的趋势。夏季表层温度介于22.02—28.85 ℃之间,平均为25.62 ℃;表层盐度介于22.25—33.99之间,平均为30.08。其平面分布与春季相似,温度呈南高北低的趋势,盐度呈东高西低的趋势。底层温度和盐度范围分别介于9.02—25.00 ℃和28.8—34.47之间,平均值分别为20.56 ℃和32.99,表、底温盐差异很大,层化明显。秋季表层温度介于17.68—21.45 ℃之间,平均为19.58 ℃;表层盐度介于27.21—33.89之间,平均为32.01。二者均呈近岸低、外海高的趋势。
为进一步了解低氧区的水文条件,分析了31°00′N断面的温度和盐度的分布情况。春季B断面在近岸温、盐度垂直分布比较均匀,在122°30′E以东海域温、盐度有轻微层化,温度随水深增加逐渐降低,而盐度随水深增加逐渐升高,且在B2、B3站位存在低温、高盐的台湾暖流深层水(温度17.4 ℃,盐度> 31)的抬升现象,这与赵保仁等的观测相符[32]。夏季D断面低温高盐的台湾暖流深层水(温度21.0 ℃,盐度> 31)的抬升现象有所加强,水体层化现象较春季进一步增强,强烈的温盐跃层是造成低氧现象发生的一个主要因素。温度随着水深的增加而逐渐降低,盐度随水深增加逐渐升高。秋季D断面温度和盐度的垂直分布比较均匀,从近岸向外海呈逐渐升高的趋势。
2.2 浮游植物物种组成
通过对914个浮游植物样品的分析,共鉴定出浮游植物4门74属248种(含变种、变型,不含未定种),其中硅藻门54属161种,甲藻门16属81种,金藻门3属5种,蓝藻门1属1种。硅藻和甲藻之和占所有物种数的97.58%,是调查海域的主要浮游植物功能群。浮游植物生态类型多为广温、广布型种,少数为暖水种或大洋种。春季物种丰富度最高,共鉴定出193种,夏季次之,为161种,秋季最低,为122种(表1)。3次调查均出现的物种有88种,占总物种数的35.48%,说明3个季节的物种组成存在明显的季节差异。调查区浮游植物优势物种列表2,调查区浮游植物优势物种存在明显的季节演替现象。
将研究范围缩小到低氧区附近海域后发现,低氧区浮游植物物种丰富度的季节变化与整个调查海域的变化不同。低氧区物种丰富度在夏季最高,春季最低(表1)。与整个调查区相比甲藻物种比例在春季有所增加,超过40%,在夏、秋两季差别不大。
2.3 浮游植物细胞丰度
浮游植物细胞总丰度在夏季最高,均值为85.002×103个/L,春季次之(66.937×103个/L),秋季最低(5.811×103个/L)(表1)。甲藻是春季浮游植物的主要类群,占总细胞丰度的74.91%。硅藻是夏、秋季浮游植物的主要类群,分别占总细胞丰度的98.47%和83.63%。

表1 调查区浮游植物种类组成和细胞丰度的季节变化Table 1 Seasonal changes of phytoplankton species composition and cell abundance in the surveyed area

表2 调查区浮游植物优势物种Table 2 Dominant species of phytoplankton in the surveyed area
* 种名更改参考孙军等[27];** 浮游植物优势物种优势度大于0.010
2.3.1 平面分布
春季,调查区表层浮游植物细胞丰度介于(0.178—1854.878)×103个/L,平均值为59.660×103个/L。浮游植物细胞丰度存在2个高值区,一个是受长江冲淡水影响的长江口近岸和闽浙沿岸海域,另一个位于台湾西北部海域(图2)。长江口近岸和闽浙沿岸海域高细胞丰度主要由具齿原甲藻(Prorocentrumdentatum)贡献,峰值出现在B3站位。台湾岛西北部海域细胞丰度最高值出现在T1站位,优势种主要是骨条藻(Skeletonemasp.)和旋链角毛藻(Chaetoceroscurvisetus)。观测区甲藻细胞丰度为53.422×103个/L,占表层浮游植物丰度的73.97%;硅藻细胞丰度仅为17.007×103个/L。表层硅藻细胞丰度高值主要集中在调查区西南部,优势种为柔弱伪菱形藻(Pseudo-nitzschiadelicatissim)、骨条藻、具槽帕拉藻(Paraliasulcata)等。
夏季,调查区表层浮游植物细胞丰度介于(0.178—7041.911)×103个/L,平均值为277.108×103个/L。高值区出现在长江口东南部和闽浙沿岸海域,由近岸向外海丰度逐渐降低(图2)。高细胞丰度主要由中肋骨条藻(Skeletonemacostatum)和海链藻(Thalassiosirasp.)贡献,在X1站位出现丰度峰值。硅藻丰度为274.354×103个/L,占表层浮游植物丰度的99.01%,其平面分布与总丰度的分布基本一致;其次为甲藻,平均值为2.755×103个/L,以纺锤(梭状)角藻(Ceratiumfusus)和叉状角藻(Ceratiumfurca)为主,细胞丰度相对较低,对浮游植物的分布影响不大。
秋季,调查区表层浮游植物细胞丰度介于(0.222—46.311)×103个/L,平均值为7.342×103个/L。高值区出现在调查区的东北部海域,由近岸向外海丰度逐渐增加(图2)。高细胞丰度主要由具槽帕拉藻和铁氏束毛藻(Trichodesmiumthiebaultii)贡献,在D3站位出现丰度峰值。硅藻丰度平均值为4.760×103个/L,占表层浮游植物丰度的64.84%;蓝藻门中的铁氏束毛藻占表层浮游植物丰度的32.96%,二者的平面分布决定了表层浮游植物细胞丰度分布的基本格局。

图2 调查海区表层浮游植物细胞丰度(×103 个/L)平面分布Fig.2 Horizontal distribution of phytoplankton cell abundance (×103 cells/L) in the surface water of the surveyed area
2.3.2 垂直分布
调查区浮游植物细胞丰度的垂直分布示图3。春季浮游植物细胞丰度随水深增加逐渐降低;甲藻是春季浮游植物的优势种群,因此其垂直分布决定了浮游植物丰度的垂向特征;而硅藻细胞丰度随水深增加先升高后降低,在25m层出现最大值,但由于丰度相对较低,对浮游植物丰度分布影响较小。夏季浮游植物总丰度及硅藻、甲藻丰度都在表层出现最大值,随水深增加而逐渐降低。秋季浮游植物总丰度及硅藻、甲藻丰度的垂直分布相对均匀,不同水层之间变化不大;硅藻在该季节是浮游植物的优势种群,因此其垂直分布决定了浮游植物丰度的垂向特征;甲藻在次表层出现最大值。

图3 调查海域浮游植物细胞丰度的垂直分布Fig.3 Vertical distribution of phytoplankton cell abundance in the surveyed area
2.3.3 断面分布
31°00′N断面浮游植物细胞丰度的分布示图4。春季,B断面浮游植物细胞丰度介于(0.133—1854.878)×103个/L,平均值为149.331×103个/L。甲藻是该断面浮游植物的主要优势种群,占总丰度的98.04%。浮游植物丰度高值出现在B3站位,优势种为具齿原甲藻;该断面细胞丰度从表层到底层呈逐渐降低趋势。夏季,D断面浮游植物细胞丰度介于(0.222—784.218)×103个/L,平均值为91.427 ×103个/L,硅藻占总丰度的99.52%,浮游植物在该断面出现两个丰度高值区,位于近岸的D1、D2、D3站位表层和外海的D7站位35m层,优势种均为中肋骨条藻。秋季,D断面浮游植物细胞丰度介于(0.222—46.311)×103个/L,平均值为9.401×103个/L。硅藻占总丰度的69.98%,浮游植物在该断面同样出现两个丰度高值区,D3与D5站位表层,优势种为铁氏束毛藻和具槽帕拉藻;相对来说该断面细胞丰度垂直分布比较均匀,且自西向东呈逐渐增加的趋势。

图4 调查海域浮游植物细胞丰度(×103 个/L)的断面分布Fig.4 Section distribution of phytoplankton cell abundance in the surveyed area
分析表明调查区浮游植物细胞丰度表现出明显的季节动态变化。将研究范围缩小到低氧区附近海域后发现,在低氧区及邻近水域浮游植物平均丰度在夏季最高,达到130.695×103个/L,秋季最低,与整个调查海域的变化相一致;但春、夏季平均丰度要比整个调查海域的要高得多,这主要是因为春、夏季低氧区附近海域是浮游植物丰度高值区(表1),高细胞丰度产生的颗粒态有机碳沉降到海底并在生物化学氧化过程中消耗大量溶解氧,是造成底层氧亏损的主要原因。低氧区附近海域细胞丰度平面分布也与整个调查海域的分布相似(图2)。春季低氧区附近海域丰度的垂直分布是在表层出现最大值,从表到底丰度先减小后增加,在夏、秋两季则与整个调查海域的分布基本一致。
2.4 优势种的时空分布
浮游植物优势种在调查海域存在明显的季节演替现象,各季度优势种的分布示图5。
具槽帕拉藻在整个调查期间都具有较高的优势度,且分布较广。在春季48个站位存在该物种,主要分布在近岸和东北部外海。在夏季49个站位出现该物种,主要分布在调查海域东北部。在秋季所有站位均存在该物种,主要分布在调查海域的东北部。
具齿原甲藻和微小原甲藻(Prorocentrumminimum)是春季常见赤潮原因物种。具齿原甲藻虽出现频率不高,但细胞丰度很高,在其出现水体中平均丰度高达303.818×103个/L,主要分布在长江口近岸和闽浙沿岸海域,该海域(27°25′—31°23′N, 120°80′—122°78′E)的5个测站(D2、B3、FE2、F1和FE1)发现具齿原甲藻赤潮,表层丰度均超过106个/L。近年来,该物种多次在杭州湾、长江口外海域和浙江沿岸发生春季水华[23,33- 34],已成为东海最常见的赤潮物种之一。微小原甲藻主要分布在调查海域的东北部和中部海域。
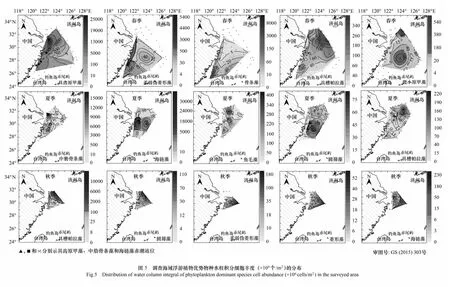
中肋骨条藻是夏季最主要的优势种,超过63%的站位存在该物种,在其出现水体中平均丰度高达127.882×103个/L,主要分布在长江口近岸和闽浙沿岸海域,在W1站位发生中肋骨条藻赤潮。
柔弱伪菱形藻和骨条藻是春、秋季两种比较重要的优势种。春季柔弱伪菱形藻和骨条藻因其细胞丰度较高,优势度很高。柔弱伪菱形藻主要分布在长江口和闽浙沿岸海域;骨条藻主要分布在台湾岛西北部海域,最高值出现在T1站位表层(467.055×103个/L)。秋季柔弱伪菱形藻主要分布在调查海域东南部,骨条藻主要分布在长江口近岸海域。
海链藻和圆筛藻是夏、秋季两种比较重要的优势种。夏季海链藻主要分布在调查海域中部,在X1站位发生海链藻赤潮;圆筛藻主要分布在调查海域东南部。秋季海链藻和圆筛藻均集中分布在调查区外海,前者主要分布在东南部海域,后者主要分布在东北部海域。
浮游植物优势种在调查海域存在明显的季节演替现象,只有具槽帕拉藻在整个调查期间都具有较高的优势度(表2和图5)。春季优势种以具齿原甲藻和微小原甲藻等甲藻为主,柔弱伪菱形藻、骨条藻和具槽帕拉藻等硅藻为辅。夏季,主要优势种演替为中肋骨条藻、海链藻等硅藻,甲藻只有极少数物种(如梭状角藻和叉状角藻)优势度相对较高。秋季,主要优势种演替为具槽帕拉藻、圆筛藻、柔弱伪菱形藻等硅藻,铁氏束毛藻也有一定的优势度。
2.5 群落多样性的平面分布
群落多样性是衡量群落稳定性的一个重要指标,通常与两个参数密切相关,即物种丰富度和物种均匀度;本文采用 Shannon-Wiener 多样性指数和 Pielou 均匀度指数对浮游植物的群落结构进行综合分析,前者多用于反映群落结构的复杂程度,而后者能较好地反映群落的均匀度[28]。调查海域表层浮游植物群落的 Shannon-Wiener 多样性指数和 Pielou 均匀度指数平面分布如图6所示。

图6 调查海域表层浮游植物群落 Shannon-Wiener 多样性指数和 Pielou 均匀度指数平面分布Fig.6 Horizontal distribution of Shannon-Wiener diversity index and Pielou evenness index in the surface water of the surveyed area
春季,调查海域表层多样性指数平均值为1.863,高值出现在台湾岛东北部海域,最高值出现在FX站位(4.22)。这些站位的共同特点是受上升流携带的营养盐影响,浮游植物物种数多,但不存在显著优势种,各物种丰度相差不大,群落结构比较复杂。低值位于长江口近岸以及调查海域的东北部,长江口近岸是具齿原甲藻占优势,东北部是微小原甲藻,优势种单一且优势度较大导致了群落多样性降低。夏季,表层多样性指数平均值为1.825,高值出现在调查海域的西南部和东北部,最高值出现在G1站位(3.88)。虽然调查区东北部海域丰度比西南部海域要低,但这两个海区浮游植物物种数均较多,且各物种丰度相差不大,因而多样性指数值都较高。低值主要集中在长江口近岸以及调查海域的东南部,前者是中肋骨条藻、海链藻占优势,后者是铁氏束毛藻。秋季表层多样性指数平均值为2.275,高值出现在调查海域的东南部。低值主要集中在长江口近岸海域,该海域铁氏束毛藻、具槽帕拉藻、骨条藻等物种优势度较高,造成物种多样性较低。表层 Pielou 均匀度指数平均值分别为0.613(春季)、0.535(夏季)和0.653(秋季),其平面分布与 Shannon-Wiener 多样性指数的平面分布基本一致。
2.6 春、夏季低氧区与非低氧区浮游植物的比较
春、夏季低氧区与非低氧区的浮游植物分布表现出明显的差异。非低氧区浮游植物物种丰富度和细胞丰度平均值均是春季高于夏季,而低氧区则均是夏季高于春季(表1)。低氧区浮游植物细胞丰度明显高于非低氧区,夏季非低氧区浮游植物细胞丰度平均值仅为低氧区的7.48%(表1,图2,图4)。两区硅藻和甲藻对总细胞丰度的贡献也有较大差异,春季非低氧区甲藻占总细胞丰度的比例较低氧区下降了38.06%,夏季非低氧区硅藻丰度比例下降了18.30%。低氧区浮游植物优势种组成与非低氧区也表现出明显差异,在春季两区优势度前三的共有优势种唯有具齿原甲藻,在夏季唯有中肋骨条藻(表3)。低氧区浮游植物多样性指数平均值均低于非低氧区(表3)。
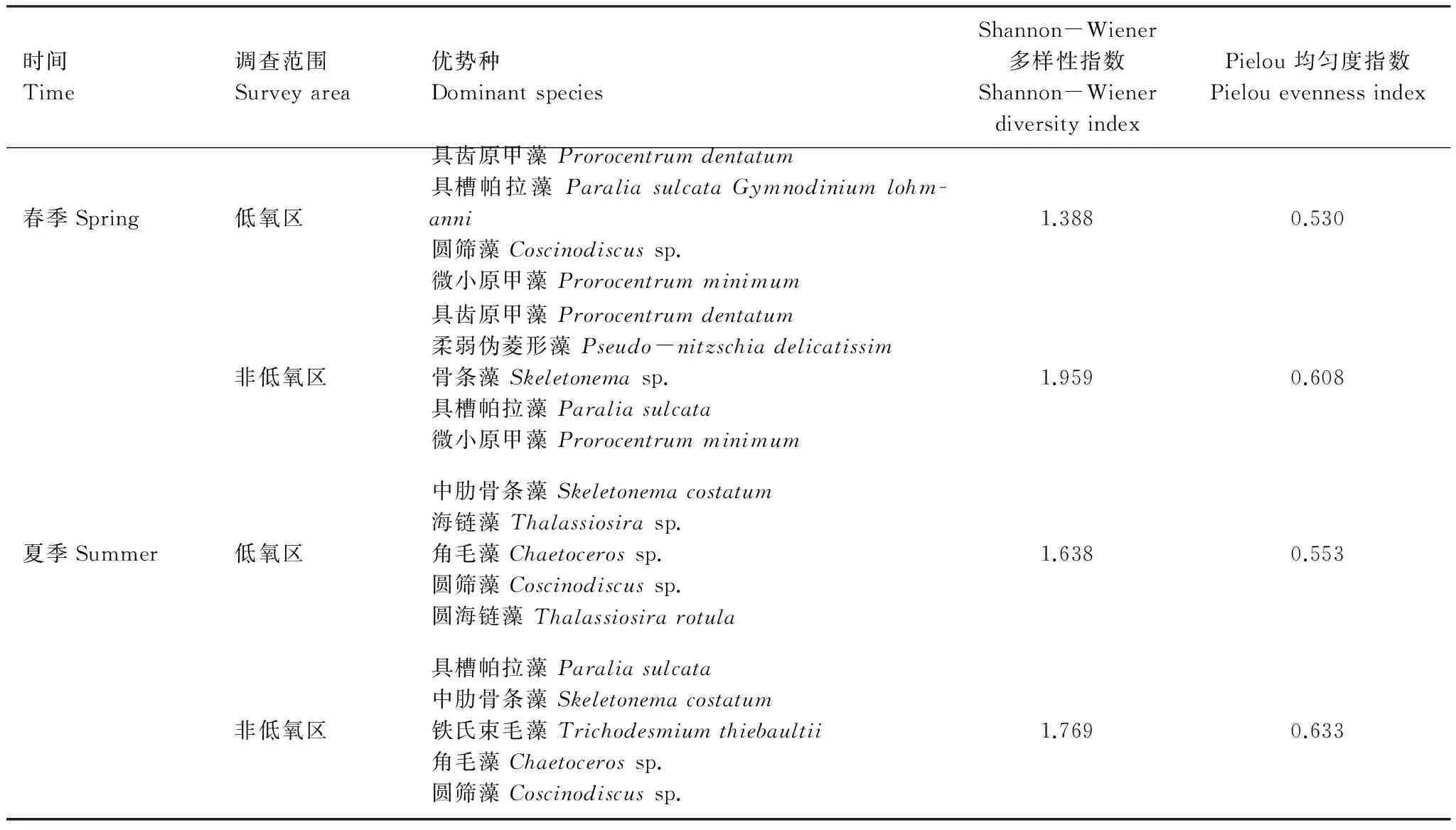
表3 低氧区与非低氧区浮游植物优势种和多样性指数的比较Table 3 Comparison of phytoplankton dominant species and diversity index in the hypoxia area and non-hypoxia area
2.7 与历史资料的比较
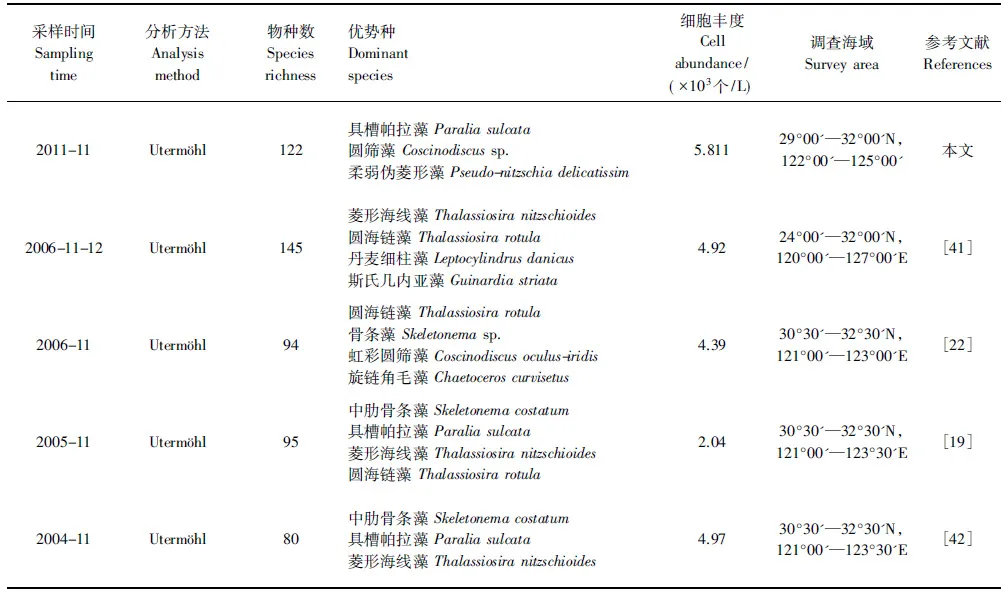
与历史资料比较后发现本次调查所获浮游植物优势种、细胞丰度资料与历史资料季节变化基本一致,但也有个别季度差别较大。本次调查除骨条藻、具齿原甲藻、具槽帕拉藻、柔弱伪菱形藻和菱形海线藻(Thalassionemanitzschioides)等东海常见优势种外,微小原甲藻、梭状角藻也作为优势种出现,且往年只在秋冬季作为优势种的具槽帕拉藻在调查期间优势度都较高(表2,表4)。春、夏季浮游植物细胞丰度波动较大,2011年春、夏季平均细胞丰度与2006年相比均降低了55%,而秋季细胞丰度相差不大。2011年长江流域降雨量是33年来最少的一年,导致随长江径流量入海的营养盐的减小,可能是造成上述现象的主要原因,顾新根等人的研究成果也表明长江口外浮游植物丰水期的数量明显大于枯水期的数量[35]。

表4 调查海域浮游植物物种丰富度、优势物种组成及细胞丰度与历史资料的比较Table 4 Comparison of species richness, dominant species and cell abundance among the historical data in the surveyed area
续表
3 结论
2011年东海低氧区及其邻近水域的浮游植物群集主要由硅藻和甲藻组成,春季以甲藻为主,夏、秋季以硅藻为主。调查区浮游植物平均细胞丰度在夏季最高,达到85.002×103个/L,秋季最低。在水平方向上,春、夏两季,表层细胞丰度在近岸出现高值,由近岸到外海细胞丰度逐渐降低;秋季则是在调查海域的东北部出现高值,随离岸距离的增加细胞丰度逐渐增加。在垂直方向上,春、夏两季,细胞丰度在表层出现最大值,随着深度的增加逐渐降低;而在秋季细胞丰度分布比较均匀,随水深变化不明显。调查区多样性指数在秋季最高,平均值分别为2.500和0.692,夏季最低。物种组成和优势种组成季节差异明显,浮游植物群落的演替规律是:从春季的甲藻-硅藻型、夏季的硅藻-甲藻型演变为秋季的硅藻-蓝藻型。低氧区与非低氧区浮游植物群集存在明显差异。
由于东海低氧区及邻近水域浮游植物群集及溶解氧特征在不同季节、不同年份之间存在较大差异,想要更深入的了解浮游植物群集与低氧区的关系,还需要应用Utermöhl方法对长江口低氧区浮游植物群落进行长期的分析和积累。
致谢:郭术津参与现场浮游植物样品的采集工作,特此致谢。
[1] Rabalais N N, Turner R E, Scavia D. Beyond science into policy: Gulf of Mexico hypoxia and the Mississippi River. BioScience, 2002, 52(2): 129- 142.
[2] Westernhagen H V, Hickel W, Bauerfeind E, Nierman U, Kröncke I. Sources and effects of oxygen deficiencies in the south-eastern North Sea. Ophelia, 1986, 26(1): 457- 473.
[3] Oguz T. Hypoxia and anoxia in the Black Sea. Geophysical Research Abstracts, 2006, 8: 4829.
[4] Lim H S, Diaz R J, Hong J S, Schaffner L C. Hypoxia and benthic community recovery in Korean coastal waters. Marine Pollution Bulletin, 2006, 52(11): 1517- 1526.
[5] 顾宏堪. 黄海溶解氧垂直分布的最大值. 海洋学报, 1980, 2(2): 70- 79.
[6] 张竹琦. 黄海和东海北部夏季底层溶解氧最大值和最小值特征分析. 海洋通报, 1990, 9(4): 22- 26.
[7] Tian R C, Hu F X, Martin J M. Summer nutrient fronts in the Changjiang (Yangtze River) Estuary. Estuarine, Coastal and Shelf Science, 1993, 37(1): 27- 41.
[8] Li D J, Zhang J, Huang D J, Wu Y, Liang J. Oxygen depletion off the Changjiang (Yangtze River) Estuary. Science in China Series D, 2002, 45(12): 1137- 1146.
[9] Chen C C, Gong G C, Shiah F K. Hypoxia in the East China Sea: One of the largest coastal low-oxygen areas in the world. Marine Environmental Research, 2007, 64(4): 399- 408.
[10] Wei H, He Y C, Li Q J, Liu Z Y, Wang H T. Summer hypoxia adjacent to the Changjiang Estuary. Journal of Marine Systems, 2007, 67(3/4): 292- 303.
[11] 朱卓毅. 长江口及邻近海域低氧现象的探讨-以光合色素为出发点 [D]. 上海: 华东师范大学, 2007.
[12] 郭玉洁, 杨则禹. 1976年夏季东海陆架区浮游植物生态的研究. 海洋科学集刊, 1982, 19: 11- 32.
[13] 俞建銮, 张子云, 程兆第. 东海大陆架浮游硅藻的分布. 海洋学报, 1983, 5(4): 519- 525.
[14] 毛兴华, 李瑞香. 东海北部陆架区浮游甲藻的分布及其生态特征. 海洋学报, 1984, 6(5): 672- 677.
[15] 钱树本, 陈国蔚. 长江口及济州岛邻近海域综合调查研究报告. 山东海洋学报, 1986, 16(2): 26- 55.
[16] 郭玉洁, 杨则禹. 长江口浮游植物的数量变动及生态分析. 海洋科学集刊, 1992, 33: 167- 189.
[17] 林金美. 东海浮游甲藻类的分布. 海洋学报, 1994, 16(2): 110- 115.
[18] Furuya K, Kurita K, Odate T. Distribution of phytoplankton in the East China Sea in the winter of 1993. Journal of Oceanography, 1996, 52(3): 323- 333.
[19] 栾青杉, 孙军. 2005年秋季长江口及其邻近水域浮游植物群集. 长江流域资源与环境, 2010, 19(2): 202- 208.
[20] 何青, 孙军, 栾青杉, 俞志明. 冬季长江口及其邻近水域的浮游植物. 海洋环境科学, 2009, 28(4): 360- 365.
[21] 赵冉, 白洁, 孙军, 王丹, 何青. 2006年夏季长江口及其邻近水域浮游植物群集. 海洋湖沼通报, 2009, (2): 88- 96.
[22] 赵冉, 孙军, 白洁. 2006年秋季长江口及其邻近水域浮游植物群集. 海洋科学, 2010, 34(4): 32- 39.
[23] 王丹, 孙军, 周锋, 吴莹. 2006年6月长江口低氧区及邻近水域浮游植物. 海洋与湖沼, 2008, 39(6): 619- 627.
[24] 中国国家标准化管理委员会. GB/T 12763. 6- 2007 海洋调查规范-海洋生物调查. 北京: 中国标准出版社, 2008.
[25] Utermöhl H. Zur vervollkommnung der quantitativen phytoplankton-methodik. Mitteilung Internationalen Verinigung für Theoretische Limnologie, 1958, 9: 1- 38.
[26] 孙军, 刘东艳, 钱树本. 一种海洋浮游植物定量研究分析方法 - Utermöhl方法的介绍及其改进. 黄渤海海洋, 2002, 20(2): 105- 112.
[27] 孙军, 刘东艳. 中国海区常见浮游植物种名更改初步意见. 海洋与湖沼, 2002, 33(3): 271- 286.
[28] 孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用. 海洋学报, 2004, 26(1): 62- 75.
[29] Shannon C E, Weaver W. The Mathematical Theory of Communication. Urbana IL: University of Illinois Press, 1949: 1- 117.
[30] Pielou E C. An Introduction to Mathematical Ecology. New York: Wiley-Interscience, 1969: 1- 286.
[31] 孙儒泳. 动物生态学原理(第二版). 北京: 北京师范大学出版社, 1992: 356- 357.
[32] 赵保仁. 长江口外的上升流现象. 海洋学报, 1993, 15(2): 108- 114.
[33] 田伟, 孙军, 樊孝鹏, 汪岷. 2008年春季东海近海浮游植物群落. 海洋科学进展, 2010, 28(2): 170- 178.
[34] 朱根海, 许卫忆, 朱德第, 施青松, 张健. 长江口赤潮高发区浮游植物与水动力环境因子的分布特征. 应用生态学报, 2003, 14(7): 1135- 1139.
[35] 顾新根, 袁骐, 杨焦文, 华棣. 长江口羽状锋区浮游植物的生态研究. 中国水产科学, 1995, 2(1): 1- 15.
[36] 孙军, 田伟. 2009年春季长江口及其邻近水域浮游植物——物种组成与粒级叶绿素a. 应用生态学报, 2011, 22(1): 235- 242.
[37] 谭书杰, 宫相忠, 孙军, 倪晓波, 宋书群, 何青. 春季东海产卵场及其邻近海域的浮游植物群落. 海洋科学, 2009, 33(8): 5- 10.
[38] 郭术津, 田伟, 戴民汉, 刘志亮, 孙军. 2009年夏季东海浮游植物群集. 海洋科学进展, 2011, 29(4): 474- 486.
[39] 栾青杉, 孙军. 2005年夏季长江口水域浮游植物群集特征及其与环境因子的关系. 生态学报, 2010, 30(18): 4967- 4975.
[40] Luan Q S, Sun J, Shen Z L, Song S Q, Wang M. Phytoplankton assemblage of Yangtze River Estuary and the adjacent East China Sea in Summer, 2004. Journal of Ocean University of China (Oceanic and Coastal Sea Research), 2006, 5(2): 123- 131.
[41] 王丹, 孙军, 安佰正, 倪晓波, 刘素美. 2006年秋季东海陆架浮游植物群集. 应用生态学报, 2008, 19(11): 2435- 2442.
[42] 栾青杉, 孙军, 宋书群, 沈志良. 2004年秋季长江口及其邻近水域浮游植物群集. 海洋科学进展, 2008, 26(3): 364- 371.
ZHAO Qibiao1, SUN Jun1,*, LI Dan1, XUAN Jiliang2
1CollegeofMarineScienceandEngineering,TianjinUniversityofScienceandTechnology,Tianjin300457,China
2StateKeyLaboratoryofSatelliteOceanEnvironmentDynamics,SecondInstituteofOceanography,StateOceanicAdministration,Hangzhou310012,China
A multidisciplinary comprehensive survey was carried out in hypoxia area and adjacent waters in the East China Sea (25°00′—33°30′N, 120°00′—127°30′E) from May to November 2011. The phytoplankton community structure and seasonal variation were reported in this paper. Water samples were analyzed by means of Utermöhl method. A total of 248 taxa which belong to 74 genera of 4 phyla were identified (including varieties and forms, don′t include uncertain species). Bacillariophyta and Dinophyta were the dominant phytoplankton groups in the survey area, and there were also found a few species belonging to Chrysophyta and Cyanophyta. Most of phytoplankton taxa found in the survey area was temperate coastal species, at the same time, some warm water species and oceanic species were occasional found. In spring, Dinophyta was the most dominant phytoplankton group and the dominant species wereProrocentrumdentatum,Pseudo-nitzschiadelicatissim,Skeletonemasp. andParaliasulcata. In summer, the most dominant phytoplankton group changed to Bacillariophyta and the dominant species wereSkeletonemacostatumandThalassiosirasp.. In autumn, Bacillariophyta was also the most dominant phytoplankton group and the dominant species wereParaliasulcata,Coscinodiscussp. andPseudo-nitzschiadelicatissim. The phytoplankton cell abundance was decreased in turn from summer (85.002×103cells/L), spring (66.937×103cells/L) to autumn (5.811×103cells/L) in the survey area. Horizontally, the surface distribution of phytoplankton cell abundance in the survey area was relatively high in the inshore area and decreased slightly from inshore area to offshore area in spring and summer. On the contrary, the cell abundance was relatively high in the northeast of the survey area and increased slightly from inshore area to offshore area in autumn. Vertically, the cell abundance of phytoplankton was concentrated in surface water and decreased slightly with depth from surface to bottom in spring and summer, while the vertical distribution of phytoplankton cell abundance wasn′t obvious with depth change in autumn. The surface distribution of Shannon-Wiener diversity index and Pielou evenness index was generally consistent, and the diversity indexes were low in the area with high cell abundance. The maximum of these two kinds of index was all appeared in autumn and decreased in turn from autumn, summer to spring. The succession trend of the phytoplankton dominant species in this survey changed from Dinophyta-Bacillariophyta type in spring, Bacillariophyta-Dinophyta type in summer to Bacillariophyta-Cyanophyta type in autumn. Namely, the phytoplankton dominant species was mainly composed of Dinophyta (Prorocentrumdentatum,Prorocentrumminimumetc.) and coexisted with a small amount of Bacillariophyta (Pseudo-nitzschiadelicatissim,Skeletonemasp. etc.) in spring. In summer, it was mainly composed of Bacillariophyta (Skeletonemacostatum,Thalassiosirasp. etc.) and coexisted with Dinophyta (mainly includedCeratiumfususandCeratiumfurca). In autumn, it was mainly composed of Bacillariophyta (Paraliasulcata,Coscinodiscussp. andPseudo-nitzschiadelicatissimetc.) and coexisted with Cyanophyta (Only includedTrichodesmiumthiebaultii). Phytoplankton species composition, dominant species, cell abundance and diversity index had pronounced spatial and temporal variation in hypoxia area and adjacent waters in the East China Sea. Phytoplankton assemblage in hypoxia area and non-hypoxia area showed a significant difference.
phytoplankton; community structure; seasonal variation; hypoxia area; East China Sea
国家重点基础研究发展规划项目(2011CB409804); 海洋公益项目(201105021- 03); 新世纪优秀人才支持计划(NCET- 12- 1065); 国家自然科学基金(41176136, 41276124)
2013- 05- 31;
日期:2014- 05- 08
10.5846/stxb201306021273
*通讯作者Corresponding author.E-mail: phytoplankton@163.com
赵其彪,孙军,李丹,宣基亮.东海低氧区及邻近水域浮游植物的季节变化.生态学报,2015,35(7):2366- 2379.
Zhao Q B, Sun J, Li D, Xuan J L.Seasonal changes of the phytoplankton along hypoxia area and adjacent waters in the East China Sea.Acta Ecologica Sinica,2015,35(7):2366- 2379.

