2013-2014年我国东北地区猪繁殖与呼吸综合征病毒GP5和NSP2基因遗传变异分析
常晓博,叶超,赵款,姜成刚,王淑杰,蔡雪辉,张辉,安同庆*
(1. 吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,哈尔滨 150001)
2013-2014年我国东北地区猪繁殖与呼吸综合征病毒GP5和NSP2基因遗传变异分析
常晓博1,2,叶超2,赵款2,姜成刚2,王淑杰2,蔡雪辉2,张辉1*,安同庆2*
(1. 吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,哈尔滨 150001)
为了解2013-2014年我国东北地区猪繁殖与呼吸综合征病毒(PRRSV)的遗传变异情况,研究对东北地区3个省份29个地区采集的123份样品进行了检测,并对20份阳性样品的GP5和部分NSP2基因进行了RT-PCR扩增、测序、遗传进化及序列比对分析。结果表明:我国东北地区PRRSV阳性率为16%,与国内外已发表的10株PRRSV参考株相比,GP5基因的核苷酸同源性为84.4%~100%。GP5氨基酸序列分析表明,大多数毒株在氨基酸高变区、中和表位和诱导表位发生了变异,主要变异为:C24→Y24,F25→L25,V27→A27,L28→I28,N34→G34/S34/D34。LN283株GP5和NSP2基因遗传进化树的不同结果表明,LN283株可能涉及PRRSV基因重组。HLJ13株NSP2基因PCR扩增产物有2条相差90 bp的目的条带,且NSP2基因遗传进化树显示两条序列分别属于CH-1a亚群和HuN4亚群,推断HLJ13株可能为经典和高致病性混合感染株。GP5和NSP2遗传进化及氨基酸序列分析结果表明,所有病毒株均属于北美洲型,且以HP-PRRSV为主,经典株与变异株共存。本研究结果可为我国东北地区PRRSV遗传进化研究及疫病防控提供参考。
PRRSV;GP5;NSP2;遗传变异
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS)是一种广泛流行且严重影响养猪业健康发展的以繁殖障碍和呼吸道症状为特征的传染病[1-2],该病病原为猪繁殖与呼吸综合征病毒(PRRS virus, PRRSV)。根据抗原性差异,PRRSV可分为两个血清型:基因Ⅰ型和基因Ⅱ型。目前该病在世界各主要养猪国家均有发生,我国主要流行株为基因Ⅱ型,即北美洲型[4]。
PRRSV在自然界和免疫压力下极易发生变异和基因重组,其毒力由多基因控制,并且存在于病毒的结构蛋白和非结构蛋白中。PRRSV基因组中,ORF5是高变区之一,其编码的GP5蛋白是最主要的保护性抗原蛋白[5],并且具有受体识别作用和诱导细胞凋亡的功能[6]。PRRSV编码的非结构蛋白中,NSP2最易发生变异和缺失。欧洲型和北美洲型NSP2高变区氨基酸缺失的报道[7]表明NSP2对于病毒的复制不具有决定性作用但在宿主免疫方面可能具有至关重要的作用。Kappes等[8]通过免疫电子显微技术观察到NSP2与PRRSV的病毒粒子相关;通过蛋白质印迹分析得到NSP2以多种亚型参与了病毒粒子的构成。在PRRSV基因组中GP5和NSP2基因是最易发生变异的,因此针对GP5和NSP2基因变异的研究可以在一定程度上反应PRRSV整个基因组的变异情况。
本研究对东北地区3个省份29个地区的123株PRRSV进行PT-PCR检测,并对20株阳性样品GP5和NSP2基因进行了遗传进化及序列分析,从而了解2013-2014年东北地区PRRSV的遗传变异情况,为东北PRRSV的防制及分子流行情况提供一定的实验数据。
1 材料和方法
1.1 材料
1.1.1 病料样品 来源于我国东北地区3个省份29个地区中小型规模化猪场送检的猪的肺脏、淋巴结、肾脏和脾脏。
1.1.2主要试剂 QIAamp Viral RNA Mini Kit购自QIAGEN公司;EasyPure Viral DNA/RNA Kit、EasyScript One-Step RT-PCR SuperMix购自北京全式金生物技术有限公司;Reverse Transcriptase M-MLV、Recombinant RNase Inhibitor、TaKaRa EX Taq Hot Start Version、pMD18-T Vector Kit、E.coliDH5a感受态均购自宝生物工程(TaKaRa)有限公司;胶回收试剂盒购自OMEGA公司。
1.2 方法
1.2.1 引物设计 根据GenBank中已登录的国内外经典PRRSV毒株NSP2和GP5序列的保守区,以HuN4(GenBank no. EF635006)为模板,设计并合成了扩增部分NSP2基因和完整GP5基因的特异性引物(表1)。

表1 NSP2和GP5的扩增引物
1.2.2 病料处理与RT-PCR鉴定 取猪的肺脏、脾脏和淋巴结等组织剪碎、研磨、制成匀浆,反复冻融3次,以8000 r/min离心3 min,取200 uL上清液按照EasyPure Viral DNA/RNA Kit说明书提取病毒RNA,然后按照EasyScript One-Step RT-PCR SuperMix操作说明对所检病料进行PRRSV鉴定。
1.2.3 PRRSV阳性样品GP5和NSP2基因的扩增与测序 按照QIAamp Viral RNA Mini Kit操作手册提取PRRSV阳性样品总RNA,反转录成cDNA后用于全长GP5和部分NSP2基因的扩增。利用胶回收试剂盒回收PCR扩增产物并与pMD18-T载体16 ℃过夜连接,转化并筛选重组阳性质粒,每个片段选取5个单克隆菌落,重复进行3次测序。
1.2.4 GP5和NSP2基因序列的遗传进化分析 应用生物学分析软件DNAStar中的Megalign软件对20株PRRSV毒株及参考毒株进行序列比对及同源性分析,应用MEGA5.2软件对扩增的GP5和NSP2核苷酸序列进行遗传进化分析。
2 结果
2.1 PRRSV的RT-PCR鉴定 本研究对2013-2014年东北地区3个省份29个地区的123份疑似PRRSV感染猪的病料样品进行了RT-PCR鉴定,结果显示:123份病料样品中有20份阳性样品,PRRSV阳性率为16%。
2.2 GP5和NSP2基因片段的扩增与序列测定 利用设计的2对特异性引物分别扩增20株PRRSV阳性样品的GP5和NSP2基因,PCR产物与pMD18-T载体连接、转化,筛选重组阳性质粒并测序。测序结果显示,所有毒株GP5基因扩增产物均为711 bp,19株病毒株的部分NSP2基因扩增产物为762 bp,其中HLJ13株NSP2基因PCR扩增产物有两条目的条带,分别为762 bp和852 bp。
2.3 GP5遗传进化分析2.3.1 GP5基因遗传进化树及同源性分析 GP5基因遗传进化树结果显示,所有毒株均属于北美洲型,其中18株属于高致病性PRRSV(HP-PRRSV),与HuN4和JXA1同属于一个亚群,2株(HLJ13和LN283)属于经典PRRSV,与国内经典株CH-1a同属于一个亚群(图1)。
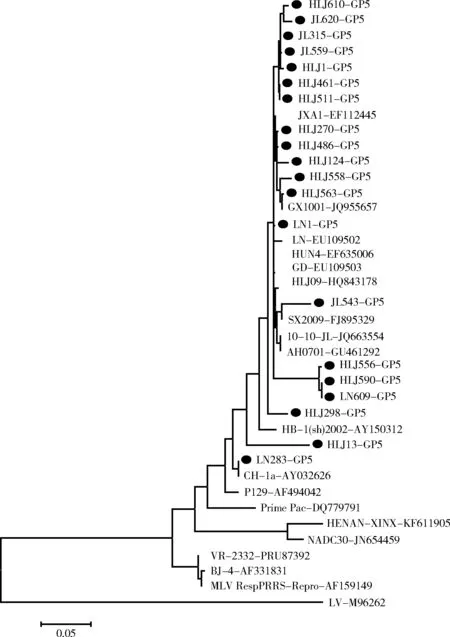
黑色圆点(●):测序株图1 GP5基因的遗传进化树
与国内外已发表的10株PRRSV进行同源性分析发现,GP5基因核苷酸同源性为84.4%~100%,推导的氨基酸同源性为83.1%~100%;与经典株CH-1a、VR-2332株相比,核苷酸同源性为86.2%~100%,氨基酸同源性为85.1%~100%;与HP-PRRSV中的代表株HuN4和JXA1株的核苷酸同源性为91.5%~99.8%,氨基酸同源性为90%~99.5%;与疫苗株MLV RespPRRS/Repro和Prime Pac相比,核苷酸同源性为85.9%~92.7%,氨基酸同源性为84.1%~94.5%。2.3.2 GP5蛋白氨基酸序列分析 GP5测序结果显示,所有毒株的GP5基因全长均为603 bp,编码200个氨基酸,不存在氨基酸的缺失和插入。应用Megalign软件对这21株病毒株GP5基因进行序列比对分析,与CH-1a、VR-2332和HuN4相比,部分毒株GP5蛋白在氨基酸高变区、中和表位和诱导表位存在多处氨基酸的变异(图2),主要变异位点为C24→Y24,F25→L25,V27→A27,L28→I28,N34→G34/S34/D34。
2.4 NSP2遗传进化分析
2.4.1 NSP2基因遗传进化树及同源性分析 NSP2基因遗传进化树结果显示,与国内外已发表的18个参考株相比,所研究的20个毒株的NSP2,19个与HUN4和JXA1同属于HP-PRRSV亚群,HLJ13-NSP2-762和LN283属于HuN4亚群,而HLJ13-NSP2-852与国内经典株CH-1a同属于一个亚群(图3)。将这20个NSP2基因与国内外已发表的10株PRRSV进行同源性分析发现,NSP2基因的核苷酸同源性为67.1%~99.8%,氨基酸同源性为54.4%~99.3%。与CH-1a相比,核苷酸同源性为85.8%~90.7%,推导的氨基酸同源性分别为79.9%~87.4%;与经典株VR-2332相比,核苷酸同源性为75.9%~79.6%,氨基酸同源性为67.8%~71.1%;与HP-PRRSV株HuN4和JXA1相比,20株病毒株的核苷酸具有90.4%~99.8%高度同源性。
2.4.2 NSP2蛋白氨基酸序列分析 NSP2氨基酸序列比对分析显示:与CH-1a、VR-2332和HuN4相比,HLJ13NSP2-852不存在氨基酸的缺失和插入现象;HLJ1、HLJ13-NSP2-762、HLJ124、HLJ270、HLJ298、HLJ461、HLJ486、HLJ511、HLJ556、HLJ558、HLJ563、HLJ590、HLJ610、JL315、JL543、JL559、JL620、LN1、LN283、LN609与HuN4和JXA1一样在481位缺失一个氨基酸,在532~560处缺失29个氨基酸,除此之外HLJ558在487~490处还缺失4个氨基酸(图4)。

黑色三角(▲):测序株图3 NSP2基因的遗传进化树
3 讨论与小结
3.1 GP5遗传衍变特征 GP5是重要的糖基化蛋白,也是变异最为显著的结构蛋白[9]。GP5基因遗传进化结果显示,本研究测序鉴定的病毒株均属于北美洲型毒株,所研究的20个病毒株中,18株属于HP-PRRSV,HLJ13株和LN283株属于经典PRRSV。GP5氨基酸序列分析表明,与经典株CH-1a、VR-2332和高致病性株HuN4相比,本实验所研究的GP5在邻近信号肽序列外区近端的氨基酸高变区[10](aa24~aa39)、中和抗原表位(aa37~aa45)和诱导表位(aa27~aa30)存在氨基酸的变异。HuN4亚群的18个病毒株的GP5氨基酸C24F25→Y24F25,HLJ13株L28→I28,HLJ486株L28→P28;与CH-1a相比,HLJ556、HLJ590、JL543、JL620、LN609的GP5氨基酸V29→A29;部分毒株氨基酸N34→D34/S34/G34。HLJ13株和LN283株的aa39与经典株CH-1a一样,aa39为F39,其余均为I39。aa34是糖基化位点,它的变异可能导致部分毒株失去一个糖基化位点且aa34的突变可能会影响病毒颗粒的产生和病毒的感染性从而引起病毒效价下降[11]。
3.2 NSP2遗传衍变特征 NSP2是具有高度免疫原性的非结构蛋白,NSP2的变异主要表现为氨基酸的缺失与插入。Shen等[12]于2000年首次报道与VR-2332相比,PRRSV北美洲型SP株在813~814处插入了36个氨基酸。2006年中国暴发的以高热、高发病率、高死亡率为特征的高致病性PRRSV(HP-PRRSV),NSP2分别在481位和532~560处缺失30个氨基酸[13]。2014年Choi等[14]研究韩国PRRSV分离株NSP2存在392和393个核苷酸的缺失。有报道表明NSP2的缺失可能在宿主免疫方面具有至关重要的作用[7]。20个病毒株NSP2遗传进化及氨基酸序列比对分析显示:与CH-1a、VR-23323和HuN4相比,HLJ13-NSP2-852不存在氨基酸的缺失和插入现象,属于CH-1a经典亚群,HLJ13-NSP2-762则属于HP-PRRSV亚群。与LN283-GP5属于经典PRRSV不同,LN283-NSP2和其余17个病毒株的NSP2与HP-PRRSV代表株HuN4和JXA1高度同源,且均存在30个不连续氨基酸的缺失,除此之外HLJ558在487~490处还缺失4个氨基酸。由于HLJ13-NSP2-762和HLJ-13-852分别处于不同的亚群,HLJ13株可能为经典和高致病性混合感染株。LN283株GP5和NSP2基因遗传进化树的不同结果表明,LN283株可能涉及PRRSV基因组重组。因此,HLJ13和LN283株的遗传变异情况需要我们进行进一步的探索和研究。
猪繁殖与呼吸综合征是影响我国乃至世界养猪业健康、持续发展的重要传染病之一。20个病毒株GP5和部分NSP2基因的遗传进化及序列比对分析结果表明我国东北地区PRRSV具有更为复杂的遗传多样性。而且,在自然界和免疫压力下,PRRSV的变异速度有所增加。因此,对东北地区PRRSV分子流行病学的调查和监测有助于及时发现和防治新型PRRSV,为我国PRRSV防控提供重要的参考依据。
[1] Cavanagh D. Nidovirales: a new order comprisingCoronaviridaeandArteriviridae[J]. Arch Virol,1997, 142(3): 629-633.
[2] Meulenberg J J, Hulst M M, de Meijer E J,etal.Lelystad virus, the causative agent of porcine epidemic abortion and respiratory syndrome (PEARS), is related to LDV and EAV [J]. Virology, 1993, 192(1): 62-72.
[3] 郭宝清,陈章水,刘文兴,等. 从疑似PRRSV感染的流产胎儿分离PRRSV的研究[J]. 中国畜禽传染病, 1996,2:1-4.
[4] 朱佳毅, 任晓峰. 猪繁殖与呼吸综合征病毒检测方法的研究进展[J].中国预防兽医学报, 2014,36(1):77-80.
[5] Pirzadeh B, Dea S. Monoclonal antibodies to the ORF5 product of porcine reproductive and respiratory syndrome virus define linear neutralizing determinants[J]. J Gen Virol, 1997,78(8): 1867-1873.
[6] Weiland E, Wleezorek-Krohmer M, Kohl D,etal. Monoclonal antibodies to the GP5 of porcine reproductive and respiratory syndrome virus is more effective in virus neutralization than monoclonal antibodies to the GP4 [J]. Vet Microbiol, 1999,66(3): 171-186.
[7] Rascon-Castelo E, Burgara-Estrella A, Mateu E,etal. Immunological features of the non-structural proteins of porcine reproductive and respiratory syndrome virus[J]. Viruses, 2015, 7(3):873-886.
[8] Kappes M A, Miller C L,Faaberg K S.Highly divergent strains of porcine reproductive and respiratory syndrome virus incorporate multiple isoforms of nonstructural protein 2 into virions[J]. J Virol, 2013, 87(24): 13456-13465.
[9] Murtaugh M P, Elam M R, Kakach L T. Comparison of the structural proteincoding sequences of the VR-2332 and Lelystad virus strains of the PRRS virus[J].Arch Virol, 1995, 140:1451-1460.
[10]罗俊,刘业冰, 姜晓晨, 等.猪繁殖与呼吸综合征病毒7个分离株全基因序列测定及遗传进化分析[J].中国预防兽医学报, 2012,34(3): 176-179.
[11]Ansari I H, Kwon B, Osorio F A,etal. Influence of N-linked glycosylation of porcine reproductive and respiratory syndrome virus GP5 on virus infectivity, antigenicity, and ability to induce neutralizing antibodies [J]. J Virol, 2006, 80(8): 3994-4004.
[12]Shen S, Kwang J, Liu W,etal. Determination of the complete nucleotide sequence of a vaccine strain of porcine reproductive and respiratory syndrome virus and identification of the Nsp2 gene with a unique insertion [J]. Arch Virol, 2000,145(5): 871-883.
[13]Tong G Z, Zhou Y J, Hao X F,etal. Highly pathogenic porcine reproductive and respiratory syndrome, China [J]. Emerg Infect Dis, 2007, 13(9):1434-1436.
[14]Choi H W, Nam E, Lee Y J,etal. Genomic analysis and pathogenic characteristics of type 2 porcine reproductive and respiratory syndrome virus nsp2 deletion strains isolated in Korea[J]. Vet Microbio, 2014,170(3/4):232-245.
(编 辑:李文平)
Genetic Variation Analysis of GP5 and NSP2 of PRRSV in Northeast China from 2013 to 2014
CHANG Xiao-bo1,2, YE Chao2, ZHAO Kuan2, JIANG Cheng-gang2, CAI Xue-hui2,ZHANG Hui1*, AN Tong-qing2*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China; 2.StateKeyLaboratoryofVeterinaryBiotechnology,HarbinVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Harbin150001,China)
To investigate the genetic variation of pathogenic porcine reproductive and respiratory syndrome(PRRSV) in Northeast China included 29 regions of 3 provinces from 2013 to 2014,123 tissue samples collected from Northeast China were tested, the GP5 and partial NSP2 genes of 20 positive samples were amplified, sequenced, phylogenetic and alignment analyzed, respectively. The results showed that the PRRSV positive rate was 16%, GP5 genesshared 84.4%~100% nucleotide similarity compared with 10 domestic and overseas reference PRRSV strains. Amino acid analysis of GP5 revealed that most strains had mutations, especially in the hyper-variable regions, the primary neutralizing epitope and decoy epitope, which were C24→Y24,F25→L25,V27→A27,L28→I28,N34→G34/S34/D34. The phylogenetic of GP5 and NSP2 of LN283 indicated the strain could be genetic recombination strain.The result of PCR on HLJ13 showed NSP2 had two genes which differed 90 bp, and the phylogenetic of NSP2 showed they belonged to CH-1a and HuN4 subgroup, which could be polyinfection involved of classical and highly pathogenic strain. The phylogenetic and amino acid analysis of GP5 and NSP2 demonstrate all strains belonged to North American genotype, which gave priority to HP-PRRSV, coexisting of classic strains and mutant strains. The study would provide a new reference on genetic evolution and disease control for PRRSV in Northeast China.
PRRSV; GP5; NSP2; genetic variation
国家自然科学基金(31270045);吉林省科技厅自然科学基金项目(20150101107JC)
常晓博,硕士研究生,从事PRRSV分子流行病学研究。
张辉,E-mail:huizhang01525@163.com;安同庆,E-mail:antongqing@163.com
2015-04-14
A
1002-1280 (2015) 08-0001-06
S858.28

