非小细胞肺癌中EGFR突变与雌激素受体表达的相关性研究*
闫 明,王淑玲,赵 驰,陈小兵,李 印
(1.郑州大学附属肿瘤医院胸外科 450008;2.郑州大学基础医学院 450008;3.郑州大学第四附属医院病理科 450008;4.郑州大学附属肿瘤医院肿瘤内科 450008)
近年来世界各国肺癌的发病率和病死率都有明显升高的趋势,女性发病率增长速度尤其快,较多的证据显示雌激素及其受体(estrogen receptor,ER)可能起了重要作用[1]。针对女性表皮生长因子受体(epidermal growth factor receptor,EGFR)突变率高的分子靶向治疗即表皮生长因子酪氨酸激酶抑制剂(EGFR-TKI),能使女性获益更多[2]。ER与EGFR突变在女性非小细胞肺癌(NSCLC)发生发展的作用与关系尚未完全清楚,本研究采用免疫组化法及实时荧光定量聚合酶链反应(TaqMan real time PCR)法分别检测ERα在NSCLC的表达及EGFR突变的情况,并分析其与肺癌临床病理的关系。
1 资料与方法
1.1 一般资料 收集郑州大学附属肿瘤医院胸外科2010年7月至2012年6月手术切除并病理证实的NSCLC标本286例。术前均未作化疗、放疗。其中男194例,女92例,年龄34~75岁,平均65.2岁;病理诊断按照WHO 1999年肺癌组织学分类:鳞癌78例,腺癌208例。根据2009年国际抗癌联盟的肺癌临床分期标准(第7版):Ⅰ期122例,Ⅱ期49例,Ⅲ期92例,Ⅳ期23例。另取20例癌旁正常组织作对照。
1.2 方法
1.2.1 ERα的检测 ERα检测试剂盒、SP试剂盒均购于福州迈新生物技术开发公司。免疫组织化学方法:将石蜡包埋的癌组织制成4~5μm切片,常规进行脱蜡,并浸入0.01mol/L、pH 6.0的枸橼酸盐缓冲液内20min。按照说明书用S-P法进行免疫组织化学染色。用已知的阳性切片作阳性对照,用PBS做阴性对照。结果判定:ERα以肿瘤细胞核或细胞质呈现棕黄色颗粒为阳性,阳性细胞总数大于25%为阳性。
1.2.2 EGFR基因突变检测 石蜡组织DNA提取采用TAKAKA试剂盒并按说明书步骤进行。首先将3~5片10μm的石蜡切片放于Eppendorf管中,加入DNA抽提液10滴并混匀,100℃加热10min,13 000r/min离心10min,吸取上清液直接用于Real-time PCR。EGFR基因突变实时荧光定量PCR法检测试剂盒由北京金菩嘉医疗科技有限公司提供,采用Taqman探针技术检测EGFR 19号外显子3种碱基缺失突变及21号外显子2种碱基置换突变。PCR反应体系包括:正反向引物、模板、MasterMix及Taqman标记探针。每次实验均设定阴、阳性对照孔及空白对照孔。反应循环参数为:50℃2min,95℃10min以激活DNA聚合酶。95℃15s,62℃1min,循环共40次。Real-time PCR仪为7900(Applied Biosystems,美国)。结果判读:以无模板对照扩增曲线的最高点为准设定阈值,没有出现扩增曲线或Ct>38.0为阴性样本,出现扩增曲线且Ct≤34.0的样本为阳性样本,出现扩增曲线且34.0<Ct≤38.0的样本需重复检测。
1.3 统计学处理 采用SPSS16.0统计学软件进行分析,计数资料用率表示,采用χ2检验,相关性分析采用等级变量Spearman相关分析,Logistic回归分析用于二分类变量的多因素相关分析,纳入变量的水准为单因素分析P<0.2,以P<0.05为差异有统计学意义。
2 结果
2.1 ERα的表达 ERα阳性部位定位于肿瘤细胞核或细胞质(图1),表达阳性率为36.0%(103/286)。其中在女性患者中的表达要显著高于男性患者(P=0.004),肿瘤最大直径小于或等于3cm的患者显著高于肿瘤直径大于3cm的患者(P<0.01),见表1。

图1 腺癌中ER的阳性表达SP法(HE×400)
2.2 EGFR基因突变 在286例标本中共检测到62例(21.7%)EGFR基因突变:29例(10.1%)为19号外显子碱基缺失突变;33例(11.5%)为2l号外显子碱基置换突变。在携带19号外显子碱基缺失突变的29位患者中,23例为E746-A750del突变,3例为L747-S752del突变,仅有2例为L747-A750del突变。在携带2l号外显子碱基置换突变的33位患者中,28例为L858R突变,5例为L861Q突变。本研究没有发现19号和2l号外显子同时突变的病例。EGFR基因突变和患者临床病病理之间的关系见表2。其中EGFR基因突变在女性、腺癌、肿瘤直径小于或等于3cm的患者显著增多(P<0.01),在ERα表达阳性患者中显著高于ERα阴性者(P<0.01)。经过单因素分析后,把P<0.20的变量纳入到Logistic回归模型中进行多因素分析,结果显示女性(OR=2.975;95%CI:1.550~5.721;P=0.001)、ERα阳性表达(OR=3.906;95%CI:1.996~7.692;P<0.01)为EGFR基因突变的独立影响因素。由于鳞癌的标本中没有检测到EGFR基因的突变,所以没有把病理分型选进模型之中。
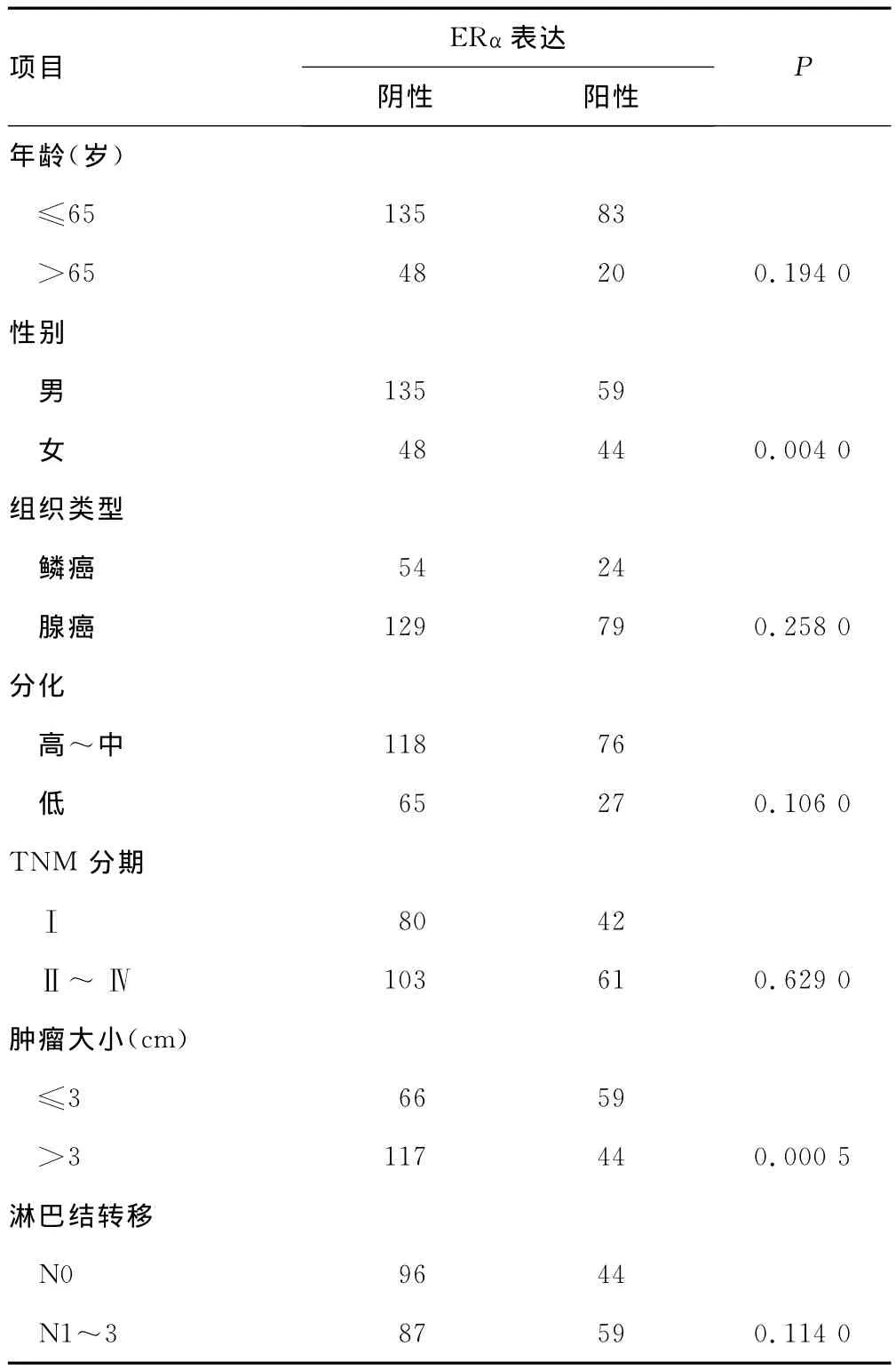
表1 ERα在非小细胞肺癌中的表达与临床特征的关系(n)
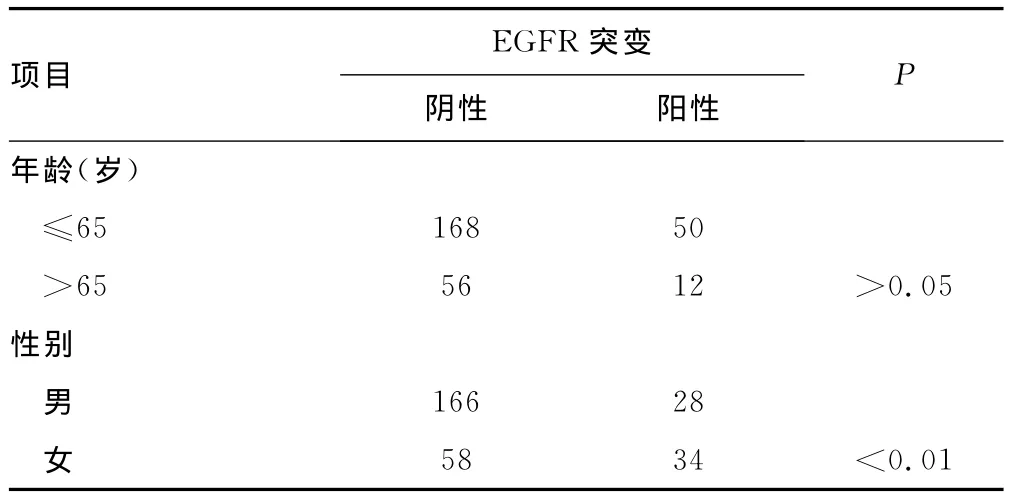
表2 EGFR突变与临床特征的关系(n)

续表2 EGFR突变与临床特征的关系(n)
3 讨论
肺癌的发病率和病死率高居各类恶性肿瘤之首,近几十年来女性肺癌发病率呈较快增长的趋势,男女患者病情发展及预后也不同[3]。尤为引人关注的是流行病学的一些改变:(1)肺腺癌的发病率显著升高,成为最常见的病理类型。(2)非吸烟者肺癌发病率上升,尤其是女性发生率明显上升,以腺癌为主。(3)女性肺癌发病率和病死率持续上升,已成为女性最主要的恶性肿瘤死因[4]。(4)晚期女性NSCLC患者较男性存在明显的生存优势。确切的原因仍不很清楚,但较多的证据显示性激素及其受体可能起了重要作用。
EGFR及其介导的信号转导是NSCLC发生、发展的重要因素[5]。最新研究发现,ER在EGFR的信号通路中发挥着重要的作用,与EGFR信号通路存在广泛的交叉调控[6]。EGFR介导的信号转导系统所引起的细胞效应包括细胞增殖、相互黏附、转移、抑制细胞凋亡及促进血管生成等多个方面。目前较为明确的主要有3条途径:(1)有丝分裂原活化蛋白激酶(Ras-RAF-MEK-MAPK)途径;(2)PI3K-AKT-mTOR途径;(3)JAK-STAT途径。导致EGFR通路持续激活的因素有很多,配体的不断产生、受体的高表达以及EGFR酪氨酸激酶的突变都可以使其持续处于激活状态[7]。基于EGFR基因激酶域基因突变理论研制的靶向药物治疗给NSCLC患者带来了新契机,抗EGFR的靶向治疗主要有两种:EGFR单克隆抗体和小分子EGFR酪氨酸激酶拮抗剂(TKI)。临床试验表明多种有EGFR突变的肿瘤对EGFR-TKI敏感,临床有效率10%~30%[5]。但是单一应用EGFR-TKI的较低的临床有效率及较高的继发性耐药仍无法解决[8],因为单一靶点的治疗往往阻断不够完全,因此效果差;同时因为细胞内相关信号通路的交互作用,阻断其中一条通路又会导致其他通路的回馈性启动,进而诱导继发性耐药的发生。所以寻找多靶点阻断的联合用药是未来的发展方向,性激素受体所介导的信号通路可能成为肺癌潜在的治疗靶点。
雌激素的调控作用主要通过ERα来发挥作用。ERα在EGFR的信号传导通路中发挥着重要作用。Raso等[9]的研究显示NSCLC中ERα的阳性表达和EGFR突变存在正相关,与本研究结果相似。而Nose等[10]的研究则显示,EGFR突变和ERβ而不是ERα的阳性表达相关,并且在EGFR基因突变阳性的患者中ERβ的阳性表达预示着患者较长的无瘤生存时间。虽然本研究结果显示ERα与EGFR相关,但ERα是否在EGFR信号通路中起作用及如何作用,现在仍未完全明确。在肺癌的ERα信号通路中,雌激素与ER结合后主要通过非基因途径产生效应[11]。雌激素可以直接刺激NSCLC细胞核中雌激素反应基因的转录并且还可以刺激EGFR信号通路的传导。在雌激素刺激下NSCLC细胞株的EGFR配体会快速释放,从而激活EGFR及MAPK通路[11]。另外,雌激素可以使NSCLC细胞株的EGFR蛋白表达下降,而雌激素拮抗剂可以使EGFR蛋白表达升高[7],这表明EGFR通路和ER通路之间可能存在一定的交叉互补关系。
多项研究结果表明,阻断或干扰ER信号的传导,都能抑制其介导的肿瘤发展:如芳香化酶抑制剂[12],选择性雌激素受体调节剂[13],选择性雌激素受体下调剂(氟维司群等)[11]。目前有多项临床实验正在进行中,以评估联合氟维司群和EGFR抑制剂对晚期NSCLC的临床价值。针对EGFR和ER两条信号通路的治疗Ⅱ期临床研究显示出良好的协同治疗效果[14]。
ER及EGFR信号通路的交叉调控能否解释女性肺腺癌发生发展的机制,EGFR-TKI的继发性耐药是否与ER通路的激活有关,这些都需要进一步的研究验证,希望本研究能为更深入理解肺癌发病分子机制、开发基于雌激素受体和EGFR的多靶点联合治疗药物提供一个思路。
[1] Siegfried JM.Hormone replacement therapy and decreased lung cancer survival[J].J Clin Oncol,2006,24(1):9-10.
[2] Marks JL,Broderick S,Zhou Q,et al.Prognostic and therapeutic implications of EGFR and KRAS mutations in resected lung adenocarcinoma[J].J Thorac Oncol,2008,3(2):111-116.
[3] Henschke CI,Yip R,Miettinen OS.Women′s susceptibility to tobacco carcinogens and survival after diagnosis of lung cancer[J].JAMA,2006,296(2):180-184.
[4] Kligerman S,White C.Epidemiology of lung cancer in women:risk factors,survival,and screening[J].AJR Am J Roentgenol,2011,196(2):287-295.
[5] Sequist LV,Lynch TJ.EGFR tyrosine kinase inhibitors in lung cancer:an evolving story[J].Annu Rev Med,2008,59(2):429-442.
[6] Migliaccio A,Castoria G,Giovannelli P,et al.Cross talk between epidermal growth factor(EGF)receptor and extra nuclear steroid receptors in cell lines[J].Mol Cell Endocrinol,2010,327(1/2):19-24.
[7] Fujimoto N,Wislez M,Zhang J,et al.High expression of ErbB family members and their ligands in lung adenocarcinomas that are sensitive to inhibition of epidermal growth factor receptor[J].Cancer Res,2005,65(24):11478-11485.
[8] Paez JG,Janne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500.
[9] Raso MG,Behrens C,Herynk MH,et al.Immunohistochemical expression of estrogen and progesterone receptors identifies a subset of NSCLCs and correlates with EGFR mutation[J].Clin Cancer Res,2009,15(17):5359-5368.
[10] Nose N,Sugio K,Oyama T,et al.Association between estrogen receptor-beta expression and epidermal growth factor receptor mutation in the postoperative prognosis of adenocarcinoma of the lung[J].J Clin Oncol,2009,27(3):411-417.
[11] Stabile LP,Lyker JS,Gubish CT,et al.Combined targeting of the estrogen receptor and the epidermal growth factor receptor in non-small cell lung cancer shows enhanced antiproliferative effects[J].Cancer Res,2005,65(4):1459-1470.
[12] Marquez-Garban DC,Chen HW,Goodglick L,et al.Targeting aromatase and estrogen signaling in human nonsmall cell lung cancer[J].Ann N Y Acad Sci,2009,1155(11):194-205.
[13] 朱晓莉,张祖贻,朱毅.肺癌雌激素受体表达与三苯氧胺拮抗治疗的研究[J].江苏医药,2002,28(9)641-643.
[14] Garon E B,Pietras R J,Finn R S,et al.Antiestrogen fulvestrant enhances the antiproliferative effects of epidermal growth factor receptor inhibitors in human nonsmall-cell lung cancer[J].J Thorac Oncol,2013,8(3):270-278.

