多重耐药鲍曼不动杆菌的耐药机制研究*
吴 倩,蒋 敏,赵 清△
(1.重庆医科大学第二临床学院 400100;2.中梁社区卫生服务中心,重庆400036)
鲍曼不动杆菌是一种重要的革兰阴性条件致病菌,广泛存 在于自然界,具有强大的获得耐药性和克隆传播的能力。近年来鲍曼不动杆菌的耐药情况日趋严重,多重耐药、广泛耐药、全耐药鲍曼不动杆菌呈世界性流行,对全球的公众健康构成威胁,其耐药机制与菌株感染的临床治疗已成为如今关注的热点。产广谱β-内酰胺酶(ESBLs)是近年的研究中认为的鲍曼不动杆菌重要的耐药机制,临床分离的耐药菌株常产ESBLs和头孢菌素酶(Ampc)。从基因层面上看,编码A类及C类BLA为鲍曼不动杆菌最主要的耐药基因。为明确重庆医科大学附属第二医院院鲍曼不动杆菌的耐药情况,现对重庆医科大学第二临床学院2013年1~4月分离的70株鲍曼不动杆菌进行研究,报道如下。

表1 A类及C类β-内酰胺酶基因引物识别序列和目的产物长度
1 材料与方法
1.1 菌株来源 70株菌株均分离自该院2013年1~4月住院病人临床标本,已剔除重复菌株。分别为:痰液56份、分泌物7份、尿液5份和血液2份;ICU 28份、呼吸内科18份、神经外科14份、骨科5份,其他科室5份,经VITEK 2Compact全自动细菌鉴定及药敏分析仪重新鉴定。标准菌株为大肠埃希菌ATCC25922、肺炎克雷伯菌ATCC700603和绿脓假单胞菌ATCC27853。
1.2 试剂及主要仪器 M-H平板购自重庆旁通医疗器械有限公司。克拉维酸(CLA)和氯唑西林(CLO)购自中国药品生物制品检定所。药敏纸片头孢曲松(CRO)购自杭州天和微生物试剂有限公司。VITEK 2Compact全自动细菌鉴定及药敏分析仪购自法国生物梅里埃公司。PCR引物及扩增试剂盒购自上海生物工程有限公司。PCR仪、凝胶电泳仪、紫外凝胶成像仪由重庆医科大学附属第二医院中心实验室提供。
1.3 方法
1.3.1 药敏试验 采用VITEK 2Compact全自动细菌鉴定及药敏分析仪测定16种抗菌药物的敏感性,微量稀释法。
1.3.2 三维试验
1.3.2.1 酶粗取液制备 将新分离的实验菌株密涂于1/4 M-H平板(直径90cm)上,35℃培养24h,用灭菌棉棒取下全部菌苔于1.0mL灭菌0.9%氯化钠溶液中,置-70℃低温冰箱,反复冻融7次,每次冻2h以上,再取出,37℃溶解,然后经4℃13 000r/min低温离心机离心15min,取上清液。将上清液接种于M-H琼脂平板上,35℃培养24h后,以无菌生长为合格,于-20℃保存备用。
1.3.2.2 产酶鉴定 用灭菌棉棒沾取0.5麦氏浊度的大肠埃希菌ATCC25922菌液均匀涂布M-H琼脂平板,于平板中心贴头孢曲松纸片,10min后于平板距纸片边缘5mm处垂直打4个长约10mm,宽1mm的槽,分别于槽内加40μL酶粗提液,36μL酶粗提液+4μLCLA,36μL酶粗提液+4μL CLO;32μL酶粗提液+4μL CLO+4μL CLA后置35℃培养24h。CLA与CLO浓度均为2mmol/L。CLA单独加入时抑酶试验为阳性,该菌ESBLs检测阳性;CLO单独加入时抑酶试验为阳性,即该菌AmpC酶检测阳性;CLA或CLO单独加入抑酶试验阴性,而CLA或CLO同时加入时抑酶试验为阳性,表明该菌同时产ESBLs和AmpC酶,即SSBL;当CLA和CLO同时加入时抑酶试验仍为阴性,提示可能产生耐酶抑制剂的BLA。肺炎克雷伯菌ATCC 700603和阴沟肠杆菌029M酶提取物分别作ESBLs和AmpC酶的阳性对照。
1.3.3 聚合酶链反应
1.3.3.1 模板制备 采用煮沸法。将适量菌液煮沸15min,冰浴1min,13 000r/min离心3min,取上清液即为所需的DNA模板。
1.3.3.2 PCR反应及引物 参照文献设计引物。检测A类、C类共5种β-内酰胺酶基因,靶基因引物序列和产物长度见表1。反应体系参照XXX试剂盒说明书设置。产物长度大于500bp者PCR扩增热循环参数为:94℃预变性2min,94℃变性1min,50℃退火1min,72℃延伸1min,共循环35次,最终72℃延伸5min。产物长度小于500bp者PCR扩增热循环参数为:94℃预变性2min,94℃变性30s,55℃退火30s,72℃延伸1min,共循环35次,最终72℃延伸5min。扩增产物于4℃保存。产物经1.0%琼脂糖凝胶中电泳,电泳结束后在紫外凝胶成像仪下拍照。
2 结果
2.1 药敏结果 70株鲍曼不动杆菌对16种抗菌药物的药敏结果见表2。其耐药率除左氧氟沙星为67.2%以外,其余均大于80%。
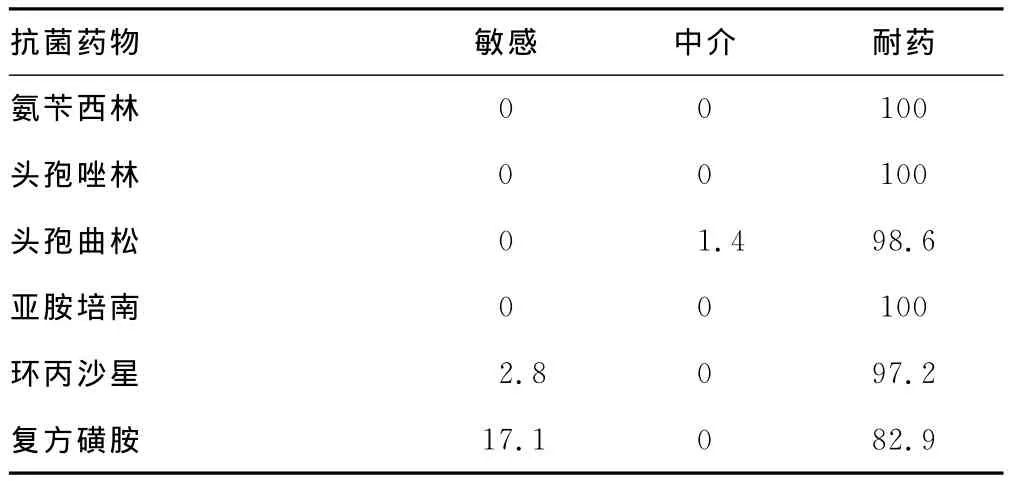
表2 70株鲍曼不动杆菌对抗生素的耐药率(%)
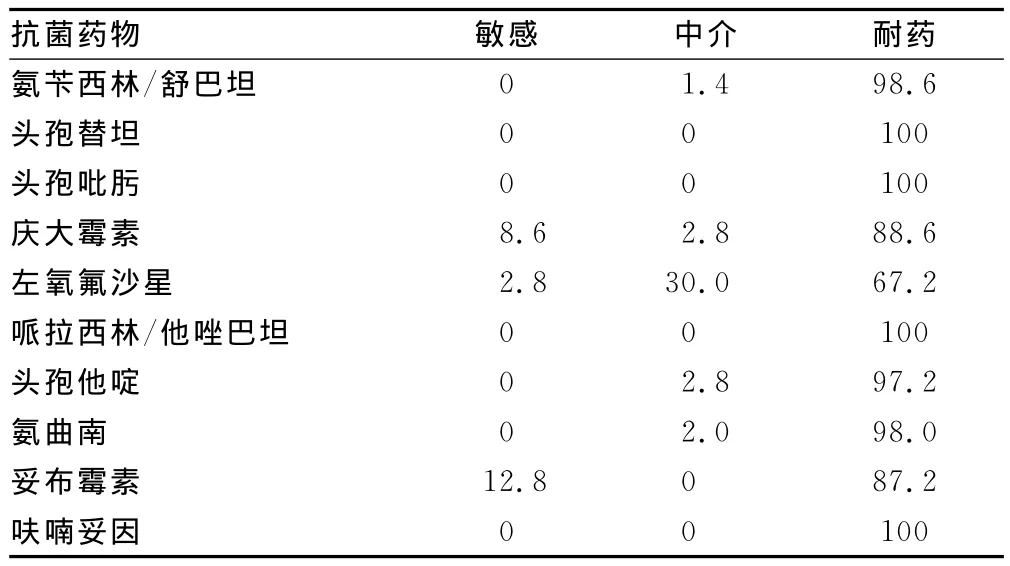
续表2 70株鲍曼不动杆菌对抗生素的耐药率(%)
2.2 三维实验结果 70株多重耐药鲍曼不动杆菌中,32株(45.7%)单产Ampc酶,8株(11.4%)单产ESBLs,20株(28.6%)同时产Ampc酶和ESBL,合计共28株(40%)产ESBLs,共52株(74.2%)产Ampc酶。3株(4.2%)为不产酶菌株,7株(10%)能水解CRO但不能被CLO和CLA联合抑制,可能为耐抑制剂的β-内酰胺酶。2号菌株同时产Ampc酶和ESBL。2号菌株酶粗取液不能单独被CLA和CLO抑制,但同时加入CLA和CLO时抑酶阳性,即同时产ESBL和Ampc酶。
2.3 PCR结果 70株鲍曼不动杆菌共检测出blaTEM、blaSHV、blaADC 3种基因,分别为69株(98.6%)、25株(35.7%)、56株(80.0%)。其余基因均为阴性。PCR扩增产物电泳图见图1,70株菌表型与基因型实验结果见表3。
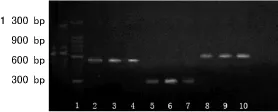
图1 各种耐药基因PCR扩增产物电泳结果
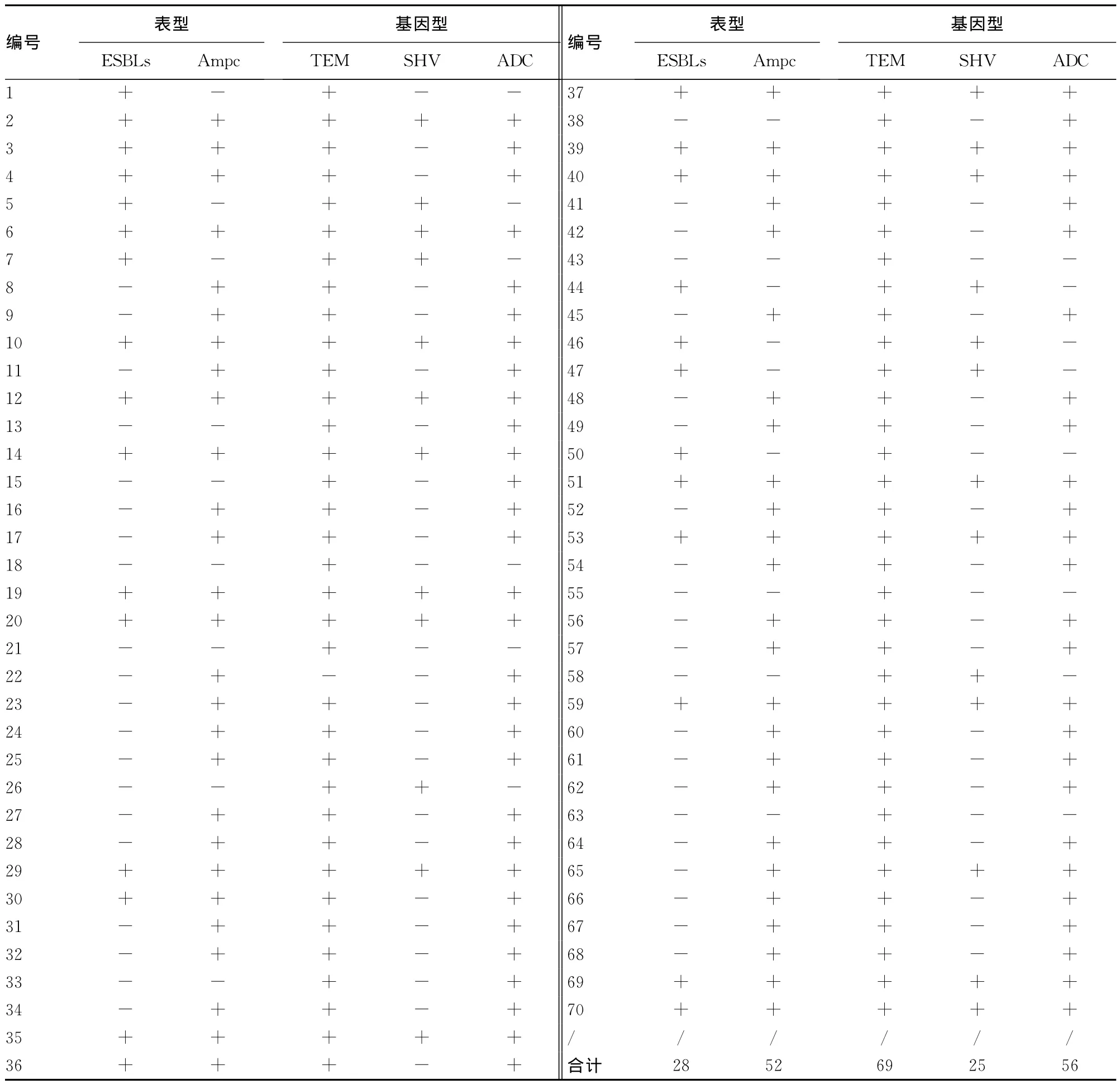
表3 70株鲍曼不动杆菌表型与基因型检测结果
3 讨论
近年来鲍曼不动杆菌从临床标本中的分离率逐渐升高,随着抗菌药物的广泛使用,多重耐药鲍曼的比例也在不断上升。该院2013年1~4月鲍曼不动杆菌检出率达13.9%,仅次于大肠杆菌,其中多重耐药鲍曼不动杆菌占83%,其耐药性不容忽视。鲍曼不动杆菌是医院感染最常见的病原菌之一,其感染危险因素包括:长时间住院、入住监护室、接受机械通气、侵入性操作、抗菌药物暴露以及严重基础疾病等,主要引起医院获得性肺炎尤其是呼吸机相关性肺炎、菌血症、尿路感染和继发性脑膜炎,常见于危重患者[1]。本次研究资料显示,分离出多重耐药鲍曼不动杆菌的临床标本多为痰液,主要来自于ICU、呼吸内科、神经外科,与文献报道相近[2]。可见,加强医院管理,针对易感人群及科室,积极有效地控制鲍曼不动杆菌感染和传播是极其重要的。
多重耐药鲍曼不动杆菌是指对5类抗菌药中的3类及以上药物耐药,为多重耐药菌株,包括头孢菌素类(如头孢他啶或头孢吡肟)、碳青霉烯类(如亚胺培南)、β-内酰胺酶抑制剂(如头孢哌酮/舒巴坦)、氟喹诺酮类(如环丙沙星)和氨基糖苷类(如阿米卡星)。本次药敏结果显示,70株鲍曼不动杆菌除对左氧氟沙星敏感率2.8%,中介率30%,耐药率67.2%,对其余抗菌药物耐药率均大于80%,甚至对亚胺培南等6种抗菌药物100%耐药,表现出严重的多重耐药性甚至泛耐药性,为临床治疗带来极大的困难。为了延缓多重耐药鲍曼不动杆菌的产生,临床医生在治疗鲍曼不动杆菌感染时应根据临床情况及药敏结果合理选用抗菌药物,同时严格限制亚胺培南等高耐药潜能抗菌药物的不合理应用。
ESBLs是鲍曼不动杆菌耐药的主要机制。β-内酰胺酶是一群数量相当庞大的抗菌药物灭活酶,作用于β-内酰胺类抗菌药物的β-内酰胺环,使酰胺键断裂而失去抗菌活性。β-内酰胺酶按照Ambler分子结构分为A、B、C、D 4类,其中A类ESBLs和C类头孢菌素酶是介导其耐药的最主要的两种酶。
A类酶主要是一些超广谱酶(ESBLs),据编码基因的同源性可分为TEM型、SHV型和非TEM、SHV型,超过200多种[3],可引起对青霉素类、碳青霉烯类和氨基糖苷类耐药,被能被B一内酰胺酶抑制剂如克拉维酸、舒巴坦和他唑巴坦抑制。ESBLs于1982年首次在临床分离的对头孢他啶耐药的1株产酸克雷伯菌中被发现,为TEM-2[4]。已在鲍曼不动杆菌中发现的ESBLs基因型主要有TEM、SHV、CTX、PER-1和VEB-1。近年来由于各地ESBLs基因和抗菌药物使用情况不同,各地产ESBLs菌株耐药性表现出多样化,带有明显的区域特征。本次研究共检出28株(40%)鲍曼不动杆菌ESBLs表型阳性,与马全玲等[5]报道的相比略高。从基因型层面上看,TEM型阳性69株,SHV型阳性25株,CTX型为阴性。可见该院多重耐药鲍曼不动杆菌携带A类β-内酰胺酶基因主要以TEM型、SHV型为主。
Ampc酶是由染色体(ADC)或质粒(DHA)介导产生的一类β-内酰胺酶,属于C类酶,能水解包括青霉素、头孢菌素和单环酰胺类在内的许多β-内酰胺类抗菌药物,但对碳青霉烯类、第四代头孢菌素和喹诺酮类敏感,可被氯唑西林和Syn2190抑制,是鲍曼不动杆菌对第3代头孢菌素耐药的主要原因。Ampc酶由Ampc基因编码,由AmpC、AmpR、AmpD和AmpG这4个不连锁的基因组成的Ampc操纵子调控其表达。当低产酶菌株接触具有诱导作用的β-内酰胺类抗生素如FOX等第三代头孢菌素时,可在Ampc操纵子上发生高频率的自发突变,使调控基因表达增强,Ampc酶产量显著上升[6]。Mak等[7]报道耐药鲍曼不动杆菌Ampc基因上游存在插入序列元件ISAbal,可使Ampc基因过度表达,耐药谱扩大,并对头孢他啶等超广谱头孢菌素高度耐药。2000年Bou等[8]报道了在耐药鲍曼不动杆菌中产生染色体介导的Ampc酶。由不动杆菌固有的染色体编码的Ampc酶称为ADCs,即不动杆菌衍生头孢菌素酶,其溯源可能来自同一个β-内酰胺酶,代表一个新的β-内酰胺酶家族。
本次研究检测出Ampc基因阳性率为80%,与本地区报道张小江等[1]报道的84.78%相符合,比广州张丽梅等[9]报道的48.8%高,比浙江苏兆亮等[10]报道的98.3%低,这些差异可能与地区差别,菌株来源等因素有关。本次研究中质粒介导的Ampc基因DHA未检出阳性,而国内外其他文献也鲜有报道在鲍曼不动杆菌中检出DHA基因,提示鲍曼不动杆菌产Ampc酶以染色体介导为主,质粒介导较少。56株Ampc酶基因阳性的菌株中,52株菌Ampc酶表型阳性,另4株为阴性,原因可能是由于调控基因表达有差异,致使这些菌株产酶量低。
近年来,鲍曼不动杆菌对各种抗菌药物的耐药性逐年增长,耐药机制也越来越复杂,导致有效抗菌药物的选择受到限制。国内外对于治疗鲍曼不动杆菌感染的研究主要集中于亚胺培南、多粘菌素、舒巴坦、四环素等[11]。但多重耐药菌株,耐碳青霉烯类菌株甚至泛耐药菌株的出现与扩散为临床选药带来极大的困难,甚至面临无药可选的地步。面对这样的局面,医院应加大对鲍曼不动杆菌耐药性与耐药机制的关注,规范临床合理使用抗生素,加强手卫生、消毒隔离等感控措施,以防止鲍曼不动杆菌多重耐药性进一步恶化,最大程度减少多重耐药菌株的产生。
[1] 张小江,徐英春,俞云松,等.2009年中国CHINET鲍曼不动杆菌细菌耐药性监测[J].中国感染与化疗杂志,2010,6(2):45-48.
[2] 朱晓华,周岐新,凌保东.鲍曼不动杆菌耐药表型与外排泵基因表达水平的研究[J].中国抗生素杂志,2010,2(3):36-38.
[3] Poirel L,Bonnin RA,Nordmann P.Genetic support and diversity of acquired extended-spectrum beta-lactamases in Gramnegative rods[J].Infect Genet Evol,2012,12(5):883-893.
[4] 覃金爱,朱莲娜.鲍曼不动杆菌β-内酰胺酶耐药基因研究进展[J].内科,2010,5(4):404-407
[5] 马全玲,武大伟,魏殿军.72株院内感染鲍曼不动杆菌ESBL检测及耐药性分析[J].中国卫生检验杂志,2010,20(12):3404-3405.
[6] Schmidtke AJ,Hanson ND.Model system to ecaluate the effect of ampD mutations on AmpC-mediatedβ-lactam resistance[J].Antimicrob Agents Chemother,2006,50(6):2030-2037.
[7] Mak JK,Kim MJ,Pham J,et al.Antibiotic resistance determinants in nosocomial strains of multiple drug-resistant Acinetobacter baumannii[J].J Antimicrob Chemother,2009,63(1):47-54.
[8] Bou G,Martinez-Beltrn J.Cloning,uncleotidese sequencing,and analysis of the gene encoding an Ampcβ-lactamase in Acinetobacter baumannii[J].J Antimicrob Chemother,2000,44(2):428-432.
[9] 张丽梅,苏丹虹,徐韫健.鲍曼不动杆菌AmpC酶和AmpC耐药基因检测分析[J].检验医学与临床,2012,9(21):2683-2685.
[10] 苏兆亮,糜祖煌,朱海涛,等.耐药鲍曼不动杆菌ADC型β-内酰胺酶基因分子流行病学研究[J].中国抗生素杂志,2013,38(9):700-704.
[11] 王国恩,刘敏龙.多重耐药鲍曼不动杆菌的抗生素治疗[J].医学综述,2010,16(24):3781-3783.

