MKK4基因启动子区-1044A>T多态与鼻咽癌易感性的研究*
鲁明骞,孔庆志,许新华,卢宏达,卢忠心,徐冰清,史克志,郭 蓉
(1.湖北中医药大学中医临床学院,湖北武汉430061;2.三峡大学第一临床医学院肿瘤研究所&湖北省宜昌市中心人民医院肿瘤内科,湖北宜昌443003;3.武汉市中心医院肿瘤科&武汉市肿瘤研究所,湖北武汉430061)
鼻咽癌(nasopharyngeal carcinoma,NPC)是头颈部最常见的恶性肿瘤,好发于中国南方各省,具有明显的地区聚集性,世界上80%的鼻咽癌发生在中国,其5年生存率约40%~60%[1],10年生存率约40%~50%[2]。细胞信号传导在恶性肿瘤的发生、发展、侵袭和转移中具有重要作用,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,能将细胞外刺激信号转导至细胞及其核内,对细胞增殖、分化、转化、凋亡、血管形成、肿瘤转移等有一定调控效应[3-4]。有丝分裂原激活蛋白激酶4(mitogen-activated protein kinase kinase 4,MKK4)作为MAPK信号传导通路的构成部分,在受到细胞内、外信号刺激后,能对肿瘤细胞的生长、增殖、凋亡和转移等有一定的作用[5-6]。目前,发现MKK4启动子区多态性与多种肿瘤关系密切,但其多态性与鼻咽癌关系研究较少。本研究将对MKK4启动子基因-1044A/T单核苷酸多态性(single nucleotide polymorphism,SNP)与鼻咽癌发生易感性的关系进行分析,进而对鼻咽癌的临床诊断和治疗研究提供分子依据。
1 资料与方法
1.1 一般资料 收集三峡大学第一临床医学院肿瘤研究所经病理学检查确诊的新发鼻咽癌患者90例,其中,男54例,女36例,年龄22~73岁,平均(45.3±5.2)岁。同期收集社区人群中30例建康者,其中,男22例,女8例,男女比例为11∶4,年龄23~65岁,平均(49.6±6.4)岁,所有受试者均无血缘关系。每位参加者签知情同意书后均采集3mL外周血冰冻待测。
1.2 多肽性分析
1.2.1 冻血提取DNA 用QIAGEN公司的FlexiGene DNA kit试剂盒提取冻血DNA,每个样提500μL,测浓度,稀释至20~30ng/μL。
1.2.2 PCR扩增 PCR扩增的引物序列,正向:5′-AGT GGG GAG TAG TAA ATG ATG-3′,反向:5′-CTA ACA CAA GTC GTG AAA GGA-3′。用所给DNA样本做模板,先通过外侧引物扩增包含SNP位点的小片段,PCR体系如下:高保真DNA聚合酶(2.5U)0.2μL,10×Buffer 1.5μL,dNTP Mixture(2.5mM)0.8μL,模板DNA(20ng/μL)2μL,引物KF(10μM)0.15μL,引物KA(10μM)0.15μL,ddH2O 10.2 μL,补充反应体积至15.0μL。扩增程序:起始高温94℃预变性5min,循环适温度延伸94℃30s,低温退火72℃60s,扩增阶段72℃10s共35个循环,72℃延伸5min,PCR扩增产物12℃保存。
1.2.3 对PCR产物进行酶切 MKK4-1044A>T的PCR产物用核酸内切酶TSP509I消化扩增好的片段(65℃过夜),然后置于2%琼脂糖凝胶分离。所有的结果均由经验丰富的实验者采用单盲法评价,随机选取2个SNP位点提纯片段10%的片段进行测序列确定效果。
1.3 统计学处理 采用SPSS13.0统计软件进行分析处理。采用直接计数法计算基因型及等位基因频率;采用拟合优良度χ2检验分析两组中的Hardy-Weinberg平衡来比较预期基因型频率和实际基因型频率的吻合程度,以P<0.05为差异有统计学意义。
2 结果
2.1 凝胶电泳结果 采用核酸内切酶TSP509Ⅰ处理后,-1044TT基因型共产生了70bp和152bp两条带,而-1044AA基因型仅产生了222bp一条带,而杂合子共产生了70、152bp和222bp三条带(图1)。
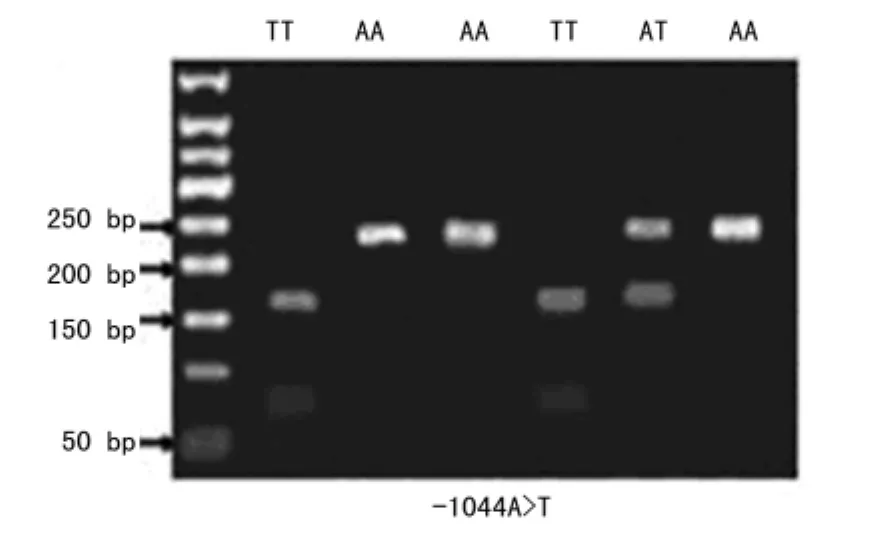
图1 MKK4-1044A>T基因扩增产物凝胶电泳结果
2.2 遗传平衡检验 两组基因型分布(-1044A>T)的实际频率均符合Hardy-Weinberg平衡(表1、表2),证明两组基因型分布具有群体代表性。
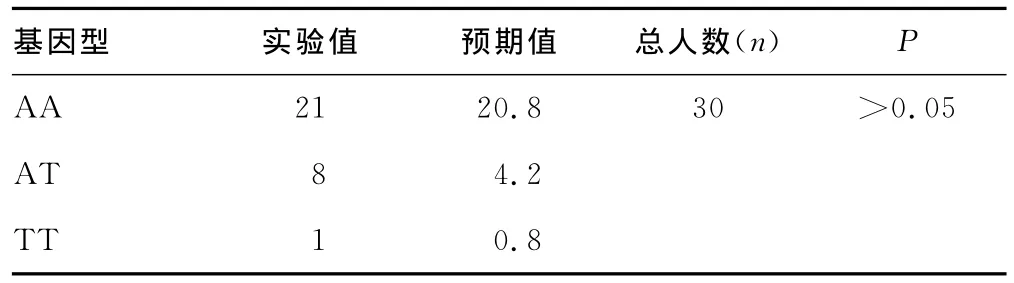
表1 正常人SNP-1044基因型的Hardy-Weinberg平衡吻合度检验
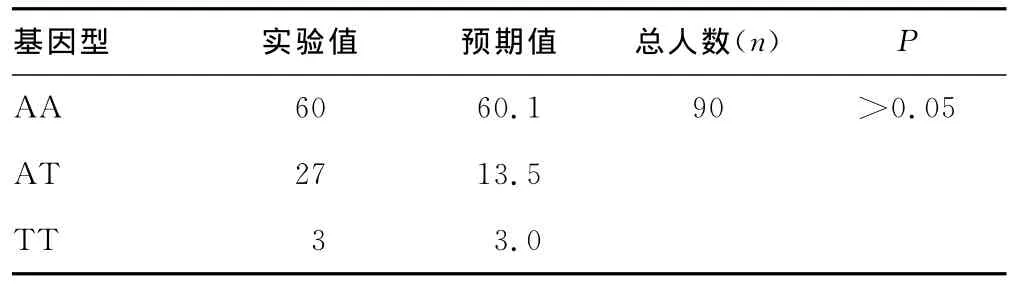
表2 鼻咽癌SNP-1044基因型的Hardy-Weinberg平衡吻合度检验
2.3 MKK4的SNP-1044A>T的基因型和基因频率的分布正常对照组-1044A>T AA、TT基因型频率分别为70.0%和3.3%。病例组中AA、TT基因型频率为66.7%和3.3%,统计学分析显示-1044A>T基因型在鼻咽癌患者和正常对照组中的分布差异无统计学意义(P>0.05),见表3。与AA基因型相比,-1044TT基因型与鼻咽癌的发病风险无相关性(校正后OR=0.952,95%CI=0.094~9.663),变异基因型AT+TT并未改变鼻咽癌的发病率(校正后OR=0.952,95%CI=0.094~9.663)。
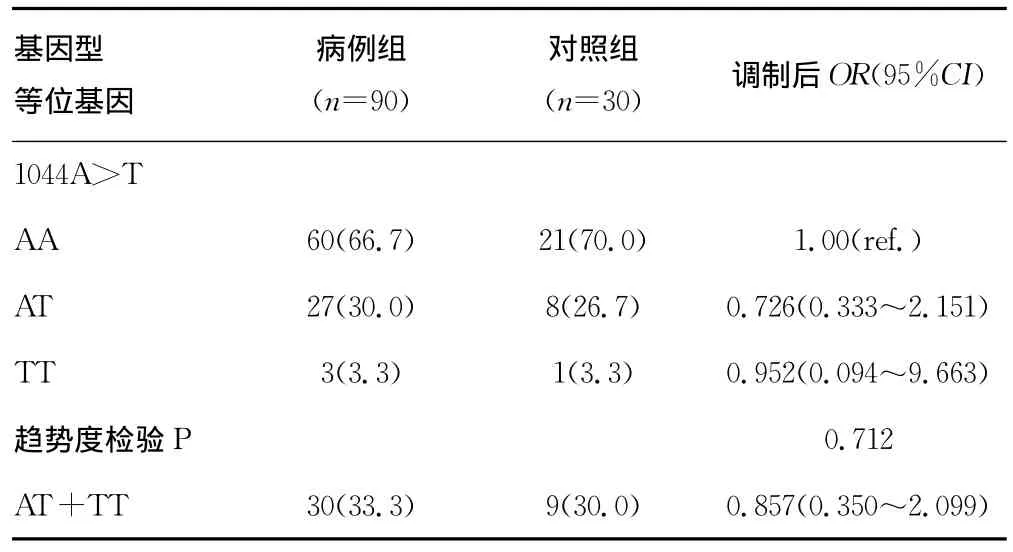
表3 基因型和等位基因的分布情况[n(%)]
3 讨论
MKK4作为MAPK通路的重要成员,在肿瘤的发生和发展中具有重要作用。研究表明,MKK4作为抑制肿瘤的重要蛋白,对恶性肿瘤生长及其转移具有抑制作用[7]。Sousa等[8]对124例鼻咽癌和509例健康对照的SNP309T/G多态性研究发现MDM2SNP309可作为早期鼻咽癌预测的标志物。Xu等[9]对444例鼻咽癌患者和464例健康对照的SNP-139GG和-939AA多态性研究发现DC-SIGN启动子的多态性与鼻咽癌的遗传易感性有关。Farhat等[10]研究认为IL-18启动子SNP-607C/A和-137G/A多态性与鼻咽癌的发生和发展具有促进作用。Cao等[11]在对鼻咽癌患者的Fas-SNP 1377G/A和FasL-SNP 844T/C的多态性研究发现此位点与鼻咽癌的发病风险相关,在吸烟患者尤为明显。
启动子作为基因转录的重要元件,在蛋白质的表达中具有重要的作用,目前已筛选出多种恶性肿瘤启动子区域的SNP,关于鼻咽癌启动子SNP的研究也有相关报道[12]。目前,已发现MKK4启动子有2个SNP位点与肿瘤关系密切,即-1304T>G和-1044A>T。Yoshida等[13]对706例大肠癌和723例健康对照组-1304T>G和-1044A>T的多态性研究发现SNP-1304T>G对于大肠癌的发生和遗传风险性有关,但未发现SNP-1044A>T与大肠癌的相关性。该研究显示了MKK4基因在恶性肿瘤的发生中起着极为复杂的作用。但目前的研究主要为MKK4基因启动子单核苷酸多态性与卵巢癌、乳腺癌、大肠癌、胰腺癌、胃癌等关系密切,但关于MKK4基因启动子单核苷酸多态性与鼻咽癌的相关性目前研究较少。刘斌等[14]收集了500例EB病毒感染的鼻咽癌患者,同期随机选取500例健康人群作为对照,发现鼻咽癌患者TG基因型和GG基因型危险性分别下降了22%和36%,且随着保护性等位基因(G)个数的增加,鼻咽癌发病的风险呈逐渐下降趋势。启动子SNP对于肿瘤的保护或者是抑制作用主要是通过降低或者是上调该基因对应的蛋白得以实现的。本研究-1044A>T的基因型和基因频率的关系表明,病例组和对照组SNP(-1044A>T)的实际频率均符合Hardy-Weinberg平衡,证明两组基因型分布具有群体代表性。病例组中AA、AT、TT基因型频率分别为66.7%、30.0%、3.3%,对照组分别为70.0%、26.7%、3.3%。Logistic多因素回归分析表明,与-1044AA基因型比较,经年龄和性别校正后-1044ATOR=0.726,95%CI=0.333~2.151,-1044TT基因型OR=0.952,95%CI=0.094~9.663,表明TT基因型与散发性鼻咽癌患者发病风险无关。变异基因型AT+TTOR=0.952,95%CI=0.094~9.663,这表明该位点对鼻咽癌风险无等位基因剂量效应。
随着对分子生物学的不断深入研究,目前,对SNP的认识更加深入,也逐渐揭开其在生命系统的重要作用[15],如疾病的诊断、预防与治疗,尤其是将SNP作为一种新的研究策略去揭示其在肿瘤等多基因疾病的发病基础、基因与药物代谢和敏感性的关系、基因与环境的相互作用等,更加有助于疾病的高危人群的筛选。同时,高通量、高自动化的SNP检测技术,更方便了高密度SNP的筛查,如直接测序、单链构象多态性分析、限制性片段长度多态性分析等,以及近年来发展起来的基因卷片技术、焦测序技术、滚环扩增技术、磁珠阵列技术、变性高效液相色谱、飞行时间质谱法等,同时这些技术与荧光检测原理和质谱仪相结合,形成了荧光检测平台和质谱仪检测平台。尽管目前已经发现MKK4-1044A>T基因多态型与鼻咽癌可能无明显相关性,但是还必须指出本研究的不足:(1)研究的对象较少;(2)研究对象较局限,没有足够的代表性;(3)实验设计样本量不足以精确检测基因与环境的相互关系。在今后的研究中,作者将扩大样本量进一步来验证上述实验结果。
[1] Chen L,Hu CS,Chen XZ,et al.Concurrent chemoradiotherrapy plus adjuvant chemotherapy versus cencurrent chemotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma:aplus 3multicentre randomised controlled trial[J].Lancet Oncol,2012,13(2):163-171.
[2] Zhou X,Cui J,Macias V,et al.The progress on genetic analysis of nasopharyngeal caicinomay[J].Comp Funct Genomics,2007:57513.
[3] Dong X,Liu Y,Du M,et al.P38mitogen-activated protein kinase inhibition attenuates pulmonary inflammatory response in a rat cardiopulmonary bypass model[J].Eur J Cardiothorac Surg,2006,30(1):77-84.
[4] 鲁明骞.丝裂原活化蛋白激酶信号传导通路在恶性肿瘤中的研究现状[J].实用癌症杂志,2013,28(3):320-321.
[5] Cheng YJ,Lee CH,Lin YP,et al.Caspase-3enhances lung metastasis and cell migration in a protease-independent mechanism through the ERK pathway[J].Int J Cancer,2008,123(6):1278-1285.
[6] 鲁明骞,许新华.MKK4与恶性肿瘤相关性的研究进展[J].山东医药,2011,51(19):110-111.
[7] Spillman MA,Lacy J,Murphy SK,et al.Regulation of the metastasis suppressor gene MKK4in ovarian cancer[J].Gynecol Oncol,2007,105(2):312-320.
[8] Sousa H,Pando M,Breda E,et al.Role of the MDM2 SNP309polymorphism in the initiation and early age of onset of nasopharyngeal carcinoma[J].Mol Carcinog,2011,50(2):73-79.
[9] Xu YF,Liu WL,Dong JQ,et al.Sequencing of DC-SIGN promoter indicates an association between promoter variation and risk of nasopharyngeal carcinoma in cantonese[J].BMC Med Genet,2010,11:161.
[10] Farhat K,Hassen E,Bouzgarrou N,et al.Functional IL-18promoter gene polymorphisms in Tunisian nasopharyngeal carcinoma patients[J].Cytokine,2008,43(2):132-137.
[11] Cao Y,Miao XP,Huang MY,et al.Polymorphisms of death pathway genes FAS and FASL and risk of nasopharyngeal carcinoma[J].Mol Carcinog,2010,49(11):944-950.
[12] Cunningham SC,Kamangar F,Kim MP,et al.MKK4status predicts survival after resection of gastric adenocarcinoma[J].Arch Surg,2006,141(11):1095-1099.
[13] Yoshida BA,Dubauskas Z,Chekmareva MA,et al.Mitogen-activated protein kinase kinase 4/stress-activated protein/Erk kinase 1(MKK4/SEK1),aprostate cancer metastasis suppressor gene encoded by human chromosome 17[J].Cancer Res,1999,59(21):5483-5487.
[14] 刘斌,黄斌,芳杨磊,等.EB病毒-MKK4基因遗传变异的交互作用与鼻咽癌危险性研究[J].实用医学杂志,2012,28(2):175-177.
[15] Dérijard B,Raingeaud J,Barrett T,et al.Independent human MAP-kinase signal transduction pathways defined by MEK and MKK isoforms[J].Science,1995,267(5198):682-685.

