新生儿主动脉弓手术的体外循环管理体会
吴永红,孙善权,姚仕文,孔娟娟
新生儿主动脉弓手术的体外循环管理体会
吴永红,孙善权,姚仕文,孔娟娟
[摘要]:目的 探讨新生儿主动脉弓离断(IAA)或主动脉缩窄(CoA)合并其它心内畸形的一期矫治手术的体外循环管理。方法 2014年9月至2015年7月手术治疗主动脉弓离断或缩窄合并其它心内畸形新生儿14例,其中主动脉缩窄6例,主动脉弓离断8例。平均年龄17(3~30)d。平均体重3.06(2.1~4.2)kg。均经胸骨正中切口在深低温体外循环下行一期矫治手术。结果 14例新生患儿均顺利完成手术,顺利脱离体外循环,平均体外循环时间141(66~410)min,平均停循环时间17 (15~30)min,平均阻断时间60(32~134)min,辅助时间69(28~284)min。其中有2例延迟关胸,14例手术开放后均尿量满意,无需进行改良超滤,无需放腹膜透析。结论 新生儿的体外循环管理,尤其是深低温停循环的体外循环管理,从做好预充液的调整到体外循环的全程控制,会对手术结局起到非常重要的作用,患者有更好的转归。
[关键词]:新生儿;主动脉弓缩窄;主动脉弓离断;体外循环
作者单位:511442广州,广东省妇幼保健院手术室(吴永红),心脏中心(孙善权、姚仕文、孔娟娟)
The experience of cardiopulmonary bypass management of aortic arch surgery in neonates
Wu Yong-hong,Sun Shan-quan,Yao Shi-wen,Kong Juan-juan
GuangDong Women And Children Hospital,Guangdong Guangzhou 511442,China
[Abstract]:Objective The aim of the study was to examine the management and the experience of cardiopulmonary bypass (CPB)in one stage repair of interrupted aortic arch or aortic coarctation with intracardiac defects in neonates.Methods One stage re⁃pair were performed in 14 neonates with interrupted aortic arch(IAA)or aortic coarctation(CoA)with other intracardiac defects from September 2014 to July 2015.The cases included 6 neonates with aortic coarctation of aortic arch and 8 with IAA.Median age was 17 (3-30)days.Median weight was 3.06(2.1-4.2)kg.Results Deep hypothermia circulatory arrest(DHCA)was used in all cases.The median CPB time 141(66-410)min,median DHCA time was 17(15-30)min,and aortic cross clamping time was 60(32-134)min,and continuous CPB time 69(28-284)min.All the cases were weaned from CPB successfully without modified ultrafiltration and perito⁃neal dialysis.The postoperative complication occurred in 2 cases with delayed sternal closure.Conclusion It is important to intensify the total process of CPB management in the neonates to ensure surgical safety,especially the management of DHCA.
[Key words]: Nonates;Aortic coarctation;Interruption of aortic arch;Cardiopulmonary bypass体外循环,尤其是新生儿的体外循环管理,尽管随着心脏外科的发展已经得到了不断的完善和提高,但在新生儿深低温停循环方面经验仍然比较欠缺,还有很大的进步空间,笔者对11个月内14例主动脉弓缩窄或离断合并其它心内畸形的新生儿实施深低温停循环的方法进行总结探讨如下。
1 资料与方法
1.1 临床资料 2014年9月至2015年7月共对14例主动脉弓离断(aortic arch,IAA)或主动脉弓缩窄(aortic coarctation,CoA)合并其它心内畸形进行手术,其中男11例,女3例。CoA 6例,IAA 8例。平均年龄17(3~30)d。平均体重3.06(2.1~4.2)kg。具体病种和临床转归见表1。
1.2 方法 14例手术体外循环均采用深低温停循环方法,采用MAQUET HL20型体外循环机,MAQUET VKMO11000型集合动脉微栓滤器的膜式氧合器,动脉管径3/16英寸,静脉管径1/4英寸,主泵管径1/4英寸。均连接超滤管路,MAQUET Plus 20血液浓缩器。预充液成分包括复方电解质液、20%人血白蛋白、库血、加入或无需加入血浆。心肌保护采用HTK液(50~60 ml/kg)。红细胞比容(Hct)灌注中不低于0.25,停机时达到0.35。流量200 ml/(kg·min),停循环直肠温度20~23℃,停机时直肠温度36~36.5℃,均采用常规超滤,部分复温时采用零平衡超滤。
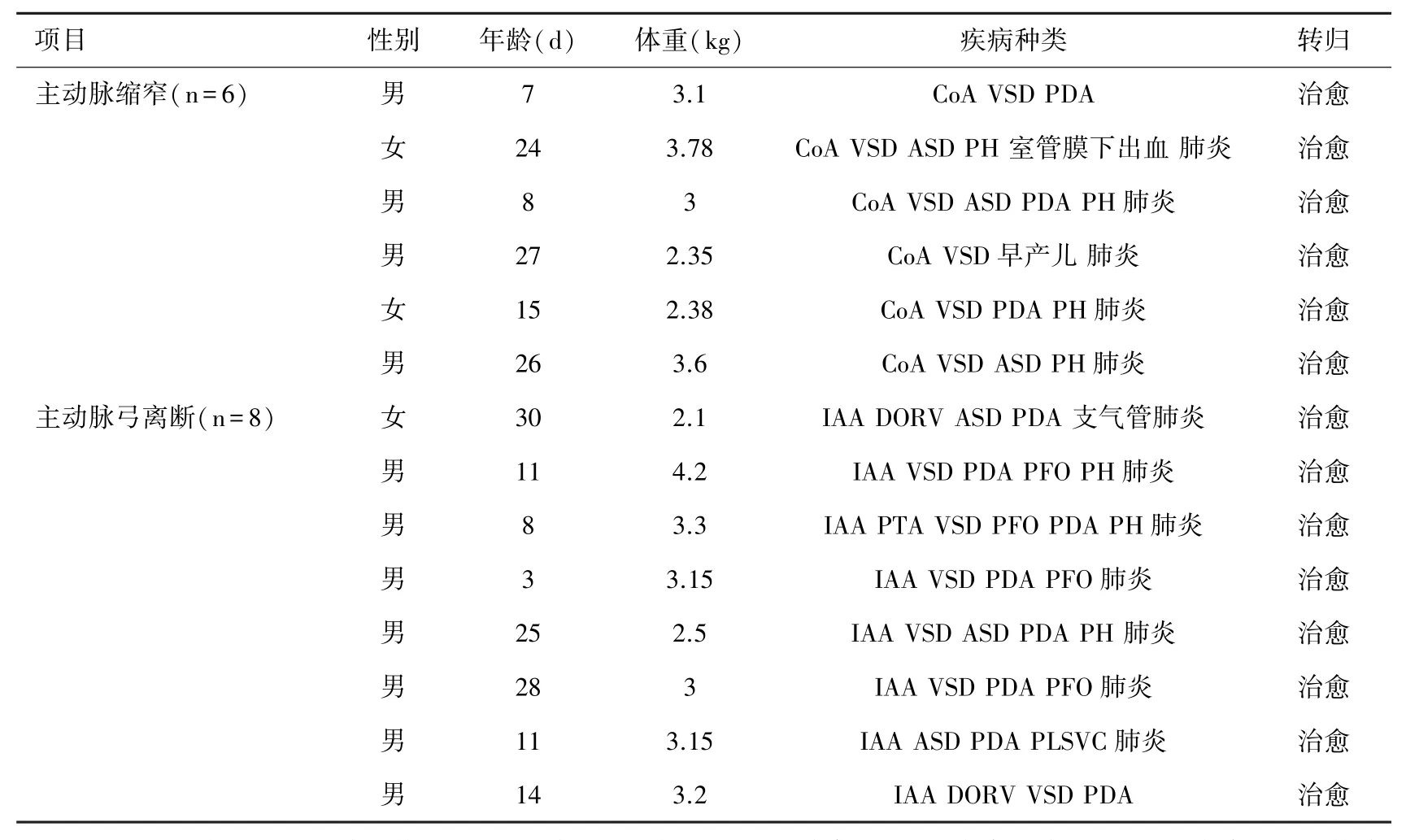
表1 14例新生儿基本临床资料及转归
2 结 果
平均体外循环时间141(66~410)min,平均停循环时间17(15~30)min,平均阻断时间60(32~134)min,后并行时间69(28~284)min。平均住院时间23 d(由于是新生儿,患儿均在监护室看护直至出院),术后呼吸机使用平均7 d。本组14例患者均顺利完成手术,手术矫正满意,手术过程采用常规超滤,5例手术复温后采用复方电解质进行零平衡超滤[1],14例均无需改良超滤,平均辅助69 min后均顺利停机,均在开放后逐渐有尿,无需进行腹膜透析,12例新生儿顺利直接关胸,2例手术(1例IAA PTA VSD PFO PDA PH的患者转流256 min;1例IAA ASD PDA PLSVC的患者手术矫正不满意二次停循环矫正转流410 min)延迟关胸,14例手术均术后恢复良好,顺利出院。
3 讨 论
3.1 预充液的管理 ①尽可能少的预充量[2]。通过使用集合动脉微栓滤器的膜式氧合器、尽可能细的管路和尽量短的管路来减少预充量,14例患儿的全部预充量均在220~240 ml之间,平均230 ml(含超滤管路的预充量60 ml)。均采用主泵(ART)控制模式进行转流,保证转流安全。②控制预充液的质量[2]。调整预充液尽量接近生理水平。根据术前检测患者Hct、血浆总蛋白水平来测算需要加入的库血及血浆的量,保证转流开始患者的Hct在0.28~0.30水平,胶体渗透压在正常范围。由于本组患者均使用的是库存血,采血日期均在两周以上,故在预充液中均根据加入的库血及血浆的量来适当加入5%碳酸氢钠,控制BE值在±3范围内。转流前即对预充液进行超滤,将库血中的高钾、高糖、高乳酸通过超滤控制在生理范围,同时将多出的预充晶体液滤出,保障预充量在(230±10)ml范围。在对预充液进行超滤时同时适当的通气,氧浓度(FiO2)21%,通气流量0.1 L/min,5~10 min,调整预充液的二氧化碳分压在35~45 mm Hg。
3.2 温度管理 体外循环前将变温水箱温度设置在35℃,同时调低室温,进行体表降温,开始体外循环后进行逐步降温,严格控制变温速度,并进行冰敷头部。待直肠温度降至接近23℃时阻断升主动脉,同时灌注HTK液,持续灌注5~7 min,灌注量50~60 ml/kg。在直肠温度降至20℃时,保证Hct不低于25%,停循环。停循环期间变温水毯持续降温保证鼻咽温低于20℃,直肠温度低于23℃。恢复循环同时去除冰帽,逐步复温,手术继续纠正合并的心内畸形,将温度复到28~29℃时维持,防止温度过高造成心脏复跳。接近主动脉开放时再继续复温。开放后逐步复温至直肠温度36℃左右。
3.3 流量及气体的管理 全流量转流,同时降温,根据静脉血氧饱和度(SvO2)调整流量和吸入氧浓度、气流量,控制SvO2在60%~75%,PaO2120~180 mm Hg。全程持续监测静脉血氧饱和度,间断监测血气、电解质、Hct等。在灌注停搏液时根据回流的HTK液的量调整超滤速度。停循环时开启自循环,并低流量通气,氧浓度21%。恢复循环前先关闭自循环及侧路,将氧浓度调至70%~80%,根据静脉回流血SvO2调整氧浓度至正常,恢复循环后根据灌注流量调整气流量,气血比>0.5∶1,直至血液中二氧化碳分压降至正常范围,恢复正常通气血流比。在恢复循环后开启常规超滤,同时加入库血,提高Hct,开放主动脉时保证Hct在0.30~0.32,至停机时Hct达到0.35左右。
3.4 血气、电解质的管理[3]由于新生儿肾功能耐受钠缺失的能力强于钠过度负荷;在整个体外循环过程中,由于麻醉、低血压、低氧时过多分泌抗利尿激素(ADH)易发生低钠,而体外循环中加入碳酸氢钠纠正酸中毒又容易引起高钠血症。所以在整个过程中把握好流量、吸入氧浓度、气流量防止发生代谢性酸中毒与呼吸性酸中毒,术中发生的低钠无需处理,往往在停机后自动恢复正常。钾平衡:新生儿不能承受突然的钾负荷,高钾比低钾更为严重,所以补钾应该格外慎重。14例手术转流开始至开放之前的低钾一般不予处理。钙平衡:新生儿钙代谢的调节机制不健全,开始体外循环到开放之前,尽量保持血钙浓度在0.6~0.8之间,一般低钙不予处理,开放以后5~10 min,心脏复跳良好,再根据血钙浓度适当地补充钙离子使血钙达到正常范围。在体外循环过程中及时监测血气电解质,尽量控制PaO2120~180 mm Hg,PaCO235~45 mm Hg。
3.5 心肌保护 由于新生儿IAA或COA并其它心内畸形手术时间相对较长,还需要停循环,为了更好的心肌保护,外科操作尽量缩短阻断时间,手术医生充分利用逐步降温的时间进行游离血管等操作。待直肠温度降至接近23℃,开始阻断升主动脉,同时灌注HTK液。灌注压力不宜过高[4],灌注压≤70 mm Hg,避免高压对血管内皮的损伤。直肠温度在灌注停搏液的同时继续下降至20℃。在恢复循环后逐步将温度复到28~29℃左右,防止温度过高造成心脏复跳。接近主动脉开放时再继续复温至30~32℃开放。
3.6 脑保护 为避免气体造成的脑栓塞,首先体外循环管路预充进行彻底的排除气体,梯度复温,主动脉开放前心内彻底排气。保持静脉回流通畅,术中监测ACT≥480 s减少血液微栓。低温是预防脑缺血性损伤的最有效方法之一,7例患儿在全身停循环前选择性脑灌继续游离降主动脉1~3 min,在吻合主动脉时开始全身停循环。术中采用均匀降温和复温以防止脑血流和代谢不匹配。在深低温时应用pH稳态进行血气管理。停循环前适当地提高氧浓度以增加组织氧储备,恢复体外循环时提高氧浓度及气流量,维持10 min左右来偿还氧债,同时降低PaCO2至正常水平。
3.7 超滤 14例患儿均采用常规超滤维持Hct在目标值,5例患儿在恢复循环后检测乳酸水平偏高,复温过程中采用复方电解质进行零平衡超滤,以滤出乳酸与炎性介质。其余患儿无需进行零平衡超滤。14例患儿在主动脉开放后均逐渐有尿,且尿量满意,常规超滤将Hct提至0.35再停机,无需再行改良超滤。
4 结 论
新生儿的体外循环管理,尤其是深低温停循环的体外循环管理,从做好预充液的调整到体外循环的全程精细化控制,包括体温管理,流量及Hct管理,血气及电解质的管理,心肌保护,脑保护等,外科手术医生尽量缩短手术时间[5],会对手术结局起到非常重要的作用。
参考文献:
[1]朱德明,王伟,丁文祥,等.平衡超滤法对小儿体外循环中炎症因子的影响[J].临床儿科杂志,2003,1(3):134-137.
[2]龙村,于坤,赵举,等.体外循环手册[M].第2版.北京:人民卫生出版社,2005.358.
[3]Gruenwald CE,Andrew M,Burrows FA,et al.Cardiopulmonary bypass in the neonate[J].Adv Card Surg,1993,4:137-156.
[4]龙村,冯正义.体外循环灌注学[M].第4版.北京:人民军医出版社,2004.624-625.
[5]董培青.体外循环损伤与保护[M].北京:人民卫生出版社,2007.246.
修订日期:(2015⁃09⁃24)
收稿日期:(2015⁃08⁃19)
基金项目:2015年建设中医药强省科研课题(20152020)

