优化气相色谱法测定小鼠血清和肝组织中脂肪酸的含量
李春艳,张秀英,张燕华,徐 尚
(东北农业大学动物医学学院,黑龙江 哈尔滨150030)
脂肪酸是脂质的重要组成元件,在各种组织中都表现出重要的生物学功能。研究表明,脂肪酸与胰岛素抵抗、冠状动脉疾病、高血压、肥胖等慢性病密切相关[1]。在健康状态下,机体组织中的脂肪酸处于相对平衡状态,一旦机体患病,这种平衡将会打破,组织中的脂肪酸组成也将发生改变。因此,建立血清及肝组织中脂肪酸的定性、定量及快速检测方法对医学基础研究及临床检验均具有极其重要的意义,对血清与肝组织中脂肪酸谱的综合分析也将有助于深入揭示不同脂肪酸间以及血清和肝组织脂肪酸变化间的相关性[2]。气相色谱法是脂肪酸分析中最常用的方法,也是ISO 和AOCS 中所采用的方法。本试验采用该方法测定小鼠血清和肝脏17 种脂肪酸的含量,为进一步阐明脂肪酸与疾病预防和治疗的关系、寻找潜在的异常代谢途径或致病机制提供科学依据。
1 材料与方法
1.1 仪器和试剂 日本岛津GC-14C 气相色谱分析仪,氢火焰离子化检测器(FID),色谱工作站(N3000),脂肪酸标准品和13%BF3-甲醇溶液,均购自Sigma 公司,氯仿和甲醇为色谱纯。
1.2 标准溶液的配制 称取每种脂肪酸标准品5 mg,分别置于5 mL 棕色容量瓶中,用正己烷溶解并定容,充分摇匀,配制成1 mg/mL 脂肪酸标准品的贮备液,吹入氮气,密封,4 ℃保存。
1.3 色谱条件 毛细管色谱柱为DB-23(30 m×0.25 mm×0.25 μm,Agilent 公司);载气为氮气(99.999%):流速50 mL/min,氢气:流速50 mL/min,空气:流速500 mL/min;进样1 μL;分流比为1∶30;进样器温度240 ℃;检测器温度260 ℃;柱温程序升温:初始柱温50 ℃,保持2 min,升温速率20 ℃/min,升到170 ℃保持1 min,2 ℃/min 升至240 ℃保持10 min。
1.4 样品处理 样品采集:健康雄性ICR 小鼠,眼球摘除采血,分离血清,并剖检取出肝脏,保存于-80 ℃冰箱。样品萃取:称取肝脏组织100 mg,减碎置匀浆器中,加入1 mL 生理盐水,冰浴中研磨成匀浆,加入三氯甲烷2 mL 甲醇1 mL[3],充分混匀,共重复两次,合并两次提取液[4],3 000 r/mim离心10 min,除去上层液相,下层有机相在氮气流吹干,置-20 ℃冰箱中保存备用。血液样本精确称取100 μL,直接进行皂化衍生。皂化衍生:取出冻存提取物,加0.5 mol/LKOH-甲醇溶液1 mL,充氮气密封,60 ℃水浴10 min,加13% BF3-甲醇1.5 mL,60 ℃水浴40 min,取出置冷,加入正己烷1.5 mL,涡流1 min 提取。加入饱和氯化钠溶液2 mL,3 000 r/mim 离心15 min,静置5 min,取上层液于螺口试管中,吹入氮气,密封,4 ℃冰箱保存。1 μL 进样进行气相色谱分析。
2 结果与分析
2.1 标准曲线的绘制 脂肪酸标准储备液用正己烷分别稀释为8 个系列标准工作液,按照1.5 皂化衍生方法处理后进行分析,将相对应的脂肪酸标准品浓度y 和脂肪酸的色谱峰面积x 做线性回归,其相应的回归方程和相关系数如表1。

表1 脂肪酸的标准曲线和线性范围
2.2 小鼠血清与肝组织中脂肪酸的检测 图谱如 图1 所 示,出 峰 顺 序 依 次 为C12、C14、C15、
C16、C17、C18、C18∶1、C18∶2、C18∶3、C20、C20∶1、C20∶2、C20∶3、C20∶4、C22、C23、C22∶6,根据6次进样确定脂肪酸标准品的保留时间进行定性(如表1 所示)。其中血清和肝脏样本中饱和脂肪酸C20 及C23 仅在极少量样本中有显示,无法进行统计。
2.3 回收率及精密度 准确称取小鼠肝脏100 μg 和血清100 μL,分别各自加入低、中、高3 个浓度的脂肪酸标准品溶液,按1.4 方法操作,每一浓度重复处理并进样5 次,根据峰面积计算加标回收率和日内变异系数,连续测5 d,计算日间变异系数。结果如表2 和表3 所示。
2.4 灵敏度的测定 取空白血清和肝脏,按照1.4 中的样品处理方法处理后,测得基线噪音值,分别按3 倍信噪比和10 倍信噪比获得该方法的检测限和定量限。结果如表1 所示。

图1 气相色谱

表2 血清中脂肪酸不同质量浓度的回收率和变异系数
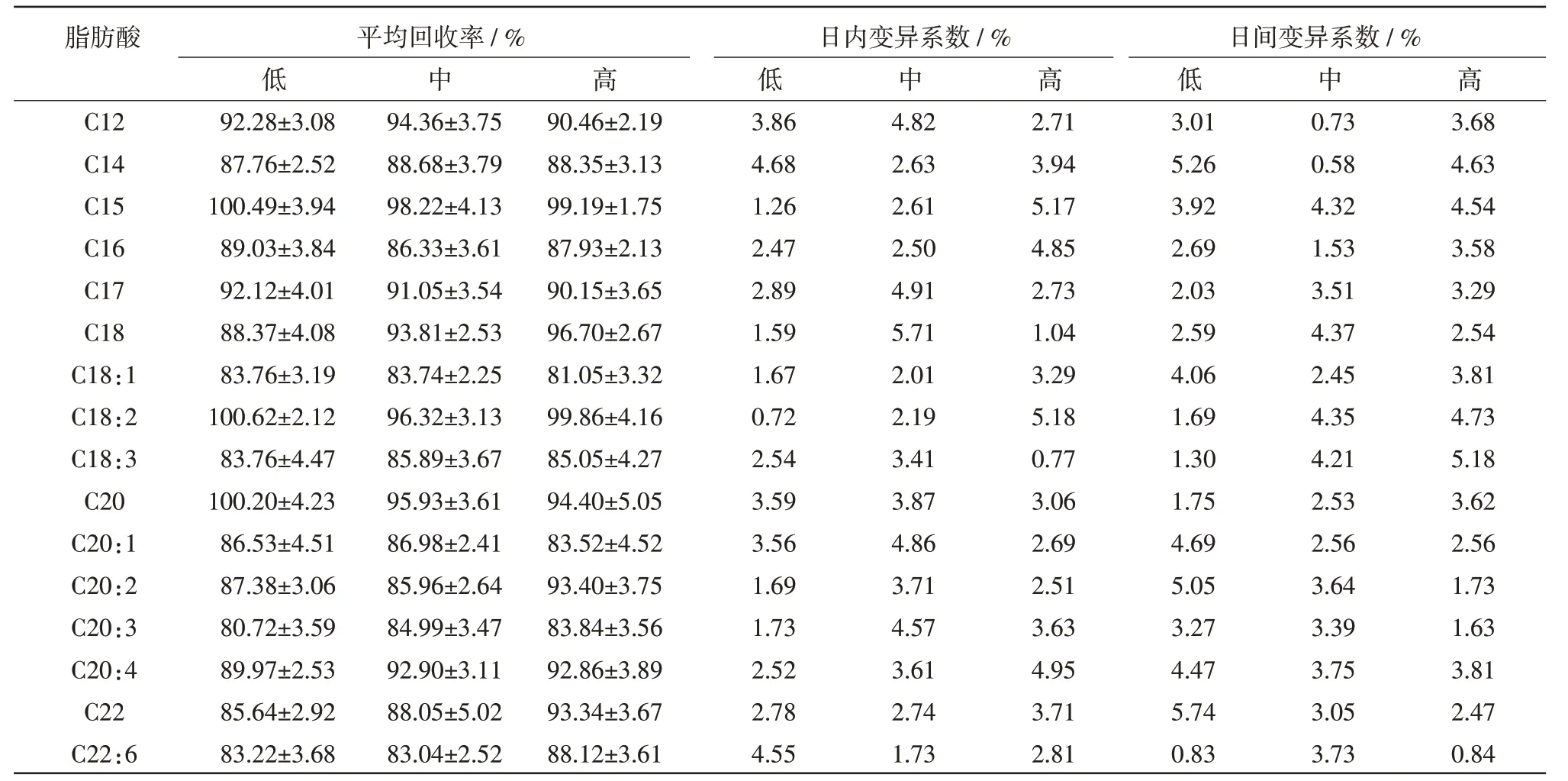
表3 肝脏中脂肪酸不同质量浓度的回收率和变异系数
3 讨论
3.1 色谱条件的选择 本试验所研究的脂肪酸种类多、范围广、沸点范围较大,因此我们采用程序升温和专门为分离脂肪酸甲酯而设计的强极性柱。程序升温过程我们借鉴了Ma 等[5]的报道,并进行了优化。从色谱图看,组织中的脂肪酸均得到了很好的分离。
3.2 样品处理方法的优化 在预试验中,我们对短期的冰冻组织和新鲜组织分别进行了脂肪酸含量的测定,发现二者差别不显著,所以短期的冰冻对脂肪酸含量的测定没有影响。
在肝脏组织前处理中,我们采用了经典的Floch 法,经过两次抽提以减少脂质丢失。对甲酯化的温度和时间进行研究,结果筛选出的脂肪酸甲酯化最佳条件是60 ℃和40 min,与Intorre 等[6]的衍生化条件较接近。在衍生化后,我们选择提取层溶液直接进样分析,而不是大多文献[2]采用的氮气吹干后复溶再进样分析。前期我们通过对比发现经过氮气吹干后再复溶会使一些脂肪酸的含量变低,可能是由于一些脂肪酸甲酯具有较高的挥发性。
3.3 方法学的验证 在试验条件下,组织中17 种脂肪酸的检测限范围是100 ng/mL~300 ng/mL。比国标[7]中报道的检测限低。在高、中、低3 个添加浓度水平下,测得小鼠血清和肝脏回收率均大于80.72%,精密度小于5.74%。说明本方法测定组织中脂肪酸具有准确度好、重现性稳定、灵敏度高等优点,为脂肪酸含量检测提供了简便、快速、灵敏、准确的方法。
[1] Karpe F,Dickmann J R,Frayn K N.Fatty acids, obesity,and insulin resistance:time for a reevaluation[J] . Diabetes,2011,60(10):2441-2449.
[2] 李海静,吴胜明,方均建.气质联用法测定人血清游离脂肪酸[J].质谱学报,2009,30(2):83-87.
[3] Folch J,Lees M,Sloane-Stanley G H.A simple method for the isolation and purification of total lipids from animal tissues[J] .Journal of Biological Chemistry,1957,226(1):497-509.
[4] 姜文宇,方京冲,史虹莉.气相色谱法测定血清脂肪酸组分[J].复旦学报(医学版),2003,4:022.
[5] Ma D W L,Ngo V,Huot P S P,et al.N-3 polyunsaturated fatty acids endogenously synthesized in fat-1 mice are enriched in the mammary gland[J].Lipids,2006,41(1):35-39.
[6] Intorre F,Venneria E,Finotti E,et al.Fatty acid content of serum lipid fractions and blood lipids in normolipidaemic volunteers fed two types of cheese having different fat compositions:a pilot study[J].International Journal of Food Sciences and Nutrition,2013,64(2):185-193.
[7] 粮食部食品质量监督检验测试中心.GB/T 21676-2008 乳与乳制品脂肪酸的测定气相色谱法[S].北京:中国标准出版社,2008.

