重组溶葡萄球菌酶阴道泡腾片的质量研究
陆珉,黄青山,张继恩
(1.复旦大学生命科学院遗传学研究所遗传工程国家重点实验室,上海 200433;2.昆山博青生物科技有限公司,江苏昆山215316)
重组溶葡萄球菌酶阴道泡腾片的质量研究
陆珉1,2,黄青山1,2,张继恩2*
(1.复旦大学生命科学院遗传学研究所遗传工程国家重点实验室,上海 200433;2.昆山博青生物科技有限公司,江苏昆山215316)
对重组溶葡萄球菌酶阴道泡腾片进行质量研究。考察泡腾片外观性状、鉴别、酸碱度、融变时限、微生物限度、发泡量、重量差异以及含量测定(主要针对含量测定进行方法学验证),确定泡腾片质量标准;同时考察泡腾片的稳定性。结果表明,重组溶葡萄球菌酶阴道泡腾片外观性状、鉴别、酸碱度、融变时限、微生物限度、发泡量、重量差异结果符合要求,含量测定为标示量的80%~150%。稳定性实验表明在干燥、阴凉、密封条件下,重组溶葡萄球菌酶阴道泡腾片至少能保质24个月。由此确定泡腾片质量符合拟定的企业质量标准。
重组溶葡萄球菌酶;阴道泡腾片;质量研究
母猪阴道炎是母猪繁殖障碍病中的主要疾病之一,引发猪阴道炎的病原细菌主要有葡萄球菌、链球菌、大肠杆菌、棒状杆菌等。调查显示,母猪阴道炎发病率高,且治愈率低。目前尚缺少相应的生物新型药物治疗母猪阴道炎[1-3]。重组溶葡萄球菌酶阴道泡腾片是一种用于治疗哺乳动物阴道炎的阴道泡腾片剂。该制剂通过给药进入哺乳动物阴道后,能够在体液的作用下泡腾崩解,使药物混合于泡沫中快速释放,药物与阴道黏膜的接触面积更大,使药物能渗入黏膜褶皱深部,延长药物与黏膜作用时间,提高局部组织药物浓度,进而增强治疗效果,有效杀灭由葡萄球菌、链球菌等引起的细菌性阴道炎。本研究考察重组溶葡萄球菌酶阴道泡腾片外观性状、鉴别、酸碱度、融变时限、微生物限度、发泡量、重量差异以及含量测定,同时考察阴道泡腾片的稳定性,以期建立重组溶葡萄球菌酶阴道泡腾片的质量标准。
1 仪器与试剂
1.1 仪器 W-CJ-2D型双人超净台(苏州净化设备有限公司);HTY-300型微生物限度检测仪(杭州泰林生物技术设备有限公司);UV757型紫外分光光度计(上海精密科学仪器有限公司);高速冷冻离心机(艾本德(上海)国际贸易有限公司);融变时限仪(上海黄海药检仪器有限公司);FA2004电子天平(上海方瑞仪器有限公司)。
1.2 试剂 营养琼脂培养基和玫瑰红钠培养基(中国医药集团化学试剂有限公司);十六烷基三甲基溴化铵培养基、哥伦比亚琼脂培养基、甘露醇高盐琼脂培养基、沙氏葡萄糖琼脂培养基(上海盛思生化科技有限公司),色源底物KNR-PG(偶联活性艳蓝染料KNR的金黄色葡萄球菌细胞壁肽聚糖);溶葡萄球菌酶工作参考品(上海高科联合生物技术研发有限公司,290 U/支,批号:20130403);甘氨酸(上海惠兴生化试剂有限公司);氢氧化钠(上海山浦化工有限公司);Tris,HCl(上海蓝季科技发展有限公司)。
重组溶葡萄球菌酶阴道泡腾片3批,批号:20110301、20110302、20110401、20141101、20141102、20141103,昆山博青生物科技有限公司生产。
2 方法
2.1 样品检测 取重组溶葡萄球菌酶阴道泡腾片,按2010年版《中华人民共和国兽药典》[4]及2010年版《中华人民共和国药典》[5]要求,对外观性状、鉴别、酸碱度、融变时限、微生物限度、发泡量、重量差异进行测定。
2.2 含量测定 取重组溶葡萄球菌酶阴道泡腾片1片,精密加0.05 mol/L Tris-盐酸缓冲液20 mL,使成每1 mL中约含10单位的溶液,0.45 μm微孔滤膜过滤,取滤液作为供试品溶液,以重组溶葡萄球菌酶标准品作为校准,照农业部公告的方法测定[6]。
重组溶葡萄球菌酶阴道泡腾片由于其配方、作用原理及使用方法与原有的重组溶葡萄球菌酶粉不同,在检测时需提前进行泡腾溶解,在泡腾时会产生一定体积的泡沫,因此,在选择色源底物比色法作为重组溶葡萄球菌酶阴道泡腾片的酶含量检测方法时,对该方法重新进行了方法学的验证。主要从重组溶葡萄球菌酶阴道泡腾片的特点出发,考察现有检测方法在测定重组溶葡萄球菌酶阴道泡腾片时的线性范围、准确性、精密性、专属性及耐用性等方面是否符合相关要求。
2.2.1 线性与范围 按表1所示,取一定量酶活测定供试品溶液用于测定,按管号加入对应量的标准品品溶液,共测定10个稀释度,每个稀释度重复测定3份。
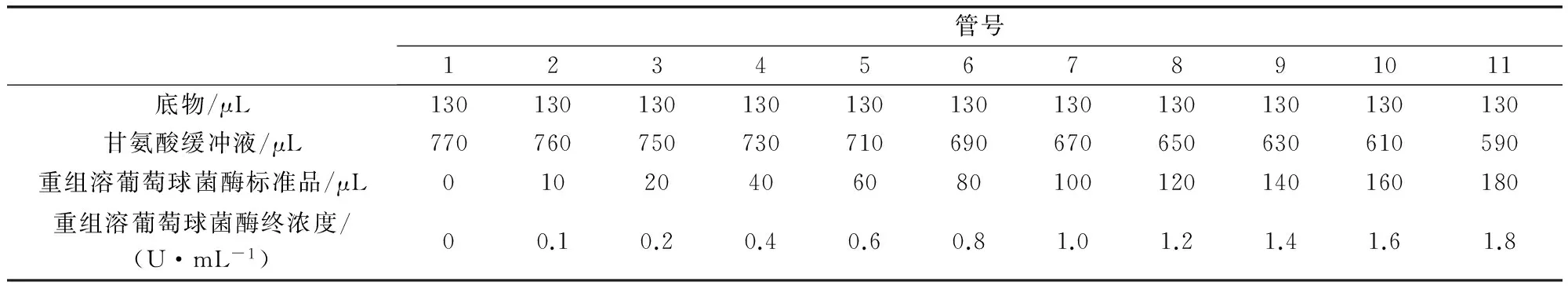
表1 线性与范围测定
2.2.2 准确性 用重组溶葡萄球菌酶标准品制备标准曲线,取泡腾片样品泡腾于20 mL体积纯化水中,0.45 μm微孔滤膜过滤,取泡腾液50 μL加样,进行酶含量测定,同时取一粒泡腾片所需的压制前混合粉,溶解泡腾于同样体积中,取泡腾液进行含量测定,另取以制备该批泡腾片所用的同批次同等量的酶粉作为对照,检测阴道泡腾片剂样品中的重组溶葡萄球菌酶在不同时期酶含量的回收率。以上试验重复3次。
以标准品活性(U/mL)与相对应的OD595值进行线性回归,求得回归曲线方程及曲线参数,根据样品测得的OD595值与回归方程求得样品的酶活性。以溶葡萄球菌酶酶粉测定结果为100%标示量,比较其他两组样品对标示量的回收率及比较3组测定值的均值、标准差及变异系数。
2.2.3 试验内精密度 取重组溶葡萄球菌酶阴道泡腾片酶活测定供试品溶液,加样体积分别为30、50、70 μL,每个体积加平行10管,依法测定。
2.2.4 试验间精密度 取重组溶葡萄球菌酶阴道泡腾片酶活测定供试品溶液,加样体积分别为30、50、70 μL,每个体积加平行3管,依法测定。共进行3次,由不同检测人员分别测定。
2.2.5 专属性 取重组溶葡萄球菌酶阴道泡腾片酶活测定供试品溶液,进行酶含量测定,同时不含溶葡萄球菌酶的空白阴道泡腾片作为对照品,同法进行泡腾及测定。实验重复3次。
2.3 稳定性试验 重组溶葡萄球菌酶阴道泡腾片的稳定性试验包括加速试验、长期留样试验两部分。根据《中华人民共和国兽药典》附录246“兽药稳定性试验指导原则”要求,对重组溶葡萄球菌酶泡腾片进行4500lx±500lx照度条件下的光照影响因素试验;(60±2)℃及(40±2)℃条件下的高温影响因素试验;90%±5%、75%±5%及65%±5%的高湿影响因素试验;(30±2)℃、相对湿度(65±5)%条件下的加速试验和(25±2)℃、相对湿度(60±10)%条件下长期试验。样品分组与评价方法如下:
2.3.1 光照影响因素试验组 从20110301批中选取20片,除去外包装,平铺于开口容器中,放置于照度为4500lx±500lx的光照箱中。分别于0、5、10 d随机取出样品,对外观性状、融变时限、吸湿率、酶含量及重量差异进行评价。
吸湿率检测方法,取检测样品,在0 d精密测定重量,在规定时间内再次精密测定重量,与0 d时样品重量相比较,观察样品重量差异变化,得出吸湿增重率。
2.3.2 高温影响因素试验组 从20110301批中选取40片,除去外包装,平铺于开口容器中,分别放置于温度为(60±2)℃及(40±2)℃的恒温箱中,各20片。分别于0、5、10 d随机取出样品,对外观性状、融变时限、吸湿率、酶含量及重量差异进行评价。
2.3.3 高湿影响因素试验组 从20110301批中选取60片,除去外包装,平铺于开口容器中,分别放置于湿度为90%±5%、75%±5%及65%±5%的恒湿密闭容器中,各20片。分别于0、5、10 d随机取出样品,对外观性状、融变时限、吸湿率、酶含量及重量差异进行评价。
2.3.4 加速试验组 从20110301、20110302、20110401批中选取60片,共180片,用一容器按批次分区排放,放置于温度为(30±2)℃、湿度为(65±5)%的恒温恒湿培养箱内。于0月、1月、2月、3月及6月随机取出样品,对外观性状、融变时限、吸湿率、微生物限度及酶含量进行评价。其中微生物限度检查项仅在稳定性试验开始与结束时检测。
2.3.5 长期留样试验组 从20110301,20110302,20110401批中随机取80片,共240片,用一容器按批次分区排放,放置于温度为(25±2)℃、湿度为(60±10)%的恒温恒湿培养箱内。于0月、3月、6月、9月、12月、18月、24月、36月随机取出样品,对外观性状、融变时限、吸湿率、微生物限度、及酶含量进行评价,第24月,36月检测发泡量。其中微生物限度检查项仅在0月、12月、24月、36月时检测。
3 结果与分析
3.1 样品检测
3.1.1 外观性状 20141101、20141102和20141103批次样品均为片形一致,片面光洁、色泽均匀、质硬的类白色片剂。
3.1.2 鉴别 按照2010年版《中华人民共和国药典》附录VIIIB免疫斑点法,阳性结果应呈明显色带,阴性结果不显色。结果如图1所示。

图1 重组溶葡萄球菌酶阴道泡腾片免疫斑点法鉴别结果(1.阳性对照,2.样品20141101,3.样品20141102,4.样品20141103,5.阴性对照)
3.1.3 酸碱度 20141101、20141102和20141103批次样品酸碱度结果分别为6.9,6.9,7.0。符合质量标准设定的6.0~8.0。
3.1.4 融变时限、微生物限度、发泡量 20141101、20141102和20141103批次样品融变时限、微生物、发泡量均符合兽药典要求。
3.1.5 重量差异 20141101、20141102和20141103批次样品重量差异均小于±2%,符合兽药典要求。
3.2 含量测定 结果如表2所示。3批次样品的酶含量均在标示量的80%~150%之间,符合拟定的质量标准。

表2 3批重组溶葡萄球菌酶阴道泡腾片的含量测定结果
3.2.1 线性与范围 结果如表3所示。反应体系中酶终浓度在0.2~1.0 U/mL范围内具有很好的线性,因此,将测定的标准曲线范围定为0.2~1.0 U/mL。

表3 3次线性范围试验结果(n=3)
3.2.2 准确性 结果如表4所示。用标准品制备标准曲线,以制备泡腾片样品的同批次等量酶粉作为对照,测定泡腾片成品及泡腾片混合粉在泡腾后的酶含量,计算回收率,同时加入不同的测活体积,试验了此方法测定溶葡萄球菌酶生物活性的准确性。由结果可见,测定方法的准确性高,加入不同的测活体积的结果无明显差别,泡腾片成品的泡腾液经回算后回收率分别达到103%、99%、97%。

表4 三次试验回收率结果(n=3)
3.2.3 试验内精密度 结果如表5所示。同一试验内不同浓度样品测定的变异系数均<10%,表明测定方法一试验内精密性高。
3.2.4 试验间精密度 结果如表6所示。多次试验间不同浓度样品测定的变异系数均<10%,表明测定方法在多次试验间的精密性高。

表5 不同加样体积测定结果
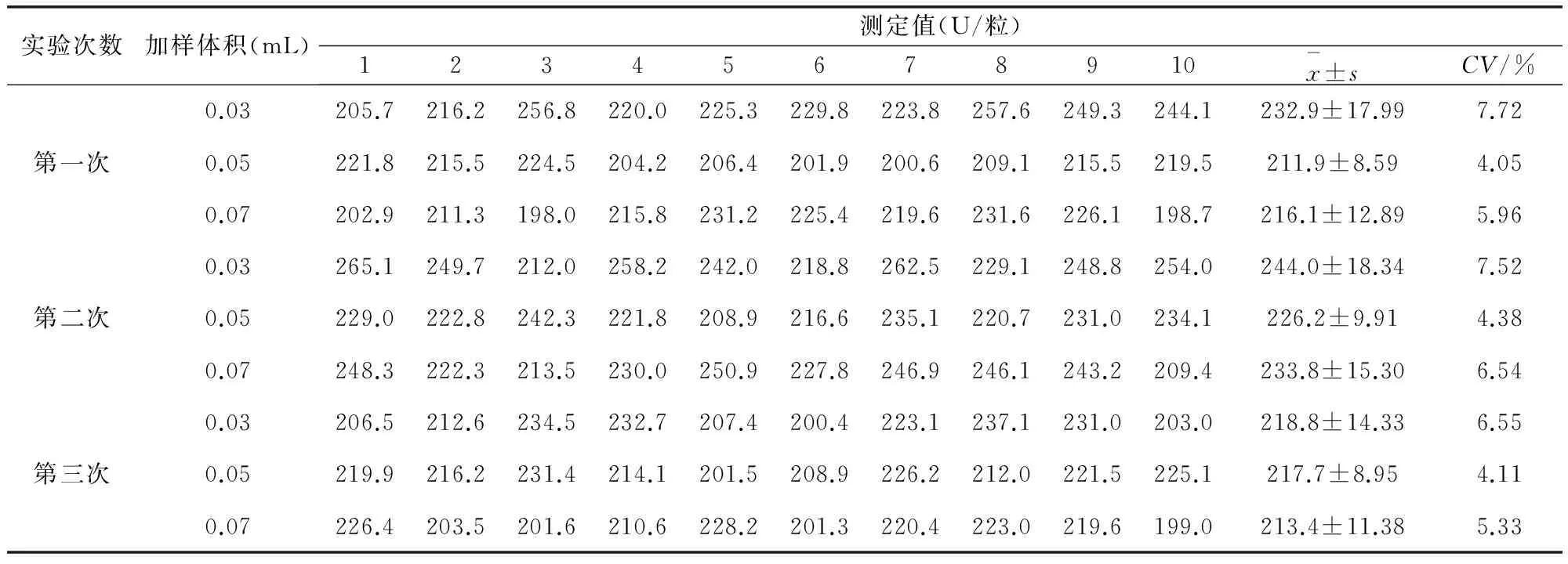
表6 三次不同加样体积的测定结果
3.2.5 专属性 结果如表7所示。以不含溶葡萄球菌酶的空白泡腾片为对照,在泡腾片酶浓度测定正常的同时,空白泡腾片完全测不出有酶活性。表明测定方法的专属性好。

表7 三次不同样品的OD595测定值及酶含量(U/粒)
3.3 稳定性试验结果
3.3.1 光照影响因素试验结果 重组溶葡萄球菌酶阴道泡腾片在4500±500lx光照强度下,10 d的考察期内,酶活性等各项指标无明显变化。
3.3.2 高温影响因素试验结果 重组溶葡萄球菌酶阴道泡腾片在(60±2)℃高温条件下,10 d的考察期内,酶活性有较明显的下降,其他无明显变化,(40±2)℃高温条件下,10 d的考察期内,酶活性等各项指标无明显变化。
3.3.3 高湿影响因素试验结果 重组溶葡萄球菌酶阴道泡腾片在95%±5%及75%±5%高湿条件下,10 d的考察期内,片剂外观变不平整,吸湿重量增加明显,酶含量有一定下降,其他指标无明显变化,在65%±5%湿度条件下各项指标无明显变化。实际生产中环境湿度都控制在低于65%以下。
3.3.4 加速实验结果 重组溶葡萄球菌酶阴道泡腾片在(30±2)℃条件下,6个月的考察期内,外观性状、微生物、酶活性等各项指标无明显变化。
3.3.5 长期实验结果 重组溶葡萄球菌酶阴道泡腾片在(25±2)℃条件下,36个月的考察期内,外观性状、微生物、酶活性等各项指标无明显变化。
4 讨论与小结
含量测定方法学验证试验结果显示,在色源底物法的测定条件下,反应体系中酶终浓度在0.2~1.0 U/mL范围内具有很好的线性,相关系数均为99.9%以上,多次测定回归曲线相关系数的CV<5%。因此,将测定的标准曲线范围定为0.2~1.0 U/mL。且色源底物法测定的准确性好、精密性高、专属性好,适宜于大量样品的测定,可以用于重组溶葡萄球菌酶阴道泡腾片的溶葡萄球菌酶生物活性的定量测定。
检测结果显示,重组溶葡萄球菌酶阴道泡腾片外观形状、鉴别、酸碱度、融变时限、微生物限度、发泡量、重量差异结果符合要求,含量测定为标示量的80%~150%。稳定性试验结果表明:温度、湿度是重组溶葡萄球菌酶泡腾片质量标准制订和运输保存必须考虑的关键指标;干燥、阴凉、密封是重组溶葡萄球菌酶泡腾片最佳保存温度条件,并至少能保质24个月。
当前国内外对母猪阴道炎的治疗方法主要有消毒剂治疗,抗生素注入,或者两者相结合治疗。消毒剂冲洗常用1000 mg/mL高锰酸钾或者500 mg/mL新洁尔灭冲洗阴道或者洗必泰栓给药治疗[7]。抗生素注入国内主要用土霉素注入剂,国外则通常在分离致病菌后进行药物敏感性测试再选用四环素类,磺胺类,青霉素类,氨基糖苷类或呋喃类抗生素[8-9]。消毒剂治疗由于通常要进行大量冲洗,粘膜受刺激较大,外阴红肿强烈且治疗效果不佳。抗生素类药物治疗会抑制阴道内有益细菌的正常生长,破坏阴道内的微生态平衡,致病菌大量繁殖,增加了治疗难度;而且长期使用抗生素,极易使致病菌产生耐药性。重组溶葡萄球菌酶阴道泡腾片作为一种生物酶制剂与抗生素、化学药物有着完全不同的杀菌机理,没有药物残留问题。重组溶葡萄球菌酶阴道泡腾片的研制为治疗母猪阴道炎提供了一种新的选择。
[1] Stephen P Hawser.Lysostaphin and clarithromycin: a promising combination for the eradication of Staphylococcus aureus biofilms[J].Letters to the Editor / International Journal of Antimicrobial Agents,2011,37 (6): 585-587.
[2] 林莉,王德容,陈勇,等.“蒲公英散”治疗母猪阴道炎的疗效观察[J].畜牧市场,2010,5:50-52.
[3] Schmelcher,MAMPowell,SCBecker,etal.Chimeric phage lysins act synergistically with Lysostaphin to kill mastitis causingStaphylococcusaureusin murine mammary glands[J].Appl Environ Microbiol,2012,1:1-19.
[4] 中国兽药典委员会.中华人民共和国兽药典2010年版一部[M].北京:中国农业出版社,2010.
[5] 中国药典委员会.(2010)中华人民共和国药典 2010年版三部[M].北京:中国医药科技出版社,2010.
[6] 中华人民共和国农业部第1653号公告.重组溶葡萄球菌酶粉附2重组溶葡萄球菌酶活性测定法[S].
[7] 卫永明,吴国良,李光良.高锰酸钾溶液结合抗生素治疗母猪脓性阴道炎[J].上海畜牧兽医通讯,1995,(5):7.
[8] Maes,D.,M.Verdonck,A.D.Kruif.Vaginal microecology and vulval discharge in swine[M].Belgium.1999: 39-50.
[9] Oravainen J.Field studies on infectious reproductive diseases and lameness in sows[M].Helsinki:University of Helsinki,2008:1-37.
(编辑:侯向辉)
Quality Research of the Recombinant Lysostaphin Vaginal Effervescent Tablets
LU Min1,2,HUANG Qing-shan1,2,ZHANG Ji-en2*
(1.StateKeyLaboratoryofGeneticEngineering,InstituteofGenetics,SchoolofSciencesFudanUniversity,Shanghai200433,China;2.KunShanBiogreenTechnologyCO.,Ltd,Kunshan,Jiangsu215316,China)
To assess the recombinant lysostaphin vaginal effervescent tablets,indicators,such as appearance,identification,pH,melt time,microbial limit,foam volume,weight variation,and assay,were investigated.In addition,the methodology of content determination was validated.And the stability of the tablet was investigated.The results showed that appearance,pH,melt time,microbial limit,foam volume,weight variation of the tablet were conform to the requirement.The content of the results was from 80% to 150% of labelled amount.Under the conditions of dry,cool and seal,the storage phase of the tablet reached at least 24 months.Thus it was confirmed that quality of the tablet was conform to the standard of the enterprise.
recombinant lysostaphin;vaginal effervescent tablets;quality research
国家星火计划项目(2012GA690003)
陆珉,硕士研究生,工程师,从事生物酶制剂质量研究。
张继恩。E-mail:jienzhang@163.com
2015-09-18
A
1002-1280 (2015) 12-0014-06
S852.61

