脓毒症患者血中CD4+CD25+调节性T细胞水平与机体细胞免疫状态的相关性研究
耿延青

[摘要] 目的 探讨脓毒症患者CD4+CD25+调节性T细胞(Treg)的水平与细胞免疫的关系。 方法 以2013年7月~2014年6月浙江省温岭市第一人民医院收治的脓毒症患者53例为观察组。将观察组患者按病情分为脓毒症组(18例)、严重脓毒症组(21例)、脓毒症休克组(14例);按28 d预后情况分为死亡组(16例)和存活组(37例)。另选取25名健康者为对照组。用流式细胞仪检测CD4+CD25+Treg及T细胞亚群水平并进行组间比较。 结果 CD4+CD25+Treg表达率:脓毒症休克组>严重脓毒症组>脓毒症组>对照组,各组间差异有统计学意义(P < 0.05)。CD3+、CD4+和CD4+/CD8+水平:脓毒症组>对照组>严重脓毒症组>脓毒症休克组,各组间差异有统计学意义(P < 0.05)。CD8+水平各组间差异无统计学意义(P > 0.05)。死亡组CD4+CD25+Treg表达率明显高于存活组(P < 0.05);CD3+、CD4+、CD4+/CD8+水平明显低于存活组(P < 0.05);CD8+水平两组间差异无统计学意义(P > 0.05)。 结论 脓毒症患者Treg细胞水平增高,可能导致T淋巴细胞亚群水平降低,在预测患者预后方面有一定作用。
[关键词] 脓毒症;细胞免疫;CD4+CD25+调节性T细胞
[中图分类号] R392 [文献标识码] A [文章编号] 1673-7210(2015)01(c)-0007-05
脓毒症(sepsis)是感染导致的炎症反应综合征(systemic inflammatory response syndrome,SIRS)。脓毒症造成多器官功能衰竭是严重创伤患者死亡的主因之一。已往研究认为,脓毒症是过度炎性反应的一系列综合征,也就是机体自身灭活病原体的免疫机制被过度激活,导致炎性反应失控,从而引起机体自身损伤,导致多器官功能衰竭甚至死亡。对脓毒症发病机制的深入探索揭示,除了病原菌及其毒素对正常组织的侵害之外,机体自身免疫功能失衡也在脓毒症的发病及进展中也起着重要作用[1]。免疫亢进与免疫抑制两种病理状态同时存在,加剧了脓毒症的进展。近年研究发现,机体中存在着CD4+CD25+调节性T细胞(Treg细胞)。脓毒症患者Treg水平升高,从而启动免疫抑制效应,诱发T淋巴细胞过度凋亡,这正是脓毒症患者免疫功能紊乱的发生机制[2]。本研究检测了脓毒症患者Treg细胞与T细胞亚群水平,分析两者的相关性及与脓毒症患者病情与预后的关系,现总结报道如下:
1 资料与方法
1.1 一般资料
选取2013年7月~2014年6月在浙江省温岭市第一人民医院(以下简称“我院”)治疗的脓毒症患者53例为观察组。纳入标准:符合国际脓毒症定义会议制订的诊断标准。排除标准:①患有自身免疫系统疾病;②急性脑卒中;③心肌梗死;④病毒性肝炎;⑤HIV感染;⑥入院前3个月内使用过激素或免疫抑制剂者。入选患者男31例,女22例;年龄31~69岁,平均(58.52±13.46)岁。疾病构成:消化道穿孔破裂术后21例;胆囊坏死及重症胆管炎12例;肠梗阻术后9例;肺部感染11例。选取25名健康者为对照组,男15例,女10例;年龄32~65岁,平均(56.25±14.62)岁。将观察组患者按疾病严重程度分为脓毒症组(18例)、严重脓毒症组(21例)、脓毒症休克组(14例);按28 d预后情况分为死亡组(16例)和存活组(37例)。
1.2 方法
1.2.1 一般监测指标 监测记录血乳酸水平、氧合指数;评估急性生理和慢性健康评分(APACHEⅡ评分)。血乳酸水平检测仪器为美国雅培I-Stat血液分析仪。抽取动脉血1 mL,应用电极法测定血乳酸值。氧合指数通过测定动脉氧分压后计算得出(氧合指数=动脉氧分压/吸入氧浓度)。APACHEⅡ评分包括急性生理评分、年龄评分、慢性健康评分三部分,总分0~71分。
1.2.2 试验指标 符合脓毒症诊断标准的患者于入选当天采肘静脉血10 mL,4 h内应用流式细胞仪检测CD4+CD25+Treg及T细胞亚群水平。另25名例健康者作为对照组同期进行试验。
试剂与仪器:异硫氰酸荧光素(FITC)标记的小鼠抗人CD25单抗,藻红蛋白(PE)标记的CD4单抗,CD25同型阴性对照试剂,CD4-FITC/CD8-PE/CD3-PE-CYS试剂(美国Beckman-Coulter公司),细胞膜渗透性试剂盒(美国eBioscience公司)。流式细胞仪(美国Beckman-Coulter公司)。
CD4+CD25+Treg检测:将25 μL抗凝全血加入试管中,再添加5 μL CD25-FITC与5 μL CD4-PE,混匀并在室温环境下避光反应15 min,添加500 μL溶血剂,放置于37℃水浴箱中保存10 min,然后上流式细胞仪检测。T细胞亚群检测:取100 μL全血,采用全血流式细胞仪三色标记法(直接免疫荧光标记法),确定CD3+、CD4+、CD8+并计算CD4+/CD8+。
1.3 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 各组一般临床资料比较
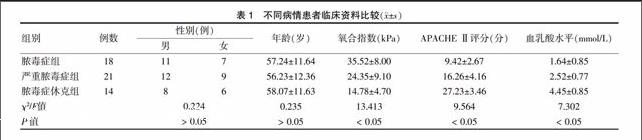
不同病情患者各指标比较:血乳酸水平、APACHEⅡ评分,脓毒症休克组>严重脓毒症组>脓毒症组(P < 0.05);氧合指数,脓毒症组>严重脓毒症组>脓毒症休克组(P < 0.05)。见表1。
不同预后患者各指标比较:存活组血乳酸水平、APACHEⅡ评分低于死亡组(P < 0.05);存活组氧合指数高于死亡组(P < 0.05)。见表2。
2.2 各组CD4+CD25+Treg表达率与T细胞亚群水平比较
不同病情患者各指标比较:CD4+CD25+Treg表达率,脓毒症休克组>严重脓毒症组>脓毒症组>对照组(P < 0.05);CD3+、CD4+和CD4+/CD8+水平,脓毒症组>对照组>严重脓毒症组>脓毒症休克组(P < 0.05);CD8+各组间差异无统计学意义(P > 0.05)。见表3。
不同预后患者各指标比较:死亡组CD4+CD25+Treg表达率明显高于存活组(P < 0.05);CD3+、CD4+、CD4+/CD8+明显低于存活组(P < 0.05);CD8+两组间差异无统计学意义(P > 0.05)。见表4。
2.3 各指标相关性分析
脓毒症患者CD4+CD25+Treg表达率与APACHEⅡ评分呈正相关(r=0.793,P < 0.05);与血乳酸水平呈正相关(r=0.627,P=0.01);与CD4+/CD8+呈负相关(r=-0.623,P < 0.05)。
3 讨论
3.1 促炎/抗炎反应失衡促进脓毒症发病的机制
脓毒症的本质是机体对感染的过度免疫反应。目前认为促炎反应/抗炎反应动态失衡在脓毒症的发生发展中起重要作用。促炎/抗炎反应过程可分为两个阶段:
第一个阶段是炎症反应综合征期。此时期的显著特征是细胞免疫状态呈增高趋势,主要为大量产生TNF-α、IL-1β等前炎症细胞因子,使机体的炎性反应被充分激活,导致单核细胞急剧增殖,同时活性水平增高,分泌TNF-α、IL-1、IL-6、IL-8、IL-12等细胞因子,诱导抗原性T淋巴细胞活化。TNF-α、IL-1 和 IL-6也是脓毒症早期的促炎因子,可以通过促进自由基、缓激肽、组胺等产生,激活补体等,加重脓毒症患者的组织损伤[3]。另外,在脓毒症患者的促炎反应还表现为前列腺素E2(PGE2)和转化生长因子-β(TGF-β)合成增多,对机体的免疫功能产生了很大的影响[4]。
第二个阶段是代偿性抗炎反应期。激发炎症反应综合征之后,随着脓毒症促炎反应发展,在脓毒症的后期,机体启动代偿性抗炎反应,进入免疫抑制状态,严重者甚至出现免疫麻痹,其典型表现是CD4+ T淋巴细胞以及B淋巴细胞不断出现凋亡,而且增殖能力明显降低,其造成的免疫抑制是脓毒症病理生理机制的关键环节,使机体对病原体的易感性明显增加。同时,在机体的负向调控机制中,细胞因子也发挥了重要的作用。IL-10是由多种细胞(如单核细胞、T细胞、B细胞、肥大细胞等)分泌的抗炎细胞因子,是机体重要的免疫调节因子,作为抗炎因子主要对单核/巨噬细胞发挥影响,抑制巨噬细胞的黏附、激活。随着IL-10等抗炎细胞因子水平升高以拮抗过度产生的前炎症细胞因子,而前炎症细胞因子水平明显降低,导致机体免疫功能低下,尤其是抗感染的功能严重受损,成为病情进一步恶化的主要原因。研究证实,IL-10水平升高被认为与脓毒症时免疫功能紊乱相关[5]。有报道显示,应用相应的抗原和IL-10反复刺激可以抑制细胞因子,诱导特异性调节性T淋巴细胞增殖、克隆,从而发挥免疫抑制作用。
3.2 Treg细胞对脓毒症免疫功能的影响
在动物和人类脓毒症患者中,均被证实发生了大量CD4+T淋巴细胞和B淋巴细胞凋亡。秦庆华[6]指出,大约1/2由于脓毒症致死的患者表现为淋巴细胞的凋亡增加,虽然未发现CD8+T淋巴细胞等的数量出现明显减少,但CD4+T淋巴细胞和B淋巴细胞浓度均显著降低。由于淋巴细胞的大量凋亡,使活化的T淋巴细胞不断被清除,这诱导了T淋巴细胞的克隆无反应性,导致其对抗原刺激失去反应,无法对抗病原体的侵袭,并且分泌细胞因子的能力也明显受到抑制。伴随着淋巴细胞大量凋亡的还有树突状细胞,后者是功能最强的抗原递呈细胞,其凋亡使细胞的抗原递呈能力明显受损,进而引起CD4+T淋巴激活功能障碍,进一步加剧了机体的免疫功能异常反应。
CD4+CD25+Treg是1995年Sakaguchi等在小鼠体内发现的,其在正常人和小鼠外周血CD4+T细胞中的含量占1%~2%,主要特征性表达CD25(IL-2受体的A链),具有分泌IL-10与PGE2的功能,是一类重要的免疫抑制细胞,广泛参与多种免疫调节机制。近年来较多研究表明,CD4+CD25+Treg在脓毒症复杂的免疫调节中发挥着对细胞免疫的抑制作用,可影响机体的天然免疫和获得性免疫。盛志勇等[7]认为,脓毒症患者机体的免疫反应倾向于Th2型,Th2型细胞因子生成增多而Th1型细胞因子产生减少,明显损害了机体的细胞免疫功能。Treg可以抑制CD4+/CD8+T淋巴细胞功能,介导Th1向Th2反应漂移,调节促炎、抗炎介质水平,下调树突状细胞表面共刺激分子的表达,影响免疫细胞如单核巨噬细胞、中性粒细胞的凋亡和增殖,特别是诱导T淋巴细胞的凋亡[8]。研究表明,Treg细胞水平与脓毒症的发病存在密切关系,脓毒症发病时Treg水平明显升高。在脓毒症患者中,CD4+CD25+Treg升高在死亡者中多见,提示CD4+CD25+Treg在某种程度上能够表现脓毒症患者病情的严重程度,能够为预测患者的预后提供依据[9]。Zhang等[10]从基因水平证实上述结论,其研究发现,脓毒症患者Treg细胞的特异性标志Foxp3 mRNA明显增多。Hein等[11]研究报道脓毒症患者Treg水平与ASPs Ⅱ及乳酸水平存在负相关。
本研究结果显示,CD4+CD25+Treg表达率:脓毒症休克组>严重脓毒症组>脓毒症组>对照组;脓毒症组CD3+、CD4+和CD4+/CD8+明显高于对照组,严重脓毒症组和脓毒症休克组CD3+、CD4+、CD4+/CD8+则显著下降。相关性分析表明:脓毒症患者CD4+CD25+Treg表达率与APACHEⅡ呈正相关,与乳酸水平呈正相关,与CD4+/CD8+呈负相关。T细胞亚群CD3+、CD4+、CD8+是机体的免疫功能状态的重要指标。Inoue等[12]研究发现,采用干预措施减少CD4+和CD8+的凋亡,能够改善脓毒症的生存率。这说明随病情加重,脓毒症患者Treg水平呈上升趋势,从而加剧免疫无反应状态。有关Treg诱导淋巴细胞凋亡的机制,可能有以下多种不同的途径:①IL-2是细胞增殖信号,在T淋巴细胞增殖过程中起着重要的激活作用。Treg细胞上的CD25能够与效应细胞竞争结合IL-2,使IL-2无法正常发挥增殖信号功能[13]。②Treg细胞能够诱导IL-10水平的升高,从而发挥免疫抑制效应。③Treg细胞能够激活FAS和FASL,通过Caspase级联反应,诱发T细胞彼此杀伤或直接凋亡。④Treg细胞经TCR介导的信号刺激活化后,能导致免疫亢进转向免疫抑制。随着脓毒症病情的加重,Treg数量增加,免疫抑制加剧,最终导致患者免疫麻痹,甚至死亡。已有研究表明,通过使用胸腺肽,诱导和促进T淋巴细胞的分泌与成熟,能够有效提高IL-2的活性及受体表达水平,从而对脓毒症的免疫抑制产生刺激作用,逆转其免疫抑制状态,尤其是对于轻中度的免疫抑制状态能够通过上述治疗取得良好效果,而重度免疫抑制者经过较长时间持续治疗也能够获益[14]。进一步证明免疫抑制的形成与改善是影响患者预后的重要因素。
综上所述,临床上对脓毒症患者检测Treg水平能够反映患者的细胞免疫状态,对患者的预后有一定预测作用。但由于目前相关的临床研究还较少,其确切的调控机制还有待进一步深入探讨。由于脓毒症患者的免疫失衡涉及各种细胞因子及炎症介质,而且与神经、内分泌因素的调节作用存在密切关系,因此,仅分析某几种细胞或细胞因子的相关性,不可能全面了解其根本的发病机制。随着对Treg细胞的免疫调节功能认识的日益深化,对脓毒症的临床干预的切入点将会越来越多,从而为防治脓毒症及其他感染性疾病提供可靠的新手段。
[参考文献]
[1] 姚咏明,祝筱梅.细胞调亡在脓毒症免疫紊乱中作用及其调控途径的思考[J].中华创伤杂志,2012,28(10): 867-870.
[2] 邵敏,刘宝,王锦权,等.脓毒症患者CD4+CD25+调节性T细胞检测的临床意义[J].湖南中医药大学学报,2011,31(4):8-10.
[3] 黄建宝,张新萍,罗海燕,等.IL-6、IL-10、TNF-α 在脓毒症患儿肝损害中的作用[J].临床儿科杂志,2012,30(1):15-17.
[4] 王鹿杰,薛庆亮,刘杜姣,等.脓毒症机体免疫变化及治疗的研究进展[J].临床肺科杂志,2013 ,18(2):325-327.
[5] Delano MJ,Thayer T,Gabrilovich S,et al. Sepsis induces early alterations in innate immunity that impact mortality to secondary infection [J]. J Immunol,2011,186(1):195-202.
[6] 秦庆华.调节性T细胞促效应T细胞凋亡在脓毒症免疫抑制中的作用及机制研究[D].广州:南方医科大学,2013.
[7] 盛志勇,姚咏明.加强对脓毒症免疫功能障碍及其监测的研究[J].解放军医学杂志,2011,36(1):8-10.
[8] 姚咏明.关注调节性T细胞在脓毒症中的免疫学意义[J].中华急诊医学杂志,2009,18(2):117-119.
[9] 张丽娜,吴铁军,刘志军.脓毒症患者血中CD4+CD25+调节性T细胞水平检测的临床意义[J].中国呼吸与危重监护杂志,2010,9(4):416-418.
[10] Zhang Y,Yao YM,Huang LF,et al. The potential effect and mechanism of high-mobility group box 1 protein on regulatory T cell-mediated immunosuppression [J]. J Interferon Cytokine Res,2011,31(2):249-257.
[11] Hein F,Massin F,Cravoisy-Popovic A,et al. The relationship between CD4+CD25+CD127- regulatory T cells and inflammatory response and outcome during shock states [J]. Crit Care,2010,14(1):132-142.
[12] Inoue S,Bo L,Bian J,et al. Dose-dependent effect of anti-CTLA-4 on survival in sepsis [J]. Shock,2011,36(1):38-44.
[13] Jiang LN,Yao YM,Sheng ZY. The role of regulatory T cells in the pathogenesis of sepsis and its clinical implication [J]. J Interferon Cytokine Res,2012,32(8):341-349.
[14] 周琴,郭光云.重度脓毒症患者的免疫增强治疗临床研究[J].中国医药导报,2011,8(31):54-59.
(收稿日期:2014-09-30 本文编辑:程 铭)

