阳离子表面活性剂的合成及其与DNA作用研究
黎 欢, 李 曦
(1. 武汉理工大学 材料科学与工程学院, 湖北 武汉 430070;2. 武汉理工大学 理学院化学系, 湖北 武汉 430070)
阳离子表面活性剂的合成及其与DNA作用研究
黎 欢1, 李 曦2
(1. 武汉理工大学 材料科学与工程学院, 湖北 武汉 430070;2. 武汉理工大学 理学院化学系, 湖北 武汉 430070)
合成了3种阳离子表面活性剂CTAB、16-3-16和16-3(OH)-16,并通过荧光光谱研究了它们与DNA在盐溶液中的相互作用。该实验包含合成操作、光谱分析等化学实验基本技能,涉及到有机化合物合成表征、荧光数据分析等化学理论知识,可作为化学专业的综合实验,有利于巩固学生的理论知识,培养学生对化学知识的综合应用。
综合性实验; 表面活性剂合成; DNA; 荧光光谱
Gemini表面活性剂由共价键形成的联接基团将2个双亲分子紧密连接而成,2个离子头基通过共价键的作用使得烷烃链间的相互作用更强,增强了疏水作用,同时联接基团也在很大程度上抵消了头基间的静电斥力,促进了在界面或分子聚集体中的紧密排列[1-3]。这种特殊的结构,使得Gemini表面活性剂较传统表面活性剂有很多优良的性质,如有很低的Krafft点,有很好的增溶、润湿、发泡作用,并且具有良好的皂化分散性质等[2,4]。而且,与传统表面活性剂相比,Gemini阳离子表面活性剂与DNA有更强的结合能力[5-7],它通过疏水作用和静电作用与DNA结合,改变DNA的构型,使DNA更容易穿越细胞膜、核膜等生物膜屏障,因此,Gemini阳离子表面活性剂有望成为一种很好的基因转染剂[8-10]。
荧光光谱分析法是一种常用又方便的研究表面活性剂与DNA相互作用的方法,但DNA自身荧光很弱,所以我们选取稳定性很好的溴化乙锭 (EB) 作为荧光探针,EB的特殊共轭平面结构能使其插入DNA双螺旋内从而使DNA/EB体系的荧光显著增强[11-12]。一些带正电的物质,如多肽、聚胺和表面活性剂等能与EB竞争性地结合DNA[7,13-14],导致荧光猝灭,从而可用于研究DNA与小分子之间的相互作用。采用荧光光谱分析法对比研究传统阳离子表面活性剂和Gemini阳离子表面活性剂与DNA在盐溶液中的相互作用,使学生既巩固了大学有机合成和表面化学的相关知识,又加强了学生的自主分析能力,是一个适于强化学生基本实验操作、培养学生思考分析能力的综合性实验。
1 仪器与试剂
仪器:Nexus傅里叶变换红外光谱仪(美国Thermo Nicolet公司);DDS-11A型电导率仪,DJS-10型铂黑电导电极(上海雷磁新泾仪器公司); RF-5301荧光分光光度计(日本岛津公司)。
试剂: N,N-二甲基十六烷基胺、1-溴代十六烷、1,3-二氯-2-丙醇、1,3-二溴丙烷,均为化学纯;小牛胸腺DNA(Sigma公司),33%三甲胺水溶液、10 mg/mL溴化乙锭溶液、正丙醇、乙醇、乙酸乙酯,甲醇、乙醚、丙酮,均为分析纯;实验用水均为双蒸水。
2 实验
2.1 表面活性剂的合成
3种表面活性剂的合成路线见图1,反应方程式右边对应产物的简称。
传统表面活性剂CTAB:1-溴代十六烷和三甲胺水溶液按1.2∶1.0的摩尔比在甲醇中回流2 h,保持约67 ℃,回流结束后旋转蒸发掉溶剂后得到白色或淡黄色黏稠胶状物质,用丙酮溶解并加入少量乙醚至微量晶体析出,冰水浴15 min后抽滤得DTAB粗晶体。用丙酮重结晶,真空干燥后得白色粉末。
亚甲基Gemini表面活性剂16-3-16:N,N-二甲基十六烷基胺和1,3-二溴丙烷按2.1∶1.0的摩尔比在正丙醇中回流反应48 h,然后旋转蒸发除去溶剂,在乙酸乙酯/乙醇混合溶剂中重结晶,真空干燥后得到白色粉末产物。
羟甲基Gemini表面活性剂16-3(OH)-16:N,N-二甲基十六烷基胺和1,3-二氯-2-丙醇按2.1∶1.0的摩尔比在正丙醇中回流反应6 h,旋转蒸发除去溶剂,在乙酸乙酯/乙醇混合溶剂中重结晶,真空干燥后得到白色粉末产物。
反应产物用傅里叶红外光谱仪进行表征,并用显微熔点仪测其熔点。
2.2 CMC的测定
25 ℃时,用电导率仪测不同浓度下各表面活性剂的电导率值,从电导率- 浓度cs的曲线上得到一个转折点,此处的浓度为临界胶束浓度(CMC)。
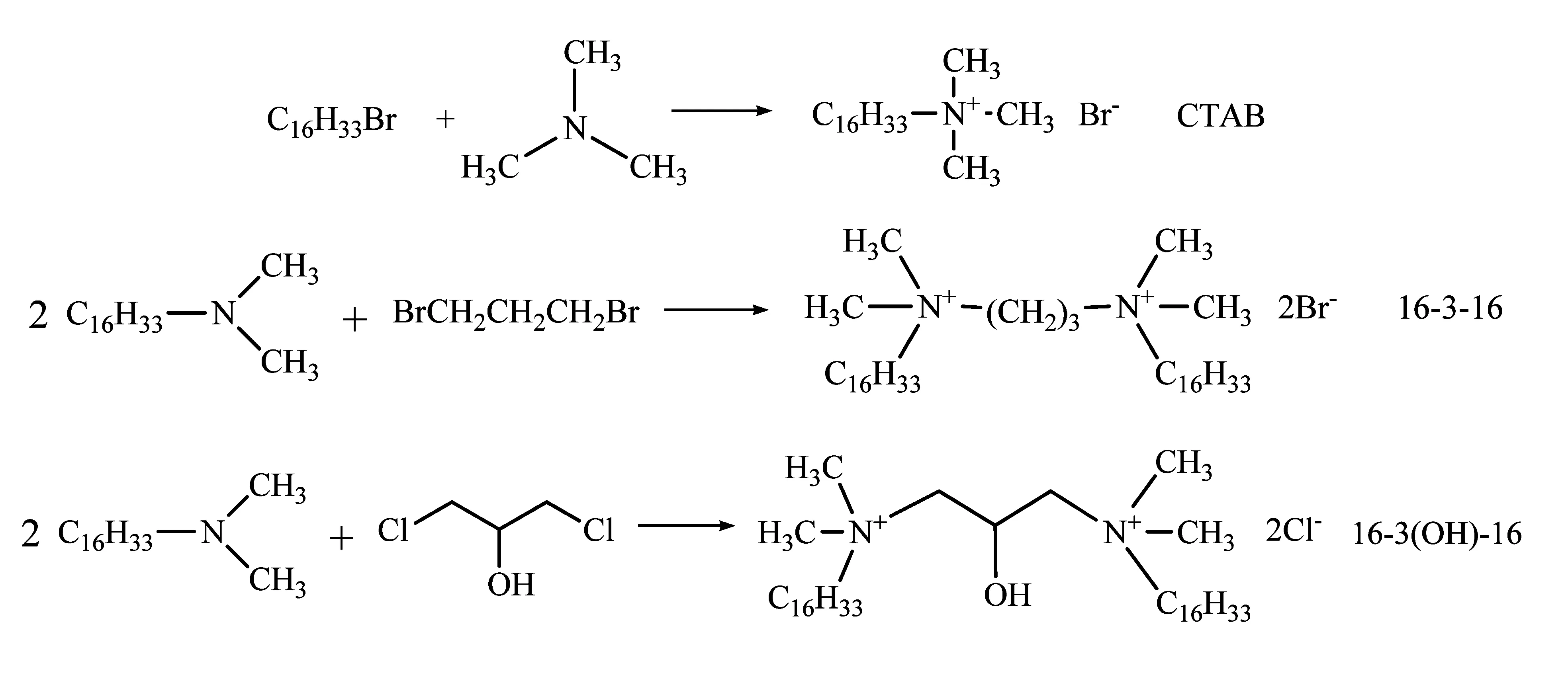
图1 表面活性剂的合成路线
2.3 荧光光谱
所有溶液以0.01 mol/L NaBr溶液为溶剂,以EB为荧光探针,并保证[EB]/[P]=0.5,[P]即为DNA磷酸基团的浓度(通过其紫外吸收光谱在260 nm的吸光度可计算出来,相应的摩尔吸光系数是6 600L/(mol·cm),各表面活性剂定量加入EB/DNA混合溶液中,且表面活性剂与DNA的摩尔浓度比X的范围在0~4。激发和发射波长分别是543 nm和601 nm。
3 结果与讨论
3.1 表面活性剂的表征
合成产品的红外表征结果如图2所示。
在图2(a)中,2 920 cm-1处和2 850 cm-1处分别对应亚甲基链上的碳-氢反对称伸缩振动和对称伸缩振动(vas(—CH2—)=2 920 cm-1,vs(—CH2—)=2 850 cm-1);1 485 cm-1处和1396 cm-1处分别对应甲基的碳-氢反对称弯曲振动和对称弯曲振动(δas(—CH3) =1485 cm-1,δs(—CH3) =1 396 cm-1);在964 cm-1、937 cm-1、910 cm-1处出现碳-氮的特征吸收峰;725 cm-1处对应亚甲基链上的碳-氢平面摇摆振动(δ(—CH2—)=725 cm-1)。在图2(b)和图2(c)中都能找出相应的峰,说明这些化合物中都含有—CH2—、—CH3、C—N等结构单元。另外在图2(b)中,3 413 cm-1处是—OH的特征吸收峰,表明产物中含有少量的水分,这是由于所合成的16-3-16有吸湿性,吸收了少量水分导致的。图2(c)对应16-3(OH)-16的红外光光谱,3 425 cm-1处和3 170 cm-1处对应羟基的氢-氧伸缩振动;1 143 cm-1处和1 115 cm-1处对应碳—氧伸缩振动。

图2 产品的红外光谱图
3.2 CMC值的测定
图3为表面活性剂的к-cs曲线。根据图3可知,25℃时CTAB、16-3-16和16-3(OH)-16的CMC分别是9.55×10-4mol/、1.501×10-5mol/L 和2.993×10-5mol/L。可以看出,Gemini表面活性剂具有较低的临界胶束浓度,CMC比传统表面活性剂低约2个数量级,但羟基的引入对Gemini表面活性剂的CMC影响不是很大。Gemini表面活性剂相比于传统表面活性剂,主要是连接基团将两个长烷烃链紧密连接,致使烃链间的相互作用增强,抑制了亲水头基之间由于静电斥力所引起的分离作用,使Gemini表面活性剂更易聚集形成胶团,从而大大提高了其表面活性。
图3 表面活性剂的к-cs曲线
3.3 荧光光谱
图4是16-3(OH)-16与DNA/EB体系混合的荧光光谱变化,随着16-3(OH)-16浓度的增加,带正电的表面活性剂与DNA磷酸基团静电结合,同时与相邻表面活性剂上烷烃链之间的疏水作用导致更多的16-3(OH)-16分子协同性结合到DNA上,大量EB被挤出DNA体系,从而发生荧光猝灭,即DNA/EB的荧光强度急剧减小。但随着16-3(OH)-16浓度的进一步增加,DNA/EB的荧光强度不再减小。CTAB、16-3-16与DNA/EB体系相互作用的荧光光谱变化趋势也大致相同。

图4 不同浓度16-3(OH)-16与DNA/EB混合的荧光光谱
图5是各表面活性剂与DNA/EB混合后相对荧光强度I/I0随摩尔浓度比X的变化曲线。这3种表面活性剂都有着相同的疏水尾链,但16-3-16和16-3(OH)-16疏水尾链由连接基团联接,在一定程度上抑制了亲水头基之间的静电斥力。相比于CTAB,它们与DNA的静电吸引作用强烈得多,所以只需很小的摩尔浓度比,Gemini/DNA体系就能达到平衡。另外,在水溶液中16-3(OH)-16分子的羟基能在彼此之间及水溶液之间形成羟基,使得16-3(OH)-16离子头基之间的距离比16-3-16 头基之间更短[15],所以16-3(OH)-16分子与DNA的相互作用更强烈。
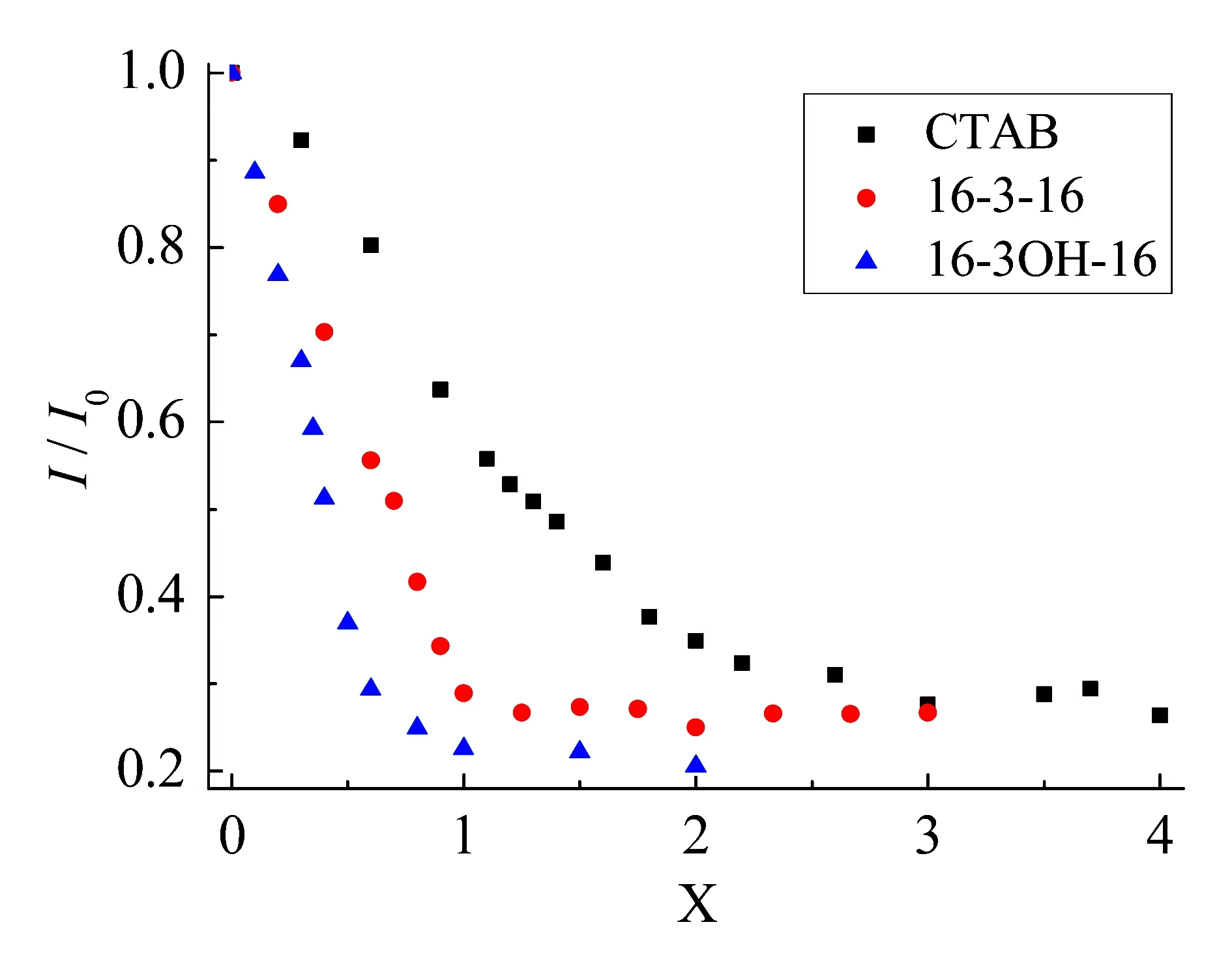
图5 不同表面活性剂与DNA/EB混合后I/I0随摩尔浓度比X的变化曲线
4 结论
本实验合成了传统表面活性剂CTAB和联结基团分别为亚甲基链、含羟基亚甲基链的季铵盐Gemini阳离子表面活性剂,即16-3-16和16-3(OH)-16,并用红外光谱对它们的结构进行了鉴定。分析表明,Gemini阳离子表面活性剂的CMC比传统表面活性剂低约2个数量级。另外,随着表面活性剂浓度的增加,带正电的表面活性剂与DNA磷酸基团静电结合,同时与相邻表面活性剂上烷烃链之间的疏水作用导致更多的表面活性剂协同性结合到DNA上。而且,疏水尾链相同时,Gemini阳离子表面活性剂与DNA的相互作用明显比CTAB要强烈得多,而连接基团上的羟基又会促进表面活性剂与DNA之间的作用。
本实验要求学生通过有机合成制备配合物并进行表征,电导法求出CMC,以及使用荧光法进行表面活性剂与DNA作用的研究,涉及到有机化学、分析化学、物理化学等基础化学的相关知识和基本操作。通过整个实验的完成,综合锻炼了学生各个方面的实验技能,初步掌握科学研究的基本路线和方法,培养学生自主学习能力和创新能力。而且,该实验取材于近几年发表的文献,涉及到目前的研究热点,有利于激发学生的学习热情和开拓学生的研究视野。
References)
[1] Li D S,Milton J R.Surface properties,micellization and premicellar
aggregation of Gemini surfactants with rigid and flexible spacers[J].Langmuir,1996,12(5):1149-1153.
[2] Raoul Zana.Dimeric (Gemini) surfactants:Effect of the spacer group on the association behavior in aqueous solution[J].Journal of Colloid and Interface Science,2002,248(2):203-220.
[3] 赵剑曦.低聚表面活性剂-两亲分子表面活性剂的突破[J].日用化学工业,2004,4(2):21-23.
[4] Raoul Zana.Dimeric and oligomeric surfactants,behavior at interfaces and in aqueous solution:a review[J].Advances in Colloid and Interface Science,2002,97(1/2/3):205-253.
[5] Chen X D,Wang J B,Luo Y H,et al.Gemini surfactant/DNA complex monolayers at the air-water Interface:effect of surfactant structure on the assembly,stability and topography of monolayers[J].Langmuir,2002,18(16):6222-6228.
[6] Bombelli C,Borocci S,Dinciaiuti M,et al.Role of the spacer of cationic amphiphiles in the condensation of DNA[J].Langmuir,2005,21(23):10271-10274.
[7] Zhao Xiaofang,Shang Yazhuo,Liu Honglai,et al.Complexation of DNA with cationic gemini surfactant in aqueous solution[J].Journal of Colloid and Interface Science,2007,314(2):478-483.
[8] Nicolazzi C,Garinot M,Mignet N,et al. Cationic lipids for transfection[J].Curr Med Chem,2003,10(14):1263-1277.
[9] Pan B,Cui D,Ozkan C,et al.DNA-templated ordered array of gold nanorods in one and two dimensions[J].J Phys Chem C,2007,111(34):12572-12576.
[10] Chen Qibin,Kang Xueli,Li Rong,et al. Structure of the complex monolayer of Gemini surfactant and DNA at the air/water interface[J].Langmuir,2012,28(7):3429- 3438.
[11] Izumrudov V A,Zhiryakova M V,Goulko A A. Ethidium Bromide as a promising probe for studying DNA interaction with cationic amphiphiles and stability of the resulting complexes[J].Langmuir,2002,18(26):10348-10356.
[12] Zhou Y, Li Y. Studies of interaction between poly(allylamine hydrochloride) and double helix DNA by spectral methods[J].Biophys. Chem,2004,107(3):273-281.
[13] Grueso E,Cerrillos C,Hidalgo C,et al.Compaction and decompaction of DNA induced by the cationic surfactant CTAB[J].Langmuir,2012,28(30):10968-10979.
[14] Jonas C,Dan L,Rita S,et al.Condensation and decondensation of DNA by cationic surfactant,spermine or cationic surfactant-cyclodextrin mixtures:macroscopic phase behavior,aggregate properties and dissolution mechanisms[J].Langmuir,2012,28(21):7976- 7989.
[15] 叶志文.Gemini表面活性剂12-3-12·2Br和12-3(OH)-12·2Cl的合成及表面活性[J].化学试剂,2007,29(9):513-516.
Study on synthesis of cationic surfactants and their interaction with DNA
Li Huan1, Li Xi2
(1. School of Materials Science and Engineering, Wuhan University of Technology, Wuhan 430070, China; 2. Department of Chemistry, School of Science, Wuhan University of Technology, Wuhan 430070, China)
Three cationic surfactants (CTAB, 16-3-16 and 16-3(OH)-16 ) were synthesized and their interactions with DNA were investigated by fluorescence spectrum. This comprehensive experiment not only contains many basic chemical experiment skills such as synthesis operation and spectrum analysis, but also involves chemical theoretical knowledge including organic synthesis, characterization and fluorescent data analysis. It can be classified as a comprehensive experiment for students majoring in chemistry, which can help students to strengthen theoretical knowledge and cultivate comprehensive experimental abilities.
comprehensive experiments;synthesis of surfactants;DNA;fluorescence spectrum
2014- 06- 05
国家自然科学基金项目(51273155);湖北省高等学校省级教学研究项目(2010082);武汉理工大学本科教学实验室实验项目开发基金
黎欢(1991—),女,湖北咸宁,硕士研究生,主要从事表面活性剂与DNA相互作用的研究
E-mail:huan_li@whut.edu.cn
李曦(1968—),女,湖北阳新,博士,教授,主要从事物理化学科研与教学.
E-mail:chemlixi@whut.edu.cn
O6-3
A
1002-4956(2015)2- 0069- 04

