林窗对马尾松人工林蛋白酶和羟胺还原酶的影响1)
李建平 高顺 张健 宋小艳 欧江 张明锦
(四川农业大学,成都,611130)
林窗对马尾松人工林蛋白酶和羟胺还原酶的影响1)
李建平 高顺 张健 宋小艳 欧江 张明锦
(四川农业大学,成都,611130)
人工砍伐四川高县39年生马尾松人工林形成7种不同大小林窗(100~1 600 m2),并栽植红椿幼苗1 a后参照土壤酶测定方法对林窗中央、林缘、林下蛋白酶和羟胺还原酶活性进行了测定。不同采样位置蛋白酶活性由大到小顺序为林缘、林下、林窗中央,羟胺还原酶活性由大到小顺序为林窗中央、林缘、林下,但均差异不显著(P>0.05);林窗中央蛋白酶活性最大体现在1 225 m2林窗,羟胺还原酶活性最大体现在625 m2林窗,两种酶活性随林窗面积增加变化规律不明显,且不同大小林窗间酶活性差异也不显著(P>0.05);2012年4月—2013年1月,林下蛋白酶活性呈现“W”型变异规律,羟胺还原酶活性呈现“√”变异规律,林窗形成显著改变了酶活性季节动态。林窗式间伐并栽植红椿幼苗改造模式对不同位置蛋白酶、羟胺还原酶活性影响不显著,但是可以明显改变这两种酶活性季节动态。
马尾松人工林;林窗;土壤蛋白酶;羟胺还原酶;季节动态
We analyzed the effect of forest gap ofPinusmassonianaplantations on soil protease and hydroxylamine xidoreductase (HyR) activity providing reference for confirming best gap size and improving the effectiveness of soil nitrogen cycling. We fell seven different size gaps (G1:100 m2, G2:225 m2, G3:400 m2, G4:625 m2, G5:900 m2, G6:1 225 m2and G7:1 600 m2) and tested soil protease and HyR in gap center and gap edge according method for measuring soil enzymes one year after plantingToonaciliataseedlings. Protease activity was GE>US>GC, while HyR activity was GC>GE>US, but not significantly different (P>0.05). The largest GC protease activity reflected in 1 225 m2gaps, largest HyR activity reflected in 625 m2gaps, variations of two enzymes with the forest area increased were not obvious, and the differences between different gaps were not significant (P>0.05). The US protease activity varied as “W” while HyR varied as “√” from April to January, and the formation of gaps changed the variations. The transformation model planningToonaciliataseedlings in manual gaps had no significant effect on soil protease and HyR activity, but it significantly changed the seasonal dynamic of these two enzymes activity obviously.
氮素是植物有机合成最重要的营养元素之一,是植物生长发育过程中必不可少的生命元素,也是调节陆地生态系统生产量、结构和功能的关键元素,能够限制群落初级和次级生产力,在全球碳氮循环中至关重要[1]。森林土壤中有效氮来源于土壤有机碎屑在微生物作用下的分解,主要以铵态氮和硝态氮形式存在,是植物从土壤中可直接吸收利用的主要氮形态[2]。氮素转换过程包括氨化作用、硝化作用、反硝化作用、有机氮化合物的合成以及固氮作用等,其中矿化、硝化和反硝化作用是其核心过程,决定着整个生态系统氮循环的速度和与外界的交换通量[3]。
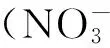
马尾松(Pinusmassoniana)是我国松属树种中分布最广的乡土工业用材树种,广泛分布于全国17个省(市、区),它具有适生能力强、速生、丰产、用途广泛等优点,是南方最主要用材树种之一[9]。但是,由于马尾松纯林生态系统组成树种单一、层次结构简单、林分密度和郁闭度过大等导致养分循环较差,容易导致土壤肥力下降,林分生长衰退,生境恶化,病虫害频繁[10]。大多成为典型的低效林,亟需对其进行改造以实现生态功能得到恢复。人工林窗可以通过人为砍伐林分中的老龄树木改变森林生态系统的光照辐射条件和气流条件,进而影响土壤理化性质、微生物活性、酶活性等,最终将会影响森林生态系统的氮素循环。因此,本文以人工砍伐林窗后种植红椿幼苗的方式对四川高县39年生马尾松人工林进行改造,测定分析了土壤蛋白酶、羟胺还原酶的活性及季节动态,旨在探讨以上两种酶对林窗改造初期的响应,从而为选择林窗干扰方式提高土壤氮素的有效性来实现马尾松低效林改造效果的优化提供理论依据和技术参考。
1 研究区概况
试验地设置于四川省宜宾市高县来复镇林区(毛巅坳工区经营小班)(104°33′37″~104°34′22″E,28°35′45″~28°36′19″N)。该区域处金沙江、岷江交汇段,属于中亚热带湿润季风气候,雨量充沛,雨热同季。年均气温18.1 ℃,7月份均温27.3 ℃,绝对最高温40.3 ℃,1月份均温7.9 ℃,绝对最低温-3.7 ℃,无霜期360 d。年均降水量1 021.8 mm,相对湿度81%,全年日照时间1 148 h;雨季出现在5—10月份;坡向主要为东北、东方向。林分土壤为黄色砂岩发育而成的山地黄壤,土壤发育完善,层次过渡明显,土壤厚度40~80 cm,腐殖质层厚度小于5 cm。
试验对象为39年生马尾松人工林,郁闭度约0.7,行间距2.5 m×2.5 m,林下植被盖度40%~80%,主要有青冈(Cycloblanopsisglauca)、香樟(Cinnamomumcamphora)、尖叶榕(Ficushenryi)、紫花冬青(IIexsp)、盐肤木(Ruhuschinensis)、悬钩子(RubusL.)、映山红(Rhododendronsimsii)、铁仔(Myrsineafricana)、白茅草(Pennisetumqianningense)、狗尾草(Setarriaviridis)、铁芒萁(Dicranopterislinearis)、凤尾蕨(Pteriscretica)、莎草(Cyperusmicroiria)、扁竹根(Irisconfuse)等。
2 材料与方法
林窗设置为人工砍伐,于2011年10月,在立地条件基本一致的研究区人工砍伐形成7种大小不等的林窗斑块,面积分别为10 m×10 m(G1)、15 m×15 m(G2)、20 m×20 m(G3)、25 m×25 m(G4)、30 m×30 m(G5)、35 m×35 m(G6)和40 m×40 m(G7),形状为正方形。林窗间距离大于10 m,窗内砍伐的树枝、树干等残体移出并清除林下灌草层,但未进行掘根处理。2012年2—3月,各林窗斑块栽植1年生红椿实生苗,造林株行距为2.5 m×2.5 m,合理管理。2012年4月中旬,对各斑块红椿幼苗生长状况进行调查,在不同大小林窗内选取存活率高、长势良好的斑块各3个,共21个,补植红椿幼苗。
在各林窗斑块中央(GC)、扩展林窗(GE),林下(US)分别选取3个样点采集表层(0~20 cm)土样,并且自2012年4月底起,分2012年8月、2012年11月、2013年1月季节性动态采样。于各林窗中央和林下土壤5 cm深处埋设DS1921G纽扣温度记录器(Maxim,USA),每2 h自动记录温度变化。将取得的土样分别充分混匀并将土壤中混合的较大的树根、石子剔除。混匀后的土壤用四分法分成2份,一份自然风干,另一份土壤鲜样2 mm过筛装袋,4 ℃保存。蛋白酶活性测定方法为比色法,活性以每24 h后1 g土壤中甘氨酸含量来表示。羟胺还原酶活性测定参照史云峰[11]等测定方法进行。土壤含水量采用铝合烘干法测定(105 ℃,24 h)。
3 结果与分析
3.1 马尾松人工林窗土壤温度、含水量动态
各林窗土壤日均温变化趋势一致(图1),8月最高,12月最低。从月均温变化来看,土壤月均温总体上随林窗增大呈现先增大后减小的变化。
由表1可见,林窗中央土壤含水量林下到G7总体上呈先“W”型的变化趋势。从季节上看,林下、G1~G3、G5土壤含水量10月份最高,1月份最低,但G4、G6、G7林窗中央10月份土壤含水量较8月份略低。林窗边缘土壤含水量呈波动状态,G5土壤含水量最高。季节上,G1~G3、G5、G7土壤含水量表现为8月份最高,而林下、G4、G6表现为10月份最高。
3.2 采样位置对蛋白酶、羟胺还原酶的影响
林下(US)、林窗中央(GC)、林缘(GE)土壤蛋白酶活性分别为(4.315±0.485)、(4.122±0.254)、(4.381±0.273)μg·g-1,由大到小顺序为林缘、林下、林窗中央;土壤羟胺还原酶活性分别为(1.519±0.247)、(1.753±0.429)、(1.567±0.191)mg·g-1·h-1,与蛋白酶由大到小大小顺序表现为林窗中央、林缘、林下。但是,经单因素方差分析显示,两种酶活性在不同位置差异均未达到显著水平(见表2)。表明,人工砍伐马尾松形成林窗并栽植红椿幼苗改造方式可以小幅度提高羟胺还原酶的活性,但对蛋白酶而言这种小幅度提高仅仅表现在林缘位置。
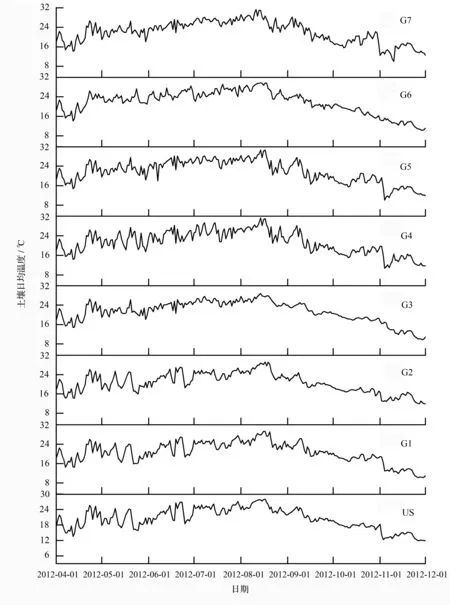
图1 2012年4—12月马尾松人工林林窗土壤5 cm深度日平均温度动态

表1 不同位置土壤含水量季节动态变化
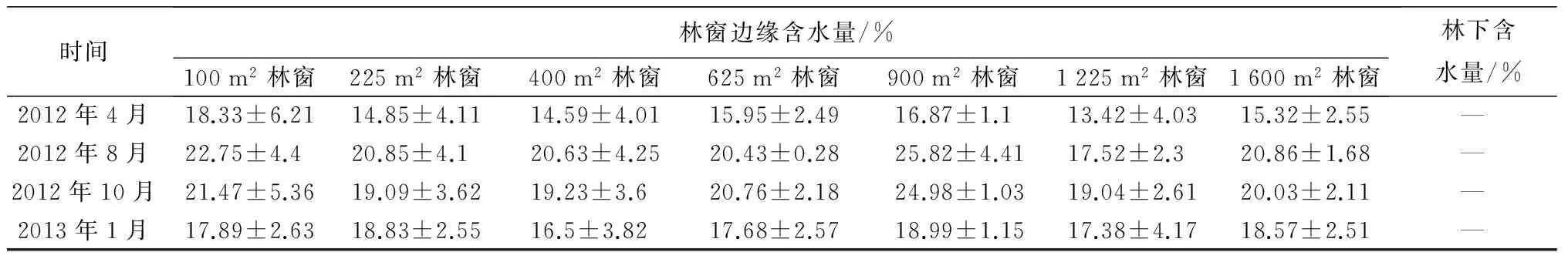
时间林窗边缘含水量/%100m2林窗225m2林窗400m2林窗625m2林窗900m2林窗1225m2林窗1600m2林窗林下含水量/%2012年4月18.33±6.2114.85±4.1114.59±4.0115.95±2.4916.87±1.113.42±4.0315.32±2.55—2012年8月22.75±4.420.85±4.120.63±4.2520.43±0.2825.82±4.4117.52±2.320.86±1.68—2012年10月21.47±5.3619.09±3.6219.23±3.620.76±2.1824.98±1.0319.04±2.6120.03±2.11—2013年1月17.89±2.6318.83±2.5516.5±3.8217.68±2.5718.99±1.1517.38±4.1718.57±2.51—
注:表中数据为平均值±标准差。
表2 采样时间、位置及林窗大小对土壤蛋白酶和羟胺还原酶活性影响的方差分析
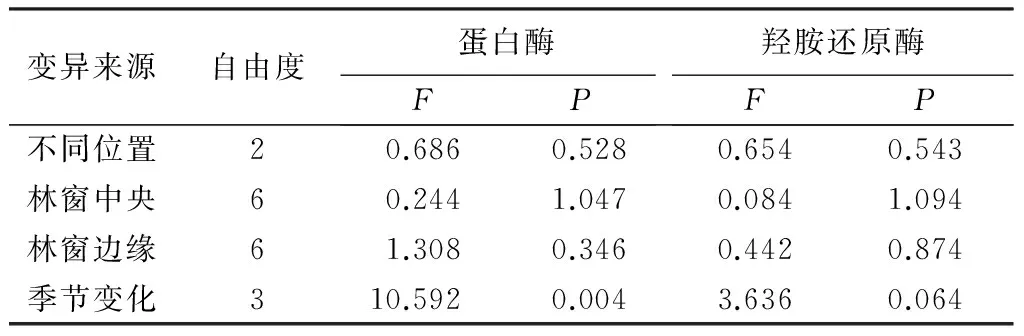
变异来源自由度蛋白酶FP羟胺还原酶FP不同位置20.6860.5280.6540.543林窗中央60.2441.0470.0841.094林窗边缘61.3080.3460.4420.874季节变化310.5920.0043.6360.064
3.3 林窗大小对蛋白酶、羟胺还原酶的影响
林窗大小对土壤蛋白酶、羟胺还原酶活性的影响见表3。从表3可以看出不同林窗大小土壤蛋白酶活性由大到小顺序为1 225 m2林窗((4.304±0.605)μg·g-1)、100 m2林窗((4.285±0.600)μg·g-1)、900 m2林窗((4.227±0.513)μg·g-1)、225 m2林窗((4.167±0.528)μg·g-1)、625 m2林窗((3.988±0.522)μg·g-1)、400 m2林窗((3.964±0.356)μg·g-1)、1 600 m2林窗((3.918±0.611)μg·g-1)。相应的林缘蛋白酶活性由大到小顺序为1 600 m2林窗((4.878±0.507)μg·g-1)、400 m2林窗((4.562±0.546)μg·g-1)、1 225 m2林窗((4.483±0.470)μg·g-1)、100 m2林窗((4.438±0.450)μg·g-1)、900 m2林窗((4.313±0.621)μg·g-1)、625 m2林窗((4.119±0.731)μg·g-1)、225 m2林窗((3.876±0.217)μg·g-1)。而方差分析表明,不同林窗大小土壤蛋白酶活性在林窗中央、林窗边缘均差异不显著(表2)。还可以看出,人工林窗改造马尾松人工林土壤羟胺还原酶活性在林窗中央由大到小顺序表现为625 m2林窗((1.872±0.309)mg·g-1)、1 225 m2林窗((1.856±0.224)mg·g-1)、100 m2林窗((1.737±0.260)mg·g-1)、225 m2林窗((1.726±0.357)mg·g-1)、900 m2林窗((1.720±0.258)mg·g-1)、400 m2林窗((1.712±0.282)mg·g-1)、1 600 m2林窗((1.651±0.321)mg·g-1)。而林窗边缘羟胺还原酶活性在225 m2林窗表现最强,在400 m2林窗表现最弱,各林窗间的酶活性差异也并未达到显著水平。还可以知道只有林窗下土壤羟胺还原酶活性随着林窗面积增大大致呈现出先增大后减小的规律,而林窗中央和林窗边缘蛋白酶活性、林缘羟胺还原酶活性随着林窗大小的变异规律均不明显。
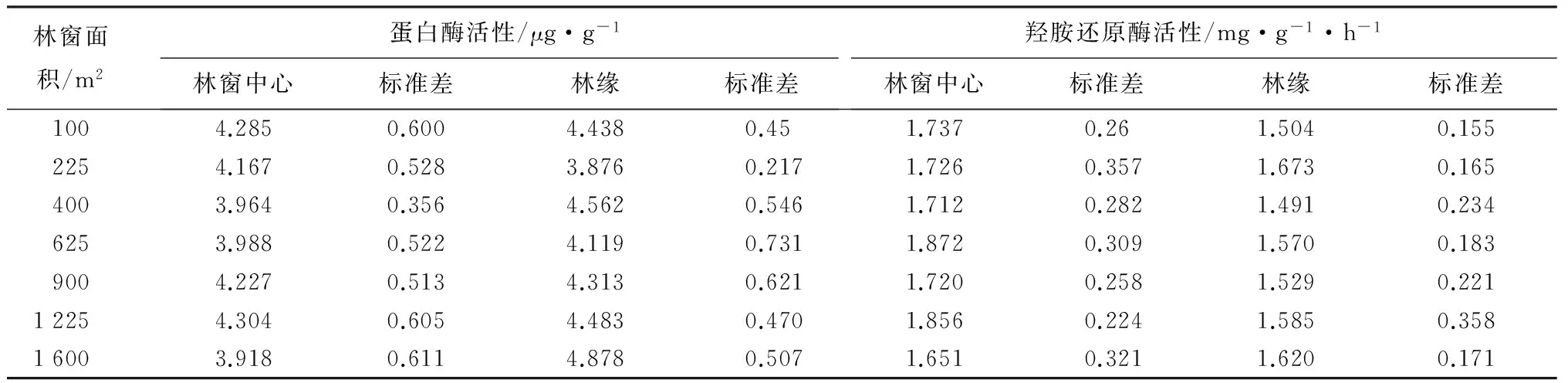
表3 马尾松人工林不同大小林窗中央、边缘蛋白酶和羟胺还原酶活性
3.4 蛋白酶、羟胺还原酶活性季节动态
马尾松人工林林下土壤蛋白酶和羟胺还原酶活性季节性动态变化规律明显,蛋白酶呈“W”型规律变化,羟胺还原酶呈“√”型规律变化(见表4)。即蛋白酶活性由大到小顺序为2012年10月、2012年4月、2013年1月、2012年8月,1 a之内高峰期发生在春秋两季,而低谷期发生于夏冬两季;羟胺还原酶活性由大到小顺序为2013年1月、2012年4月、2012年8月、2012年10月,高峰期发生在冬季,而低谷期发生在秋季。
表4 马尾松人工林林下土壤蛋白酶、羟胺还原酶活性季节动态变化
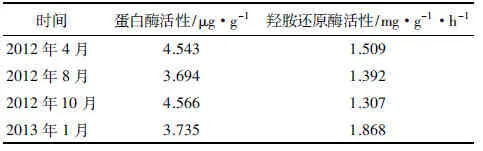
时间蛋白酶活性/μg·g-1羟胺还原酶活性/mg·g-1·h-12012年4月4.5431.5092012年8月3.6941.3922012年10月4.5661.3072013年1月3.7351.868
马尾松人工林土壤蛋白酶和羟胺还原酶活性季节动态随着林窗形成并红椿幼苗栽植1 a后发生显著的改变(表5、6)。GC土壤蛋白酶活性呈现“M”型季节变化,从2012年4月—2013年1月表现出增加—减小—增加规律,高峰期发生在夏季,虽然不同大小林窗动态变化幅度略有差异,但是季节动态变化规律基本一致(表5)。
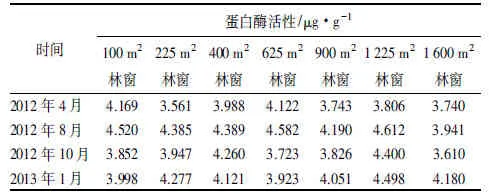
表5 马尾松人工林林窗中央土壤蛋白酶季节动态
林窗的形成对于土壤羟胺还原酶的季节动态变化影响显著,相比林下的“√”型变化规律,林窗内季节动态变化从2012年4月—2013年1月呈现降低—小幅增加—小幅增加规律,活性高峰期从林下的1月转移到了4月。从数值范围来看,林窗的形成致使1月土壤羟胺还原酶活性明显降低(降幅为20%左右),而使得4月、8月、10月活性值明显增大,在这3个月份中增大幅度最大的是4月(达到60%左右),这就使得其高峰期转移到了4月,而低谷期则变成了1月。图2中还可以看出,虽然不同大小林窗变化幅度略有差异,如225、400 m2林窗与其他大小林窗,但是其总体季节动态变化是一致的(表6)。
3.5 土壤蛋白酶和羟胺还原酶与含水量、铵态氮和硝态氮关系
相关分析结果显示(图2),蛋白酶活性与土壤铵态氮极显著正相关(R=0.366,P=0),但是土壤铵态氮对羟胺还原酶无显著影响。蛋白酶、羟胺还原酶活性均与土壤含水量、土壤硝态氮相关性不显著。
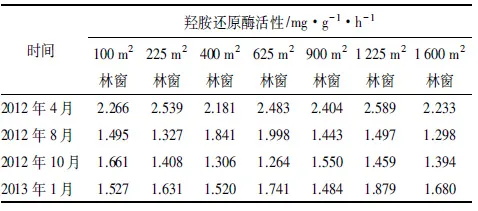
表6 马尾松人工林林窗中央土壤羟胺还原酶季节动态

图2 土壤蛋白酶和羟胺还原酶活性与土壤含水量、铵态氮及硝态氮相关性
4 结论与讨论
通常林窗越大,其地表环境变化越剧烈,各要素在林窗内部的空间异质性越强是本文探讨林窗大小对于两种酶活性影响的重要依据。不同大小的林窗可以形成不同的物种丰富度,而植物多样性可通过植物根系分泌物、根系脱落物、植物残体和凋落物的种类、数量、质量和凋落时间等与土壤动物和微生物的营养源有关的因素影响到土壤生物多样性[19]、土壤物理结构[20]、化学组成[21]和生物活性[22]。本研究中,林窗边缘蛋白酶活性处于较高水平的是1 225、100 m2林窗,林缘蛋白酶活性处于较高水平的是1 600、400 m2林窗;林窗中央羟胺还原酶活性处于较高水平的是625、1 225 m2林窗,林窗边缘羟胺还原酶活性处于较高水平的是225、1 600 m2林窗。两种酶活性在林窗中央和林窗边缘都没有随着林窗面积的增大表现出较为明显的规律性,其中的原因还有待进一步的研究。
本研究还发现,砍伐林窗后栽植红椿幼苗显著改变了马尾松人工林土壤蛋白酶、羟胺还原酶活性季节动态。100~1 600 m2林窗土壤蛋白酶活性动态(2012年4月—2013年1月)变化规律相似,呈现出增加—降低—增加趋势,这与郝俊鹏[15]研究得到的规律基本一致。羟胺还原酶则呈现降低—增加—增加规律,与蛋白酶活性动态差异明显,可能是由两种酶本身的性质差异决定的。
[1] 邢肖毅,黄懿梅,黄海波,等.黄土丘陵区子午岭不同植物群落下土壤氮素及相关酶活性的特征[J].生态学报,2012,32(5):1403-1411.
[2] Landesman W J, Dighton J. Response of soil microbial communities and the production of plant-available nitrogen to a two-year rainfall manipulation in the New Jersey Pinelands[J]. Soil Biology and Biochemistry,2010,42(10):1751-1758.
[3] 方运霆,莫江明,Gundersen P,等.森林土壤氮素转换及其对氮沉降的响应[J].生态学报,2004,24(7):1523-1531.
[4] 杨万勤,王开运.森林土壤酶的研究进展[J].林业科学,2004,40(2):152-159.
[5] Acost M V, Cruz L, Sotomayor R D, et al. Enzyme activities as affected by soil properties and land use in a tropical watershed[J]. Applied Soil Ecology,2007,35(1):35-45.
[6] Zaman M, Di H J, Cameron K C, et al. Gross nitrogen mineralization and nitrification rates and their relationships to enzyme activities and the soil microbial biomass in soils treated with dairy shed effluent and ammonium fertilizer at different water potentials[J]. Biology and Fertility of Soils,1999,29(2):178-186.
[7] Watanabe K, Hayano K. Seasonal variation of soil protease activities and their relation to proteolytic bacteria and bacillus spp in paddy field soil[J]. Soil Biology and Biochemistry,1995,27(2):197-203.
[8] 陈志刚,陈蕾,陈瀚翔,等.水稻根际土壤反硝化酶活性对水分调控的响应[J].环境科学与技术,2014,37(5):21-25.
[9] 何佩云,丁贵杰,谌红辉.1、2 代不同林龄马尾松人工林土壤微量元素及酶活性[J].东北林业大学学报,2013,41(1):32-36.
[10] 朱小龙,张丽楠,耿养会,等.三峡库区汝溪河流域马尾松林地土壤氮素特性研究[J].西南大学学报:自然科学版,2012,34(11):88-94.
[11] 史云峰,武志杰,史奕,等.土壤羟胺还原酶活性测定方法的改进[J].生态学杂志,2007,26(7):1133-1137.
[12] 熊浩仲,王开运,杨万勤.川西亚高山冷杉林和白桦林土壤酶活性季节动态[J].应用与环境生物学报,2004,10(4):416-420.
[13] 王成,庞学勇,包维楷.低强度林窗式疏伐对云杉人工纯林地表微气候和土壤养分的短期影响[J].应用生态学报,2010,21(3):541-548.
[14] 万忠梅,吴景贵.土壤酶活性影响因子研究进展[J].西北农林科技大学学报:自然科学版,2005,33(6):87-90.
[15] 郝俊鹏.间伐对马尾松人工林土壤酶活性的影响[D].南京:南京林业大学,2012.
[16] Simova-Stoilova L, Vaseva I, Grigorova B, et al. Proteolytic activity and cysteine protease expression in wheat leaves under severe soil drought and recovery[J]. Plant Physiology and Biochemistry,2010,48(2):200-206.
[17] Weng B, Xie X, Yang J, et al. Research on the nitrogen cycle in rhizosphere of Kandelia obovata under ammonium and nitrate addition[J]. Marine Pollution Bulletin,2013,76(1):227-240.
[18] Liu S, Vereecken H, Brüggemann N. A highly sensitive method for the determination of hydroxylamine in soils[J]. Geoderma,2014,232:117-122.
[19] Hooper D U, Bignell D E, Brown V K, et al. Interactions between above and belowground biodiversity in terrestrial ecosystems: patterns, mechanisms, and feed-backs[J]. Bioscience,2000,50(12):1049-1061.
[20] Lucas Y, Luizao F J, Chauvel A, et al. The relation between biological activity of the rain forest and mineral composition of soils[J]. Science,1993,260:521-523.
[21] Brussaard L, Behan-Pelletier V M, Bignell D, et al. Biodiversity and ecosystem functioning in soil[J]. Ambio,1997,26(8):563-570.
[22] Freckman D W, Blackburn T H, Brussaard L, et al. Linking biodiversity and ecosystem functioning of soils and sediments[J]. Ambio,1997,26(8):555-562.
[23] 万忠梅,宋长春.三江平原小叶章湿地土壤酶活性的季节动态[J].生态环境学报,2010,19(5):1215-1220.
[24] 郭恢财,廖鹏飞,陈伏生.脐橙果园土壤养分动态与酶活性的季节变化[J].生态学杂志,2010,29(4):754-759.
[25] 曹成有,陈家模,邵建飞,等.科尔沁沙地四种固沙植物群落土壤微生物生物量及酶活性的季节动态[J].生态学杂志,2011,30(2):227-233.
[26] 于方明,刘华,刘可慧,等.川西亚高山暗针叶林恢复初期土壤酶活性研究[J].生态环境学报,2012,21(1):64-68.
[27] Burke D J, Weintraub M N, Hewins C R, et al. Relationship between soil enzyme activities, nutrient cycling and soil fungal communities in a northern hardwood forest[J]. Soil Biology and Biochemistry,2011,43(4):795-803.
[28] 孔爱辉,耿玉清,余新晓.北京低山区栓皮栎林和油松林土壤酶活性研究[J].土壤,2013,45(2):264-270.
[29] 韩建刚,曹雪.典型滨海湿地干湿交替过程氮素动态的模拟研究[J].环境科学,2013,34(6):2383-2389.
Effects of Forest Gap ofPinusmassonianaPlantations on Soil Protease and Hydroxylamine Xidoreductase Activity
Li Jianping, Gao Shun, Zhang Jian, Song Xiaoyan, Ou Jiang, Zhang Mingjin(Sichuan Agricultural University, Chengdu 611130, P. R. China)/Journal of Northeast Forestry University,2015,43(4):62-68.
Pinusmassonianaplantation; Gap size; Soil protease; Soil HyR; Seasonal dynamics
1)国家科技支撑计划项目(2011BAC09B05);国家自然科学基金项目(31370628);四川省科技支撑计划项目(12ZC0017);四川省科技应用基础项目(2012JY0047);四川省教育厅科技创新团队计划项目(11TD006)。
李建平,男,1989年10月生,四川农业大学林学院,硕士研究生。E-mail:513010375@qq.com。
张健,四川农业大学林学院,教授。E-mail:sicauzhangjian@163.com。
2014年10月27日。
S714.3; S756.5
责任编辑:潘 华。

