碘[131I]爱克妥昔单抗注射液细菌内毒素检查方法建立
孙祥敏,张 云,张 先,杨薇薇,蔡海燕
(1.原子高科股份有限公司,北京 102413;2.上海海抗中医药科技发展有限公司,上海 201318)
碘[131I]爱克妥昔单抗注射液细菌内毒素检查方法建立
孙祥敏1,张 云1,张 先1,杨薇薇2,蔡海燕2
(1.原子高科股份有限公司,北京 102413;2.上海海抗中医药科技发展有限公司,上海 201318)
为建立碘[131I]爱克妥昔单抗注射液的细菌内毒素检查方法,采用《中国药典》二部细菌内毒素检查法进行实验。结果表明,将供试品稀释10倍、20倍、40倍进行细菌内毒素检查均存在干扰;对供试品稀释80倍进行检查或采用抗增液复溶鲎试剂,再将供试品稀释20倍进行检查,均无干扰。供试品的细菌内毒素检查可采用将供试品至少稀释80倍进行检验的方法;也可采用抗增液复溶鲎试剂,将供试品稀释至少20倍进行检查。结果表明,直接稀释法为产品检验的首选方法。
碘[131I]爱克妥昔单抗注射液;细菌内毒素检查;干扰实验
碘[131I]爱克妥昔单抗注射液,为放射性核素碘[131I]标记的爱克妥昔单抗,是碘[131I]与爱克妥昔单抗共价偶联的衍生物。该药物约含1 g/L的爱克妥昔单抗、0.01 mol/L的磷酸盐缓冲溶液和20 g/L的人血白蛋白,放射性活度约为3.33 GBq,主要用于治疗癌胚抗原表达阳性的大肠癌,是研究开发的新药品种。该药是注射剂,根据药典规定[1]应该对其进行注射剂项下的细菌内毒素检查。该药的细菌内毒素检查采用凝胶法,在进行新药的内毒素检查实验前,需进行干扰实验,确定适宜的检验方法,以保证检验结果的准确可靠。拟对该产品的细菌内毒素检查方法进行研究,建立无干扰的、适宜于该产品的细菌内毒素检查方法。
1 仪器与材料
1.1 主要仪器
TAL-40D型试管恒温仪:湛江安度斯生物有限公司;XW-80A型旋涡混合器:海门市其林贝尔仪器制造有限公司;DHG-9145A型电热恒温鼓风干燥箱:上海一恒科学仪器有限公司。
1.2 主要材料
碘[131I]爱克妥昔单抗注射液:上海海抗中医药科技发展有限公司提供;细菌内毒素工作标准品: 每支120 EU,中国食品药品检定研究院提供;细菌内毒素检查用水(BET水):湛江安度斯生物有限公司产品;鲎试剂:0.25 EU/mL,0.125 EU/mL,0.06 EU/mL,湛江安度斯生物有限公司产品;抗增液:湛江安度斯生物有限公司产品。
2 实验方法
2.1 限值(L)的确定[2]
按公式L=K/M 计算。 K为每千克体重每小时最大可接受的内毒素剂量,放射性药品注射剂K=2.5 EU/(kg·h);M为每千克体重每小时的最大供试品剂量,人均体重按60 kg计算,注射时间不足1 h,按1 h计算。
2.2 标准溶液制备
细菌内毒素工作标准品用1 mL BET水复溶后,在旋涡混合器上混匀15 min,然后逐级稀释制备标准溶液(浓度为2λ、λ、0.5λ、0.25λ,λ为鲎试剂灵敏度标示值),每步稀释均在旋涡混合器上混匀30 s,使其在使用前充分分散。
2.3 鲎试剂灵敏度复核
取18支鲎试剂,其中16支分别用0.1 mL BET水复溶,然后分别加入0.1 mL浓度为2λ、λ、0.5λ、0.25λ的内毒素标准溶液,每个浓度平行做4支;剩余2支,每支加入0.2 mL BET水,作为阴性对照(NC)。37±1 ℃恒温培养60±2 min。若2λ管均为阳性(+),0.25λ管均为阴性(-),NC均为(-)时,实验有效。计算鲎试剂灵敏度测定值λc=antilg(∑X/4)(X为反应终点浓度的对数值)。λc在0.5λ~2λ范围内时,该批鲎试剂符合规定,并以标示灵敏度λ为该批鲎试剂的灵敏度。
2.4 最大有效稀释倍数(MVD)计算
实验中供试品溶液被允许达到稀释的最大倍数由公式MVD=cL/λ计算得出,在不超过此稀释倍数的浓度下进行内毒素限值的检测。c为供试品溶液浓度,当L以EU/mL表示时,c为1.0 mL/mL。
2.5 干扰实验
按《中国药典》2010 年版二部附录(ⅪE)-细菌内毒素检查法[2]进行干扰实验。供试品溶液组(A)平行两管,每管用0.1 mL BET水复溶鲎试剂,然后加入0.1 mL供试品溶液;干扰实验系列(B),每管用0.1 mL内毒素标准溶液(共四个浓度2λ、λ、0.5λ、0.25λ)复溶鲎试剂,然后加入0.1 mL供试品溶液,每个浓度平行四管;鲎试剂标示灵敏度对照系列(C)同灵敏度复核内毒素标准溶液系列;阴性对照组(D)平行两管,每管加入0.2 mL BET水。37 ℃±1 ℃恒温培养60±2 min。当A、D均为(-),C组在鲎试剂灵敏度复核范围内时,实验有效。计算Es=antilg(∑Xs/4),Et=antilg(∑Xt/4)(Xs为系列溶液C反应终点浓度的对数值,Xt系列溶液B的反应终点浓度的对数值)。Es在0.5~2 λ范围内,Et在0.5Es~2Es范围内,供试品在该浓度下无干扰。如有干扰,采用有效的去除干扰方式重新实验。
2.6 细菌内毒素检查
采用建立好的细菌内毒素检查方法对碘[131I]爱克妥昔单抗注射液进行检验。实验分为供试品组、阳性对照组、供试品阳性对照组、阴性对照组,每组平行两管。供试品组每管用0.1 mL BET水复溶鲎试剂,然后加入0.1 mL供试品溶液;阳性对照组,每管用0.1 mL BET水复溶鲎试剂,然后加入0.1 mL浓度为2λ的内毒素标准溶液;供试品阳性对照组,每管用0.1 mL浓度为2λ的内毒素标准溶液复溶鲎试剂,然后加入0.1 mL供试品溶液;阴性对照组每管加入0.2 mLBET水。37±1 ℃恒温培养60±2 min。阴性对照组均为(-),阳性对照组和供试品阳性对照组均为(+),实验有效;供试品组均为(-)时,判定供试品符合规定。
3 结果与讨论
3.1 限值(L)的确定
碘[131I]爱克妥昔单抗注射液为无菌水针制剂,每瓶约4.0 mL。临床实验计划给药方案为:加入100 mL生理盐水建立静脉通道后滴注,30±10 min内滴完,计算 M=4 mL/(60 kg·h);放射性药品注射剂K=2.5 EU/(kg·h),计算L=K/M=37.5 EU/mL。为了严格控制产品质量,保障用药安全,上海海抗中医药科技发展有限公司企业内控标准将L定为5 EU/mL。
3.2 鲎试剂灵敏度复核
对3批不同批号和规格的鲎试剂进行灵敏度复核实验,结果见表1。3批鲎试剂灵敏度测定值(λc)均在0.5~2.0λ范围内,鲎试剂灵敏度复核均符合规定。
3.3 最大有效稀释倍数(MVD)
碘[131I]爱克妥昔注射液的细菌内毒素限值L为5 EU/mL,目前市售鲎试剂灵敏度λ通常在0.5~0.03 EU/mL,鲎试剂的灵敏度越高,相应的MVD越大。当使用不同规格鲎试剂时所对应的最大有效稀释倍数见表2。
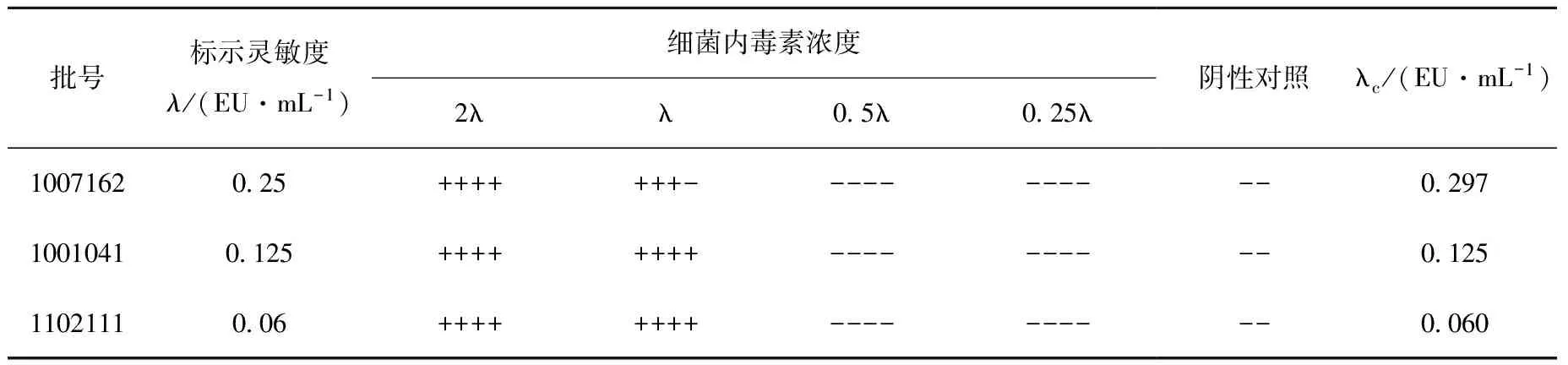
表1 鲎试剂灵敏度复核Table 1 Confirmation of the labelled lysate sensitivity

表2 最大有效稀释倍数Table 2 The maximum valid dilution
3.4 干扰实验
为尽量避免供试品所含的内毒素对干扰实验造成阳性影响[3],首先选用较低灵敏度的鲎试剂。选λ为0.25 EU/mL的鲎试剂,供试品用BET水稀释10倍、20倍进行实验,结果见表3。
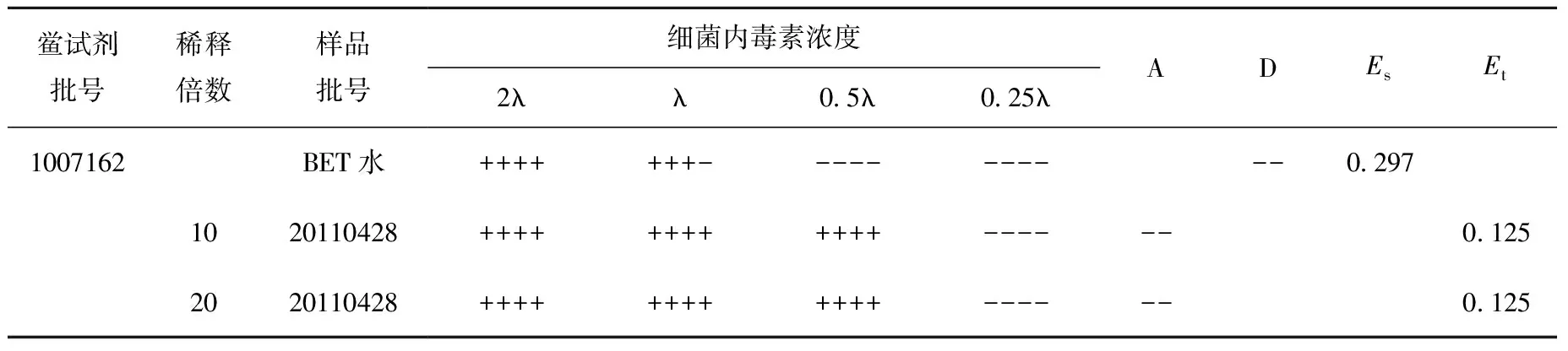
表3 10倍、20倍稀释液干扰实验Table 3 The test for interfering factors at 10 times and 20 times dilution
实验结果表明:Es在0.5λ~2λ范围内,Et均小于0.5Es,供试品在10、20倍稀释浓度下均存在干扰,且为增强作用。
采用两种方法去除干扰,直接稀释法和抗增液法。直接稀释法将供试品进行更高倍数稀释,抗增液法实验过程中以抗增液替代检查用水。实验结果见表4和表5。
直接稀释法中,首先选用λ为0.125 EU/mL的鲎试剂,将供试品稀释40倍进行实验。实验结果表明:Es在0.5λ~2λ范围内,Et小于0.5Es,实验存在干扰,为增强作用;选用λ为0.06 EU/mL的鲎试剂,将供试品稀释80倍进行实验,Es在0.5λ~2λ范围内,三批供试品的Et均在0.5Es~2Es范围内,实验均无干扰。
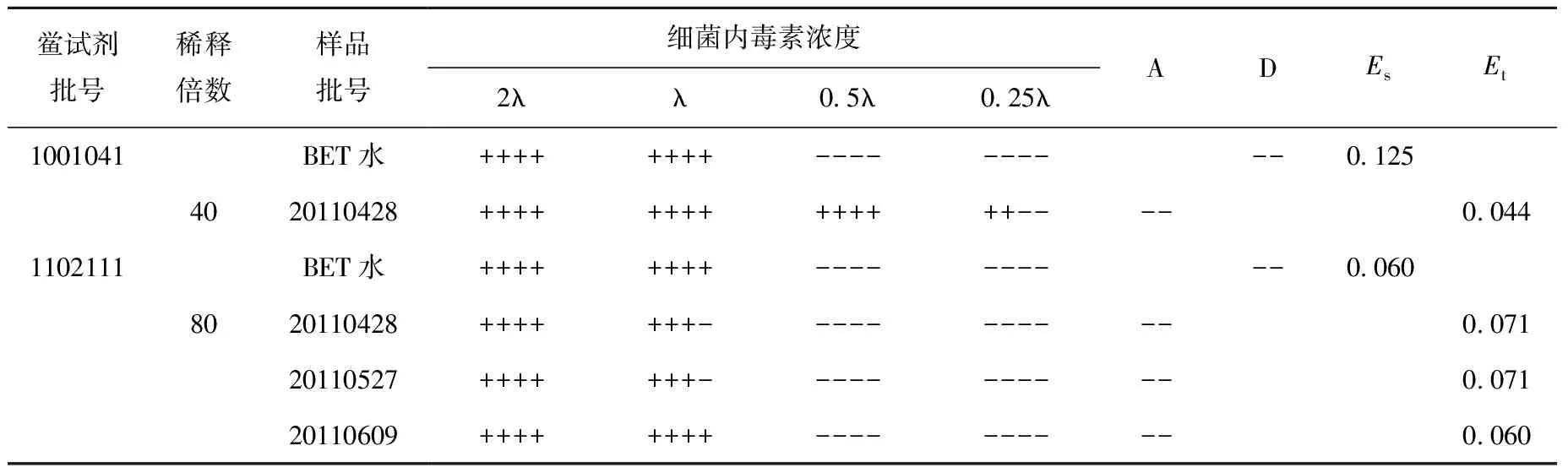
表4 直接稀释法干扰实验Table 4 The test for interfering factors using a greater dilution
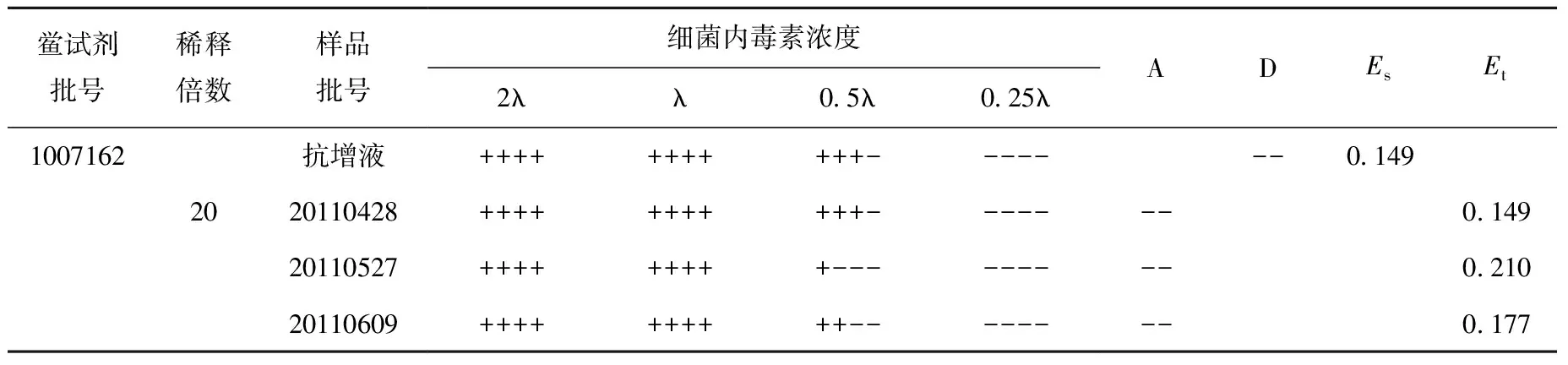
表5 抗增液法干扰实验Table 5 The test for interfering factors using the endotoxin-specific buffer
采用抗增液法进行实验,将供试品稀释20倍时,Es在0.5λ~2λ范围内,三批供试品的Et均在0.5Es~2Es范围内,实验均无干扰。
直接稀释法和抗增液法均可有效去除干扰。直接稀释法操作简单方便、且比较经济,推荐为碘[131I]爱克妥昔注射液常规检验的首选方法。
3.5 细菌内毒素检查
采用直接稀释法,选λ为0.06 EU/mL的鲎试剂,将供试品稀释80倍进行细菌内毒素检查。4批次碘[131I]爱克妥昔注射液的检验结果见表6,结果均符合规定。
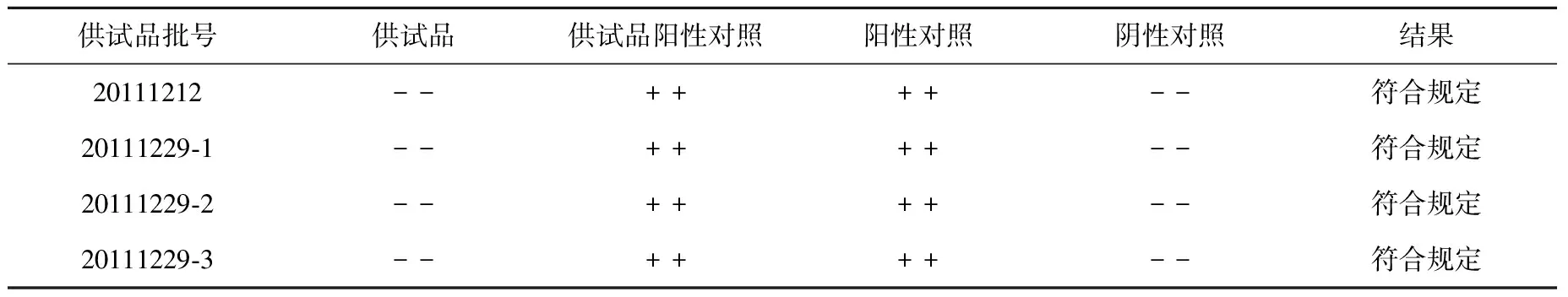
表6 碘[131I]爱克妥昔单抗注射液的细菌内毒素检查Table 6 The bacterial endotoxin test of Iodine[131I] Actuximab Injection
实验结果表明:4个批次的碘[131I]爱克妥昔注射液的细菌内毒素检查结果均符合规定,细菌内毒素含量均小于5 EU/mL。
4 小结
碘[131I]爱克妥昔单抗注射液为放射性药品,细菌内毒素检查主要采用凝胶法。鲎试剂与内毒素的反应易受很多因素影响,碘[131I]爱克妥昔单抗注射液中含有人血白蛋白,人血白蛋白可激活鲎试剂的G因子旁路反应,使检验结果出现假阳性。当存在干扰时可通过直接稀释法、抗增液、特异性鲎试剂等[4]多种方法去除干扰。
当采用直接稀释法进行实验时,将供试品稀释10、20、40倍均存在干扰,稀释80倍无干扰。可以采用将供试品至少稀释80倍,进行碘[131I]爱克妥昔单抗注射液的细菌内毒素检查。
抗增液主要是通过添加过量的真菌多糖来阻断G因子旁路反应,消除干扰。采用抗增液法进行实验时,将供试品稀释20倍即无干扰。可以采用将供试品至少稀释20倍,以抗增液替代检查用水复溶鲎试剂,进行碘[131I]爱克妥昔单抗注射液细菌内毒素检查。
直接稀释法和抗增液法均可有效去除干扰。直接稀释法操作简单方便、且比较经济,推荐为碘[131I]爱克妥昔注射液常规检验的首选方法。采用直接稀释法对4批供试品检验均符合规定,产品质量稳定。
本研究建立了碘[131I]爱克妥昔单抗注射液细菌内毒素检查方法,可用于该产品的质量检验、对产品质量进行控制,同时也为新药的申报工作提供相关资料和数据支持。
[1] 国家药典委员会. 中华人民共和国药典(二部)[S]. 北京:中国医药科技出版社,2010:附录6~7.
[2] 国家药典委员会. 中华人民共和国药典(二部)[S]. 北京:中国医药科技出版社,2010:附录99~102.
[3] 中国药品生物制品检定所. 中国药品检验标准操作规范[S]. 北京:中国医药科技出版社,2010:310-325.
[4] 肖贵南,孙清萍,盛英美. 如何建立新药的细菌内毒素检查方法[J]. 中国医药导报,2011,8(32):159-162.
Xiao Guinan, Sun Qingping, Sheng Yingmei. How to establish the method of bacterial endotoxin test for new drugs[J]. China Medical Herald, 2011, 8(32): 159-162(in Chinese).
Establishment of Bacterial Endotoxin Test of Iodine [131I] Actuximab Injection
SUN Xiang-min1, ZHANG Yun1, ZHANG Xian1, YANG Wei-wei2, CAI Hai-yan2
(1.HTACO.,LTD.,Beijing102413,China;2.ShanghaiHaikangPharmaceuticalTech. &Deve.Co.,Ltd,Shanghai201318,China)
To establish a method for the bacterial endotoxin test of Iodine [131I] Actuximab Injection,The experiment was carried out according to the appendix ⅪE in Vol.Ⅱ of the 2010 version of Chinese Pharmacopoeia. The results demonstrated that the preparation interfered with the test at 10 times, 20 times and 40 times dilution,and the interference can be eliminated after the sample was diluted to 80 times or the sample was diluted to 20 times with the endotoxin-specific buffer dissolving the Tachypleus Amebocyte Lysate. Two methods can be used to test the bacterial endotoxin of Iodine [131I] Actuximab Injection. One is the sample should be diluted to atleast 80 times,the other is the sample was diluted to 20 times with the endotoxin-specific buffer dissolving the Tachypleus Amebocyte Lysate. The dilution method is the preferred method for the quality control.
iodine [131I] actuximab injection; bacterial endotoxin test; interference test
10.7538/tws.2015.28.03.0135
2015-03-06;
2015-04-16
孙祥敏(1984—),女,河南人,工程师,主要从事药品检验工作
TL92+3
A
1000-7512(2015)03-0135-05

