光动力治疗在胆管癌姑息性治疗中的应用*
胡贤荣 综述 胡 冰 审校
(第二军医大学附属东方肝胆外科医院内镜科,上海 200438)
·文献综述·
光动力治疗在胆管癌姑息性治疗中的应用*
胡贤荣 综述 胡 冰**审校
(第二军医大学附属东方肝胆外科医院内镜科,上海 200438)
胆管癌是胆道系统的恶性肿瘤,其患病率近10年持续上升。由于胆管癌的解剖位置特殊,起病隐匿,故早期诊断率很低,确诊时往往已到中晚期而失去根治性切除机会,预后极差。根治性切除是临床治愈胆管癌的惟一手段,遗憾的是只有低于10%的病人有切除的机会,并且在这些进行手术切除的病人中,近50%会出现肿瘤复发[1]。同时没有证据表明辅助放疗与化疗可使患者获益,且不能降低术后复发率[2]。因此,姑息性的治疗手段显得尤为重要。遗憾的是胆管癌现有的姑息性治疗手段都无法获得较好疗效,所以无法手术切除的胆管癌预后极差。尽管胆道支架引流解除了黄疸并很大程度上改善了病人的生活质量,但患者的生存期仍然十分有限[3]。相关研究显示30天死亡率约为40%,中位生存时间一般<300天,肿瘤体积较大(>3 cm)的患者则更短(约99天)[4]。
现有的治疗手段无法为患者提供良好的疗效与生存的获益,寻找新的有效的治疗手段极为迫切。光动力治疗(photodynamic therapy,PDT)是一项相对新的局部治疗手段,已在大量的研究中显示出其在治疗胆管癌中的有效性和安全性,患者的生存期得到延长。2013年发布的亚太地区胆管癌治疗共识中[5],PDT在胆管癌姑息性治疗中的应用,证据级别为Ⅰ级,推荐强度为A级,PDT已成为胆管癌姑息性治疗的重要治疗选择。本文拟从PDT的原理、光敏剂、在胆管癌治疗中的应用以及前沿进展领域作一综述。
1 光动力治疗原理
在光动力治疗中,两种无毒成分光敏剂和光源序贯应用以达到光动力治疗的目的。首先是光敏剂局部或者全身应用,经过一段时间,光敏剂在体内增殖旺盛部位富集。大多数光敏剂都有多个激发波长,在肿瘤治疗中一般应用最长波长,因为波长与组织作用深度正相关,特定波长光波照射激活光敏剂,在氧分子的存在下引发光敏剂的光化学反应产生大量杀伤作用的单态氧,进而通过凋亡、坏死等机制杀伤肿瘤细胞。PDT对肿瘤的杀伤主要通过3种机制实现:①对微血管的破坏作用。通过损伤血管内皮细胞引起血管活性分子的释放,从而引起血管通透性增高、血小板聚集、白细胞黏附、静脉血管收缩血液流动停滞。其结果是肿瘤微环境变化引起的缺氧缺血导致肿瘤细胞的死亡。②诱导肿瘤细胞凋亡和坏死,是PDT产生疗效的重要机制。③免疫反应。光动力治疗后细胞膜及血管壁的损伤引起中性粒细胞、单核细胞及巨噬细胞的趋化,同时激活前体免疫因子如白细胞介素(IL)1b、IL-2、肿瘤坏死因子(TNF)α。上调的免疫环境在二次细胞毒性及肿瘤控制上扮演着重要角色[6]。
2 光敏剂
理想的光敏剂应具备以下特点[7]:①有较高的三重态量子产率,从而产生足量的单线态氧;②在激发波长范围对组织的穿透性好;③易于在肿瘤组织富集,而正常组织不或者少吸收;④有稳定的化学性质,最好是单一的物质;⑤光毒性强而暗毒性弱;⑥药物应能较快从体内排出。
目前,血卟啉衍生物如卟吩姆钠(porfimer sodium,Photofrin)是光动力治疗胆管癌中应用最广的光敏剂(表1)。Photofrin推荐2 mg/kg静脉注射,通常48小时后进行光波照射,激发波长为630 nm,照射能量为180 J/cm2,所能达到的组织照射深度为4~6 mm。主要的副作用为皮肤的光过敏,因此治疗后病人需要避光3~4天后才可逐渐光暴露,而强光暴露则需要4~6周后才可进行[8]。5-氨基乙酰丙酸(5-ALA)作为第二代光敏剂是人体的内源性物质,其代谢途径为合成血红素,血红素是血红蛋白、肌红蛋白等的辅基,所以中间的代谢产物无毒副作用。5-ALA的激发波长同样为630 nm,其组织穿透深度为2 mm,光毒性小,用药后只需避强光1~2天[9]。5-ALA值得注意的一个优点是其可通过口服途径给药,60 mg/kg,5~7小时可达到治疗疗效的血药浓度[10]。新型的光敏剂替莫泊芬(temoporfin,Foscan)吸收峰在652 nm波长附近,可引起更深层的细胞坏死,由于其对光激发的高度敏感,所以在剂量控制及曝光上需更谨慎。Kniebühler等[11]在支架治疗的基础上使用低剂量Foscan对13例进行光动力治疗,诊断后中位生存期为13个月,获得了与标准的Photofin治疗相当的疗效,同时低剂量的治疗可能是没有发生严重并发症如严重的光过敏的原因。

表1 光敏剂在胆管癌中的应用
化学家和药剂学家以及临床医师对光敏剂的研究与开发都有着极大的热忱,如何从组织的靶向选择性、激发光的组织穿透性以及其他方面增益现有的光敏剂是共同努力的方向,与纳米分子技术的结合也展现出极大的吸引力[21,22]。
3 PDT在胆管癌治疗中的应用
光动力治疗已经在头颈部肿瘤、胃肠道肿瘤、膀胱肿瘤、皮肤疾病、眼科疾病等各个领域展开了大量的基础、临床研究及实践,在胃肠道中,胆管癌的治疗可谓是最令人振奋的治疗领域[6]。
激光是腔内治疗使用最多的光源,激光光源产生特定波长的单色光,通过圆柱形的传送光纤传输,光纤通过标准套管送至目标胆管处,适当调整好位置后则可进行光照治疗。在进行光动力治疗后多置入塑料支架引流,也已经有金属支架作引流的尝试,并有实验对自膨式金属支架影响光波吸收进行了评估[23],该实验表明630 mn或652 nm点状或线状的光源在金属支架应用时更易产生阴影效应,不论金属是否覆膜均会引起一定程度的光波吸收。结论是光动力联合金属支架治疗是可行的,需要解决的问题是调整光照剂量以减少因支架吸收引起的治疗量损失。
光动力治疗联合支架引流在无法切除的肝门部胆管癌患者中的应用取得了很好的治疗效果(表1)。在Ortner等[12]进行的第一项针对光动力治疗的随机对照研究中,纳入39名肿瘤<3 cm的肝门部肿瘤。使用的光敏剂为Photofrin,光动力联合支架治疗的中位生存时间为498 d(n=20),单独支架治疗的中位生存时间为98 d(n=19),2组差异有显著性(P<0.0001)。Zoepf等[18]进行的研究是针对32名非选择性无法切除的胆管癌病人的非随机试验,也对光动力治疗延长生存时间予以了肯定。该试验中使用光敏剂Photosan。支架联合光动力治疗与单独支架治疗的中位生存时间分别为630 d、210 d(P=0.0109)。副作用只在2项试验的少数病人中出现(狭窄为0~10%,光过敏0~10%),光动力治疗联合支架治疗和单纯支架治疗在诱发胆管炎上没有明显差异,胆道出血仅1例。
Witzigmann等[24]进行的另一大型的回顾性研究,对肝门部胆管癌的手术治疗、单纯支架治疗、支架联合光动力治疗的预后进行比较。光动力联合支架治疗与单纯支架治疗比较明显延长了生存时间(360 d对192 d),光动力治疗联合支架治疗与不完全切除(R1/R2)术后相近(360 d对366 d),应该注意的是进行光动力治疗的病人在肿瘤分期分型上恶性程度是更高的。生存期最长的是R0切除患者(684 d)。光动力联合支架治疗在减黄和改善生存质量上是优于单纯支架治疗的。该研究同时肯定了多次光动力治疗的有效性。
Prasad等[25]对光动力治疗后生存时间延长的相关因素进行研究。纳入梅奥诊所1991年~2005年25例病人。结果显示,光动力治疗前影像学表现不佳、诊断与进行光动力治疗间期较长使光动力延长生存时间的获益减少。
与光动力治疗关系最密切的并发症是光过敏,发生率在4%~25%[12]。光敏剂虽然有向增生旺盛组织富集的特性,但也在皮肤等正常组织中少量分布,且不同的光敏剂其代谢过程不尽相同,影响着光动力治疗的避光时间,避光不当则可能出现光过敏反应[8]。另外,在光动力姑息性治疗胆管癌的过程中,也存在着内镜相关并发症的风险,如胆管炎、胆道出血、胆漏、狭窄形成等,光动力治疗后局部组织的水肿以及结块的坏死组织未完全清除等原因引起的短暂胆道阻塞可能是相关并发症的一个诱因。
4 PDT对于胆管癌围手术期的辅助治疗作用
第一次对光动力治疗作为胆管癌辅助治疗手段的研究来自于一篇病例报道[26]。结果显示光动力治疗作为辅助手段是有效的选择。对8例切除术后肿瘤组织残留的病人进行光动力辅助治疗,可以观察到显著的肿瘤组织破坏,其中有4例在随访中(6~20个月)未出现肿瘤复发。
Cosgrove等[27]在一项小样本非对照的研究中对4名等待肝移植的进展期Bismuth Ⅲ或Ⅳ型患者进行光动力新辅助治疗。所有患者在治疗后均获得了肝移植的机会,治疗期间未出现严重的光过敏,2例在ERCP后出现轻微的胆管炎,移植后中位随访28.1月,1例肿瘤复发。
5 PDT后的肿瘤微环境在胆管癌靶向治疗中的探索
PDT后病程晚期复发常出现,针对PDT治疗后肿瘤微环境中细胞、蛋白、基因的变化而寻求相应措施增强PDT疗效则成为一个方向。Gomer等[28]的研究显示,PDT治疗后肿瘤细胞、组织的血管内皮生长因子(VEGF)、基质金属蛋白酶(MMPs)、环氧合酶2(COX-2)等促进肿瘤生长的基因、蛋白表达上调,诱导肿瘤组织重建与血管新生。一系列的实验研究表明[29~32],光动力治疗可引起或刺激肿瘤微环境中包括VEGF、COX-2和前列腺素、TNF-α、MMPs、整合蛋白、IL-6、IL-8等因子的释放,这些分子或许直接参与PDT治疗后的肿瘤组织重建与血管新生。针对性的联合光动力治疗与相关的抑制剂抑制在肿瘤微环境中促进肿瘤细胞生存的因子的靶向治疗便成了探索增强PDT疗效的行之有效的办法(图1)。
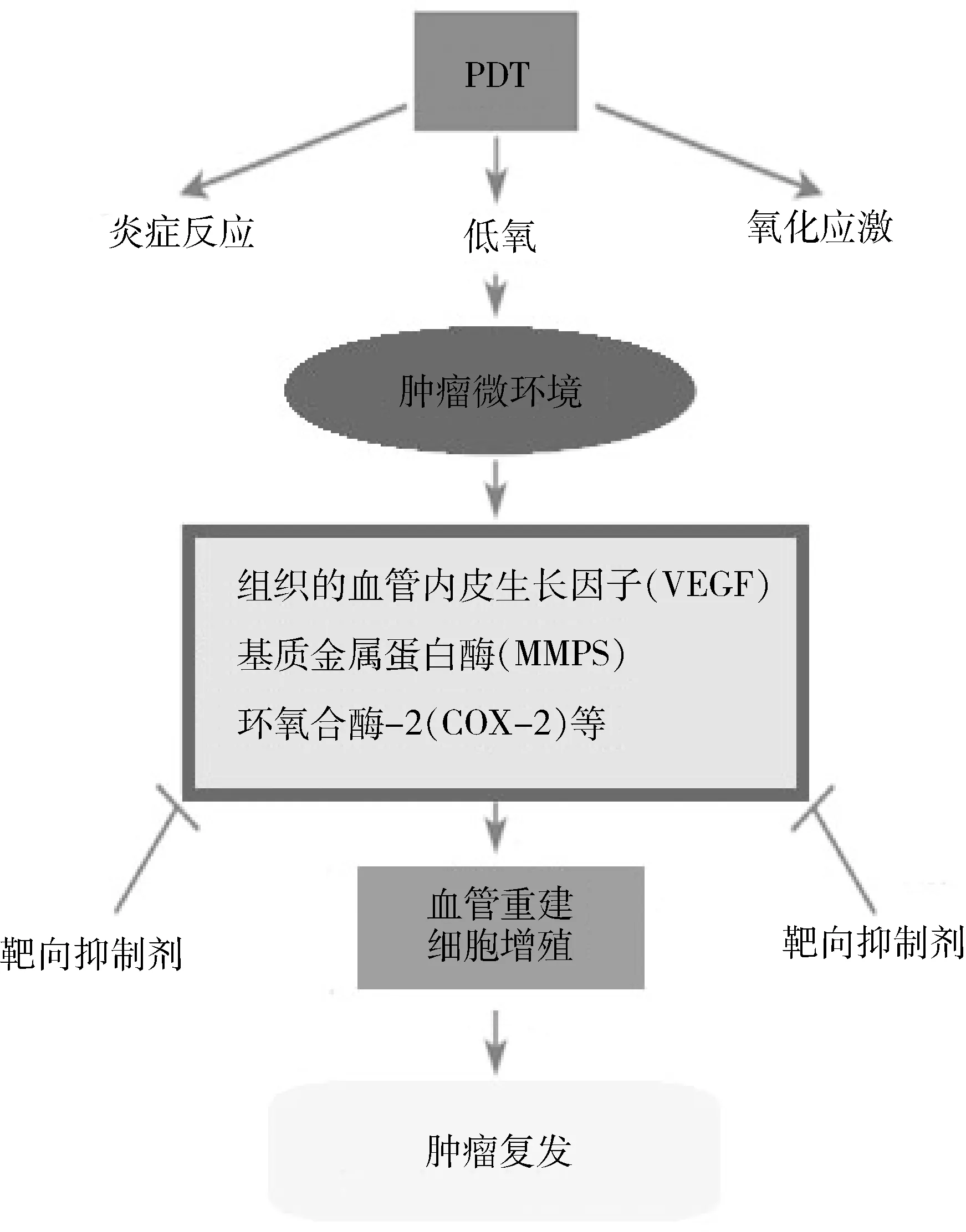
图1 光动力治疗对肿瘤微环境的影响
光动力治疗联合塞来昔布[29]、血管生长抑制剂[30]、基质金属蛋白酶抑制剂[31]及VEGF和表皮生长因子(EGF)受体抑制剂[32]在乳腺癌、卡波西肉瘤、膀胱癌等动物模型中的应用表明,光动力联合相应受体抑制剂治疗比单纯光动力治疗更为有效。
同时,在胆管癌的光动力治疗后肿瘤微环境探索中,也有新的尝试。在5-ALA光动力治疗胆管癌的动物模型中[33],联合使用塞来昔布组的氧化应激反应比单纯光动力治疗组更为活跃,表现出了更好的光动力治疗效果。另有一实验研究在光动力治疗胆管癌的同时联合EGF受体抑制剂[34],verteporfin-PDT联合EGF受体抑制剂在治疗两种胆管癌细胞系HuCCT1和TFK1中均对PDT产生的细胞杀伤作用有增益效果,获得肯定疗效的同时也提示EGFR对PDT杀伤细胞的DNA损伤可能有修复作用。
6 小结
胆管癌的总体生存预期都很短,早期诊断率低,确诊时往往已到中晚期而失去根治性切除机会,预后极差,所以姑息性治疗在胆管癌的治疗中有着非常重要的地位,然而现有的姑息性治疗手段无法为患者提供良好的疗效与生存的获益,寻找新的有效的治疗手段极为迫切。光动力治疗作为一个微创、副作用小、可重复进行的有效的治疗手段给病人带来了福音。大量的临床及基础实验研究已表明其治疗的积极作用,展现出了极大的应用前景,在胆管癌的姑息性治疗中,合并支架引流在改善生活质量的同时明显延长生存期,并且作为辅助治疗手段也可为患者带来更多的收益。所以我们推荐光动力治疗应作为不可手术切除的胆管癌的一线治疗手段。随着化学、药剂学及纳米技术对光动力原理及光敏剂研究的深入,比如对现有光敏剂在给药剂量和光照剂量上的优化,甚至结合纳米技术的靶向富集的光敏剂的开发,都将为提高光动力在胆管癌治疗中的疗效添砖加瓦。同时,随着对光动力治疗后肿瘤微环境变化的研究不断深入,针对肿瘤微环境的靶向治疗药物的应用,也将使光动力治疗在胆管癌的姑息性治疗中获得更鼓舞人心的疗效。
1 Jang JY,Kim SW,Park DJ,et al.Actual long-term outcome of extra-hepatic bile duct cancer after surgical resection.Ann Surg,2005,241(1):77-84.
2 Todoroki T,Kawamoto T,Koike N,et al.Treatment strategy for patients with middle and lower third bile duct cancer.Br J Surg,2001,88(3):364-370.
3 李兆申,汪 鹏.胆胰肿瘤介入治疗现状及展望.中国微创外科杂志,2007,7(8):711-713.
4 Prat F,Chapat O,Ducot B,et al.Predictive factors for survival of patients with inoperable malignant distal biliary strictures:a practical management guideline.Gut,1998,42(1):76-80.
5 Rerknimitr R,Angsuwatcharakon P,Ratanachu-ek T,et al.Asia-Pacific consensus recommendations for endoscopic and interventional management of hilar cholangiocarcinoma.J Gastroenterol Hepatol,2013,28(4):593-607.
6 Agostinis P,Berg K,Cengel KA,et al.Photedynamic therapy of cancer:an update.CA Cancer J Clin,2011,61(4):250-281.
7 Stemberg ED,Dolphin D.Porphyrin-based photosensitizers for use in Photodynamic therapy.Tetrahedron,1998,54:4151-4202.
8 Allison RR,Sibata CH.Oncologic photodynamic therapy photosensitizers:a clinical review.Photodiagnosis Photodyn Ther,2010,7(2):61-75.
9 Kim CH,Chung CW,Choi KH,et al.Effect of 5-aminolevulinic acid-based photodynamic therapy via reactive oxygen species in human cholangiocarcinoma cells.Int J Nanomedicine,2011,6:1357-1363.
10 Chung CW,Kim CH,Lee HM,et al.Aminolevulinic acid derivatives-based photodynamic therapy in human intra- and extrahepatic cholangiocarcinoma cells.Eur J Pharm Biopharm,2013,85(3 Pt A):503-510.
11 Kniebühler G,Pongratz T,Betz CS,et al.Photodynamic therapy for cholangiocarcinoma using low dose mTHPC (Foscan®).Photodiagnosis Photodyn Ther,2013,10(3):220-228.
12 Ortner MA,Caca K,Berr F,et al.Successful photodynamic therapy for nonresectable cholangiocarcinoma:a randomized prospective study.Gastroenterology,2003,125(5):1355-1363.
13 Kahaleh M,Mishra R,Shami VM,et al.Unresectable cholangiocarcinoma: comparison of survival in biliary stenting alone vs stenting with photodynamic therapy.Clin Gastroenterol Hepatol,2008,6(3):290-297.
14 Pereira SP,Aithal GP,Ragunath K,et al.Safety and long term efficacy of porfimer sodium photodynamic therapy in locally advanced biliary tract carcinoma.Photodiagnosis Photodyn Ther,2012,9(4):287-292.
15 Lee TY,Cheon YK,Shim CS,et al.Photodynamic therapy prolongs metal stent patency in patients with unresectable hilar cholangiocarcinoma.World J Gastroenterol,2012,18(39):5589-5594.
16 Cheon YK,Lee TY,Lee SM,et al.Longterm outcome of photodynamic therapy compared with biliary stenting alone in patients with advanced hilar cholangiocarcinoma.HPB (Oxford),2012,14(3):185-193.
17 Hoblinger A,Gerhardt T,Gonzalez-Carmona MA.Feasibility and safety of long-term photodynamic therapy (PDT) in the palliative treatment of patients with hilar cholangiocarcinoma. Eur J Med Res,2011,16(9):391-395.
18 Zoepf T,Jakobs R,Joachim C,et al.Palliation of nonresectable bile duct cancer:improved survival after photodynamic therapy.Am J Gastroenterol,2005,100(11):2426-2430.
19 Zoepf T,Jakobs R,Rosenbaum A,et al.Photodynamic therapy with 5-aminolevulinic acid is not effective in bile duct cancer.Gastrointest Endosc,2001,54(6):763-766.
20 Peireira SP,Ayaru L,Rogowska A,et al.Photodynamic therapy of malignant biliary stricture using meso-tetrahydroxyphenylchlorin.Eur J Gastroenterol Hepatol,2007,19(6):479-485.
21 Pankratov AA,Andreeva TN,Yakubovskaya RI,et al.Study of photoinduced antitumor activity of phthalocyanin-based nanostructures as pro-photosensitizers in photodynamic therapy of malignant tumors in vivo.Bull Exp Biol Med,2014,157(6):798-803.
22 Punjabi A,Wu X,Tokatli-Apollon A,et al.Amplifying the red-emission of upconverting nanoparticles for biocompatible clinically used prodrug-induced photodynamic therapy.ACS Nano,2014,8(10):10621-10630.
23 Wang LW,Li LB,Li ZS,et al.Self-expandable metal stents and trans-stent light delivery: are metal stents and photodynamic therapy compatible?Lasers Surg Med,2008,40(9):651-659.
24 Witzigmann H,Berr F,Ringel U,et al.Surgical and palliative management and outcome in 184 patients with hilar cholangiocarcinoma:palliative photodynamic therapy plus stenting is comparable to R1/R2 resection.Ann Surg,2006,244(2):230-239.
25 Prasad GA,Wang KK,Baron TH,et al.Factors associated with increased survival after photodynamic therapy for cholangiocarcinoma.Clin Gastroenterol Hepatol,2007,5(6):743-748.
26 Nanashima A,Yamaguchi H,Shibasaki S,et al.Adjuvant photodynamic therapy for bile duct carcinoma after surgery:a preliminary study.J Gastroenterol,2004,39(11):1095-1101.
27 Cosgrove ND,Al-Osaimi AM,Sanoff HK,et al.Photodynamic therapy provides local control of cholangiocarcinoma in patients awaiting liver transplantation.Am J Transplant,2014,14(2):466-471.
28 Gomer CJ,Ferrario A,Luna M.Photodynamic therapy: combined modality approaches targeting the tumor microenvironment.Lasers Surg Med,2006,38(5):516-521.
29 Ferrario A,Fisher AM,Gomer CJ.Celecoxib and NS-398 enhance photodynamic therapy by increasing in-vitro apoptosis and decreasing in-vivo inflammatory and angiogenic factors.Cancer Res,2005,65(20):9473-9478.
30 Ferrario A,Gomer CJ.Avastin enhances photodynamic therapy treatment of Kaposi’s sarcoma in a mouse tumor model.J Environ Pathol Toxicol Oncol,2006,25(1-2):251-259.
31 Ferrario A,Chantrain CF,Gomer CJ.Thematrix metalloproteinase inhibitor prinomastat enhances photodynamic therapy responsiveness in a mouse tumor model.Cancer Res,2004,64(7):2328-2332.
32 Bhuvaneswari R,Thong P,Yuen GY,et al.Combined use of anti-VEGF and anti-EGFR monoclonal antibodies with photodynamic therapy suppresses tumor growth in an in vivo tumor model.J Cancer Sci Ther,2013,5:100-105.
33 Kim CH,Chung CW,Lee HM,et al.Synergistic effects of 5-aminolevulinic acid based photodynamic therapy and celecoxib via oxidative stress in human cholangiocarcinoma cells.Int J Nanomedicine,2013,8:2173-2186.
34 Andreola F,Cerec V,Pereira SP,et al.Effect of verteporfin-PDT on epithelial growth factor receptor (EGFR) signaling pathway in cholangiocarcinoma cell lines.Progress in Biomedical Optics and Imaging,2009,10(2):73806.
(修回日期:2014-12-04)
(责任编辑:王惠群)
卫生计生委重大专项课题(项目编号:2012zx10002016003004)
R735.8
A
1009-6604(2015)05-0460-05
10.3969/j.issn.1009-6604.2015.05.022
2014-08-01)
** 通讯作者,E-mail:drhubing@aliyun.com

