17β 雌二醇对氯胺酮诱导发育期大鼠皮质神经细胞凋亡的影响
李建立 ,张秀果,常秀杰,容俊芳,蔚冬冬,吴红海,侯艳宁
氯胺酮作为小儿麻醉时的常用药物,其对发育期大脑的神经毒性,近年来引起了国内外学者的广泛关注,因此寻找安全有效的措施来防治氯胺酮的发育期神经毒性变得十分迫切。我们的前期研究发现神经甾体17β 雌二醇可通过抗凋亡机制对氯胺酮诱导的原代培养皮质神经元凋亡产生保护作用[1]。但17β雌二醇是否对氯胺酮引起的发育期大鼠大脑皮质区神经细胞凋亡产生保护作用以及机制未见报道。本文对此进行了研究,为围手术期应用17β 雌二醇防治氯胺酮的发育期神经毒性提供进一步的实验依据。
1 材料与方法
1.1 材 料
1.1.1 实验动物及分组 母鼠与出生7 日龄雄性SD 幼鼠均由河北医科大学动物实验中心提供(合格证号:1306107,体质量16~18 g)。30 只7 日龄雄性SD 幼鼠,随机分为对照组(C 组)、氯胺酮组(K 组)、氯胺酮+17β 雌二醇组(K+E 组),每组10只。C 组连续3 d 腹腔注射等容量生理盐水;K 组连续3 d 腹腔注射75 mg/kg 氯胺酮;K +E 组连续3 d腹腔注射75 mg/kg 氯胺酮,同时皮下注射600 μg/kg 17β 雌二醇。麻醉后把幼鼠放在暖箱中同时给予低流量氧气(2 L/min),实验过程密切观察幼鼠的呼吸频率以及皮肤颜色,各组幼鼠与母鼠的分离时间均为250 min[2]。
1.1.2 试 剂 氯胺酮(福建古田药业有限公司提供,批号H35020148),17β 雌二醇(美国sigma 公司),Bcl-2、Bax、cleaved-caspase-3 抗体(Cell signaling 公司),TUNEL(德国罗氏公司)。
1.2 方 法
1.2.1 TUNEL 法检测发育期大鼠大脑皮质区神经凋亡 出生7 d 的SD 幼鼠经各组药物处理24 h后,取额叶皮质脑组织经4% 多聚甲醛固定48 h,梯度乙醇脱水后,石蜡垂直定向包埋,切片(厚度为5 μm)。石蜡切片经过二甲苯浸泡3 次,梯度乙醇脱水(每次5 min),然后自来水浸泡5 min,抗原修复20 min,自然冷却。然后滴加3% H2O2去离子水,室温孵育10 min,冷PBS 液冲洗3 次(每次5 min)。滴加正常山羊血清工作液,室温孵育15 min,进行封闭。PBS 液清洗后,浸入通透液(0.1%Triton X-100 溶于0.1%柠檬酸钠)冰上促渗10 min。然后加入50 μl TdT 酶置于CO2孵育箱中37 ℃反应1 h。PBS 液漂洗3 次(每次5 min)后,滴加50 μl Streptavidin-HRP 工作液,室温孵育10 min。PBS 液漂洗3 次(每次5 min),在样本区域滴加100 μl DAB 工作液,直到呈现浅棕色背景。用去离子水漂洗两次,用滤纸小心吸除载玻片上的多余液体,滴加几滴甘油于样本区域,然后盖上盖玻片进行封片。于倒置显微镜下任意选取5 个视野观察TUNEL 阳性细胞并计数,计算神经元的凋亡率,凋亡率=(凋亡细胞数/细胞总数)×100%。
1.2.2 Western-blot 法检测大鼠大脑额叶皮质区bcl-2、Bax 以及cleaved-caspase-3 蛋白的表达幼鼠经药物处理24 h 后,取额叶皮质脑组织经匀浆,裂解液裂解细胞提取细胞总蛋白,BCA 法检测样品蛋白含量。取待测蛋白质50 μg 加上样缓冲液煮沸变性,于10%十二烷基硫酸钠-聚丙烯酰胺凝胶中100 V 电泳1.5 h,转膜2 h,加入bcl-2,Bax 以及cleaved-caspase-3 抗体(1∶ 2000),4 ℃过夜,常规洗涤,加羊抗鼠二抗(1∶ 5000)37 ℃孵育60 min,洗涤,电化学法发光,显影,扫描,用凝胶图像处理系统分析目标条带与内参照条吸光度的比值。实验重复3 次,设β-actin 蛋白为内参。
2 结果
2.1 药物处理后幼鼠一般情况变化 各组幼鼠在给药过程中呼吸均匀,肤色红润,无1 例出现呼吸抑制。
2.2 17β 雌二醇对氯胺酮诱导大鼠大脑皮质区细胞凋亡的影响 与对照组比较,氯胺酮组大鼠大脑皮质区TUNEL 阳性细胞显著性增加(P <0.01);与氯胺酮组比较,氯胺酮+17β 雌二醇组TUNEL 阳性细胞显著性降低(P <0.01)(见图1)。
2.3 不同处理对幼鼠大脑皮质区bcl-2 和Bax水平的影响 与对照组比较,氯胺酮组大鼠大脑皮质区bcl-2 蛋白水平显著性下降(P <0.01),Bax 蛋白水平显著性增加(P <0.01),Bcl-2/Bax 显著性降低(P <0.01);与氯胺酮组比较,氯胺酮+17β 雌二醇组bcl-2 蛋白水平显著性增加(P <0.01),Bax 蛋白水平显著性下降(P <0.01),Bcl-2/Bax 显著性增加(P <0.01)(见图2)。
2.4 不同处理对幼鼠大脑皮质区cleavedcaspase-3 蛋白水平的影响 与对照组比较,氯胺酮组大鼠大脑皮质区cleaved-caspase-3 蛋白水平显著性增加(P <0.01)。与氯胺酮组比较,氯胺酮+17β雌二醇组cleaved-caspase-3 蛋白水平显著性下降(P<0.01)(见图3)。
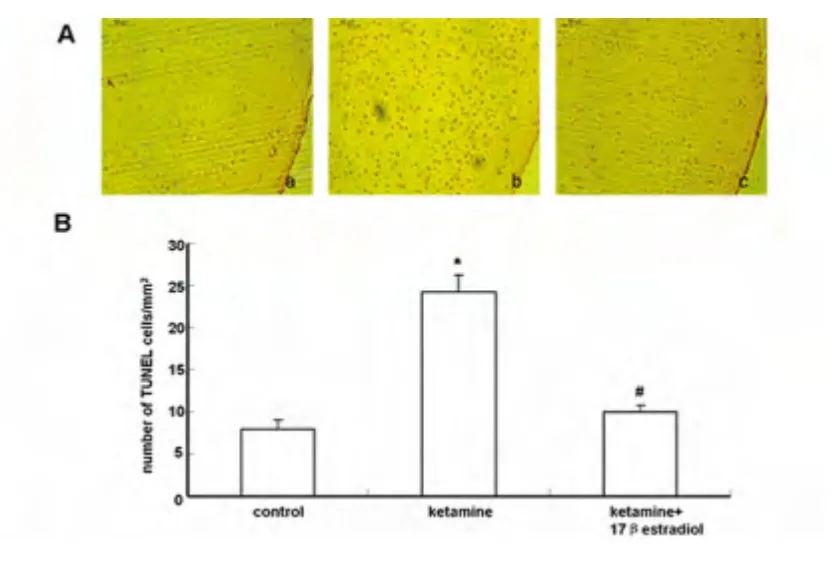
图1 不同处理对皮质区TUNEL 阳性细胞表达的影响(,n=6)

图2 不同处理对bcl-2/Bax 的影响(,n=3)

图3 不同处理对cleaved-caspase-3 水平的影响(,n=3)
3 讨论
氯胺酮作为一种N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体拮抗剂,是小儿麻醉时最为常用的药物。近年来大量研究表明氯胺酮可引起发育期大鼠大脑广泛脑区凋亡样损伤[2~4]。研究表明雌二醇作为一种内源性神经活性甾体在大脑早期发育中发挥着十分重要的调节作用,同时对发育期多种神经损伤可产生神经保护作用[5~7]。我们以往的研究结果表明17β 雌二醇可对氯胺酮诱导的原代培养皮质神经元产生保护作用[1]。由于利用培养细胞进行的体外实验有一定的局限性,比如缺乏机体对外界环境变化的内分泌调节功能,所以本研究进一步以大脑处于快速发育期的7 日龄SD 雄性幼鼠作为研究对象,从动物整体研究17β 雌二醇是否对氯胺酮引起的发育期大鼠皮质区神经细胞凋亡产生保护作用以及机制,以期为临床应用17β 雌二醇预防氯胺酮对发育期大脑的神经损伤提供进一步的实验依据。
大鼠大脑快速发育期处于产后7 d 左右,在此期间神经突触高度活跃,突触连接广泛建立,这一时期的神经元对外界刺激包括全身麻醉药的神经毒性最为敏感,也最容易受到损伤。因此本实验选择出生7 d 的新生雄性SD 幼鼠作为研究对象,此时大脑发育阶段相当于人类的新生儿期[8]。本研究采用连续3 d 75 mg/kg 氯胺酮腹腔注射来研究氯胺酮对发育期大脑皮质神经细胞凋亡的影响[2]。由于全身麻醉药易造成呼吸抑制,缺氧成为影响动物实验结果的重要因素。以往研究表明80 mg/kg 是单次注射氯胺酮而维持大鼠脉搏氧饱和度(SpO2)在正常范围的最高剂量[9]。同时在整个实验过程中我们严密监测幼鼠的呼吸情况,同时给予低流量氧气供应避免了因缺血、缺氧引起的神经细胞凋亡。
目前研究认为氯胺酮通过凋亡机制引起发育期大脑神经损伤[10]。凋亡发生受凋亡调控蛋白的控制,凋亡调控蛋白分为促凋亡蛋白和抗凋亡蛋白两大类。研究表明bcl-2 和Bax 蛋白水平高低与凋亡发生直接相关,凋亡的发生由bcl-2 与Bax 的比率决定[11,12]。Caspase-3 是凋亡发生的最终执行者,Bcl-2通过抑制线粒体细胞色素C 以及caspase-3 的活化产生抗凋亡作用[13]。Bax 作为线粒体膜上离子通道的重要组成成分,使细胞色素C 穿过线粒体膜,激活caspase-9,进一步激活caspase-3,最终导致细胞凋亡。
本研究采用连续3 d 75 mg/kg 氯胺酮腹腔注射引起发育期大鼠大脑皮质区TUNEL 阳性细胞的大量增加,证明了连续大剂量氯胺酮可引起发育期大鼠皮质区神经细胞凋亡的发生。17β 雌二醇与氯胺酮共处理组皮质区TUNEL 阳性细胞较氯胺酮组明显下降,说明17β 雌二醇可对氯胺酮导致的发育期大鼠大脑皮质区神经细胞凋亡产生保护作用。Western-blot 结果显示与对照组比较,氯胺酮组抗凋亡蛋白bcl-2 表达显著下降,促凋亡蛋白Bax 表达显著增加,Bcl-2/Bax 比值显著降低,cleaved-caspase-3表达显著增加。与氯胺酮组比较,17β 雌二醇与氯胺酮共处理组抗凋亡蛋白bcl-2 表达显著增加,Bax表达显著降低,Bcl-2/Bax 比值显著增加,cleavedcaspase-3 表达显著下降。以上结果充分表明17β雌二醇抑制氯胺酮引起发育期大鼠皮质神经细胞凋亡的机制可能与下调Bax、cleaved-caspase-3 和上调bcl-2 的蛋白水平,升高bcl-2/Bax 比值有关,但它对其他凋亡相关蛋白是否也有作用以及相关机制,还需要进一步研究。
总之,17β 雌二醇可对氯胺酮诱导的发育期大鼠大脑皮质区神经细胞凋亡产生保护作用,其机制可能与影响bc1-2 和Bax 蛋白水平有关。本研究进一步在动物整体证实了17β 雌二醇可对氯胺酮发育期神经毒性产生保护作用,为围术期应用17β 雌二醇防治氯胺酮对婴幼儿大脑产生神经损伤提供了更为直接的实验依据。
[1]李建立,梁 巍,吴红海,等.17β 雌二醇对氯胺酮所致神经元凋亡的影响[J].医药导报,2014,33(11):1434-1438.
[2]Huang L,Liu Y,Jin Wei,et al.Ketamine potentiates hippocampal neurodegeneration and persistent learning and memory impairment through the PKCgamma-ERK signaling pathway in the developing brain[J].Brain Res,2012,1476:164-171.
[3]Straiko MM,Young C,Cattano D,et al.Lithium protects against anesthesia-induced developmental neuroapoptosis[J].Anesthesiology,2009,110(4):862-868.
[4]Ponten E,Viberg H,Gordh T,et al.Clonidine abolishes the adverse effects on apoptosis and behaviour after neonatal ketamine exposure in mice[J].Acta Anaesthesiol Scand,2012,56(8):1058-1065.
[5]Arevalo MA,Ruiz-Palmero I,Scerbo MJ,et al.Molecular mechanisms involved in the regulation of neuritogenesis by estradiol:Recent advances[J].J Steroid Biochem Mol Biol,2012,131(1/2):52-56.
[6]Asimiadou S,Bittigau P,Felderhoff-Mueser U,et al.Protection with estradiol in developmental models of apoptotic neurodegeneration[J].Ann Neurol,2005,58(2):266-276.
[7]Lu LX,Yon JH,Carter LB,et al.General anesthesia activates bdnfdependent neuroapoptosis in the developing rat brain[J].Apoptosis,2006,11(9):1603-1615.
[8]Ikonomidou C,Bosch F,Miksa M,et al.Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain[J].Science,1999,283(5398):70-74.
[9]Waterman AE,Livingston A.Effects of age and sex on ketamine anaesthesia in the rat[J].British J Anaesthesia,1978,50(9):885-889.
[10]Wang C,Sadovova N,Fu X,et al.The role of the Nmethyl-D-aspartate receptor in ketamine-induced apoptosis in rat forebrain culture[J].Neuroscience,2005,132(4):967-977.
[11]Xie Z,Koyama T,Suzuki J,et al.Coronary reperfusion following ischemia:different expression of bcl-2 and bax proteins,and cardiomyocyte apoptosis[J].Jpn Heart J,2001,42(6):759-770.
[12]McClintock DS,Santore MT,Lee VY,et al.Bcl-2 family members and functional electron transport chain regulate oxygen deprivationinduced cell death[J].Mol Cell Biol,2002,22(1):94-104.
[13]Cory S,Huang DC,Adamas JM.The Bcl-2 family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590-8607.

