鹿舍内气载真菌浓度的检测及其粒谱分析
孟 凯,马藤菲,孙文静,柴同杰,刘建柱,马泽芳
(1.山东农业大学动物科技学院,山东泰安 271018;2.青岛农业大学动物科技学院,山东青岛 266109)
真菌气溶胶为真菌孢子和菌丝附着在固、液颗粒上悬浮在空气中形成,具有很宽的粒谱范围(1 μm~100 μm)[1]。畜舍环境可以不断的产生真菌气溶胶,并且借助空气介质扩散和传输,不仅污染环境,还会对畜禽以及畜禽饲养人员的健康构成威胁。真菌进入呼吸道后,还能不断的产生毒素,诱发一定的病变,引起感染、过敏、炎症和中毒反应[2]。其中,芽枝霉(Cladosporium)、链格孢(Alternaria)、黑附球菌(Epicoccum nigrum)以及灰葡萄孢(Botrytis cinerea)等真菌孢子被认为是环境真菌气溶胶的主要构成(约90 %),而青霉(Penicillium)和曲霉(Aspergillus)孢子则比例较小[3]。
研究证实,养殖业的大规模发展已成为自然环境真菌污染的重要来源,而且真菌气溶胶在畜舍内会形成相对稳定的存在形式。虽然空气中微生物种类繁多,但在不同的环境、气象因素等条件下,空气中真菌的种群结构和浓度也具有很大的变化,不同的养殖环境和人类活动均会对环境中真菌的种类和组成水平产生影响。
特种经济动物养殖已成为我国畜牧业发展的重要方向之一,梅花鹿养殖业成为农业增收的重要途径,相关的环境健康问题也尤为重要。但目前国内梅花鹿养殖环境的真菌气溶胶的检测尚属空白。因此,本研究采集了山东5 个梅花鹿养殖舍的空气样本,对鹿舍养殖环境中真菌气溶胶微生物多样性及其粒径分布进行了检测,为阐明鹿舍养殖环境真菌的种群结构及其传播机制提供实验依据。
1 材料和方法
1.1 样品采集 在山东德州、临沂、泰安、济宁、淄博的5 个半封闭圈养梅花鹿舍(a~e)分别设点进行采样,每个养殖场采样5 个,采样高度距离地面50 cm,收集时间根据环境卫生状况在2 min~4 min。采样器选择国际标准的Andersen-6 级(A-F)采样器,空气流量为28.3 L/min,培养基为虎红氯霉素琼脂平板。
1.2 采样方法 无菌操作将平皿放入灭菌的Andersen 生物空气采样器中,将撞击器置于距离地面50 cm 高度,打开撞击器进气口,离开采样点2 m之外启动采样,设定采样时间;采样完毕取出采样平皿,封好并标记,迅速带回实验室进行真菌的培养鉴定。
1.3 真菌的培养与鉴定 采集样品置于25 ℃温箱中培养72 h,计算各级采样皿上真菌菌落数(cfu),为避免迟发菌落产生的误差,继续培养至第7 d 进行一次校正计数,所得结果即为真菌气溶胶粒子数。培养后的样品置于立体显微镜下观察,将形态不同的菌落进行计数和纯培养。分离纯化的真菌菌株,根据其生化特性,选择特定培养基进行培养,根据其菌落形态及真菌子实体形态特征(载孢体和分生孢子)进行鉴定。
1.4 真菌气溶胶浓度计算 以每m3空气中菌落形成单位数表示,计算公式为:cfu/m3=[Andersen-6 级采样器收集的菌落总数/28.3 L/m3×采样时间(min)]×1 000。
1.5 真菌气溶胶粒谱分析 采样器每一级的菌落数除以6 级总的菌落数即为各级所占的百分比。各采样点真菌气溶胶粒谱的特征以计数中值直径(CMD)代表。方法是将在采样点测定结果的各级百分比从F 级至A 级逐级累加,得出各级的累计百分率,再以各级累计百分率为横坐标和给定的各级有效截留粒子径(ECD)为纵坐标求出直线回归方程,在x 为50 时的y 值即为CMD 值。真菌粒径分布的离散度以几何标准差(GSD)表示,即以直线回归方程中x 为84.13 时的y 值除以CMD 值[4]。
2 结果
2.1 真菌气溶胶浓度的各级分布 利用国际标准的Andersen-6 级空气微生物采样器对山东省5 处鹿舍内进行气载真菌的检测。调查结果显示,所采集的5 个鹿舍真菌粒谱分布高峰均在D 级(2.1 μm~3.3 μm),其次为C 级,而F 级真菌浓度最小(表1)。5 个鹿舍气载真菌浓度统计结果显示,最小值为0.69×103cfu/m3(鹿舍b),最大值则为2.32×103cfu/m3(鹿舍d)(表2),所以5 个鹿舍气载真菌的浓度范围在0.69 cfu/m3~2.32×103cfu/m3。
2.2 真菌气溶胶浓度与环境因素的关系 对真菌气溶胶浓度与鹿舍环境进行分析表明,在调查的5个半封闭圈养的鹿舍中,饲养密度最大的鹿舍真菌浓度最高,达到1.61×103cfu/m3;而且在其他因素基本一致的情况下,湿度对环境真菌气溶胶浓度也具有一定的影响,湿度越大真菌浓度越高,而温度对于真菌浓度的影响则不明显(表3)。
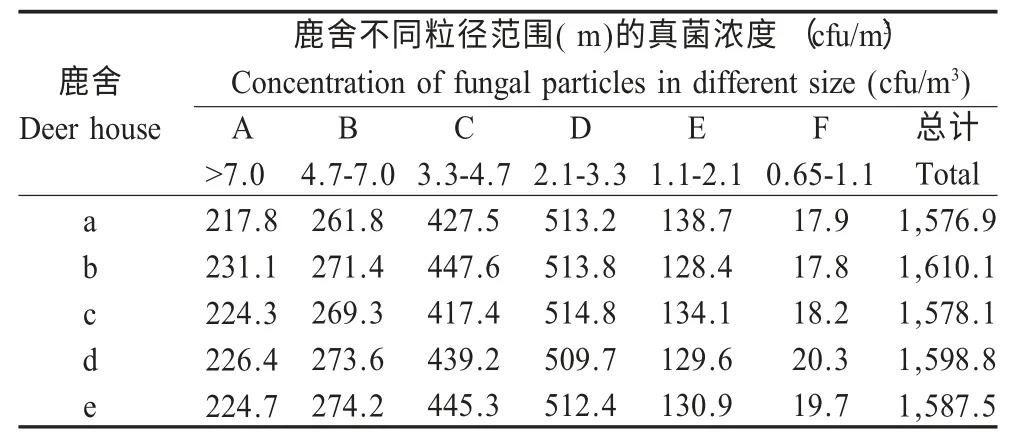
表1 鹿舍不同粒径的真菌浓度Table 1 The concentration of fungal particles in sampling environment
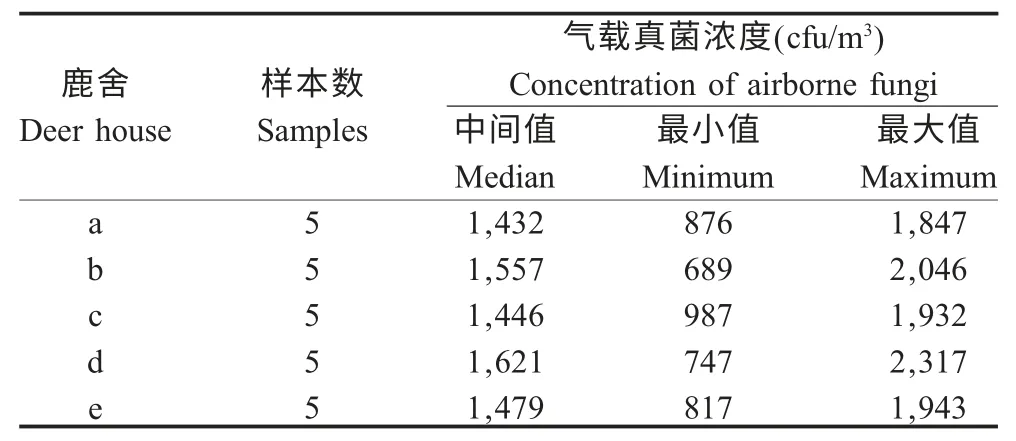
表2 鹿舍气载真菌浓度Table 2 The concentration of airborne fungi
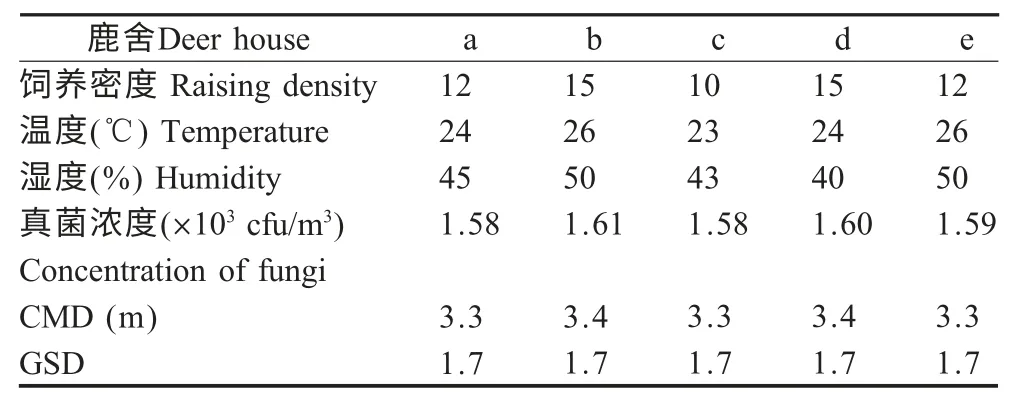
表3 鹿舍的环境因素与真菌气溶胶的浓度及粒谱特征Table 3 Environmental index,concentration of fungi and the fungal particles of the sampling deer houses
2.3 真菌气溶胶微生物多样性 在调查的5 个鹿舍中,共采集15 个样品(90 个平皿),对其检测到的活性真菌进行分析,结果显示活性真菌菌落共588 个,按属级标准分离纯化共鉴定出14 个属,其中优势种群为链格孢属(18.5 %)、青霉属(18.0 %)、枝孢霉属(9.4 %)、链孢菌属(7.1 %)、木霉属(6.6 %)、酵母菌属(5.8 %)、拟青霉属(5.4 %)、曲霉属(5.1 %),而弯孢霉属、根霉属、蠕孢属、葡萄孢属、红酵母属、帚霉属所占比例则较小(表4)。对不同鹿舍真菌cfu值分析表明,饲养密度大、湿度大的鹿舍真菌cfu值也较高。
3 讨论
养殖环境的清洁度,往往与动物疫病具有直接且紧密的联系。空气作为畜禽生活环境的重要媒介,气溶胶同样扮演着非常重要的角色,多种疫病病原可以借助气溶胶在畜禽种群之间进行传播,不仅危害畜禽生产,同样对人的健康也构成威胁。有研究证实,以雏火鸡为实验对象,每克肺培养出2.2×106cfu 真菌的火鸡,5 d 内即全部死亡,低于该数值者,发病延迟,死亡率降低[4]。而吸入肺的真菌浓度与环境真菌浓度存在一定的相关关系,即畜禽生活环境的真菌浓度可以为真菌病的发生提供预警资料。
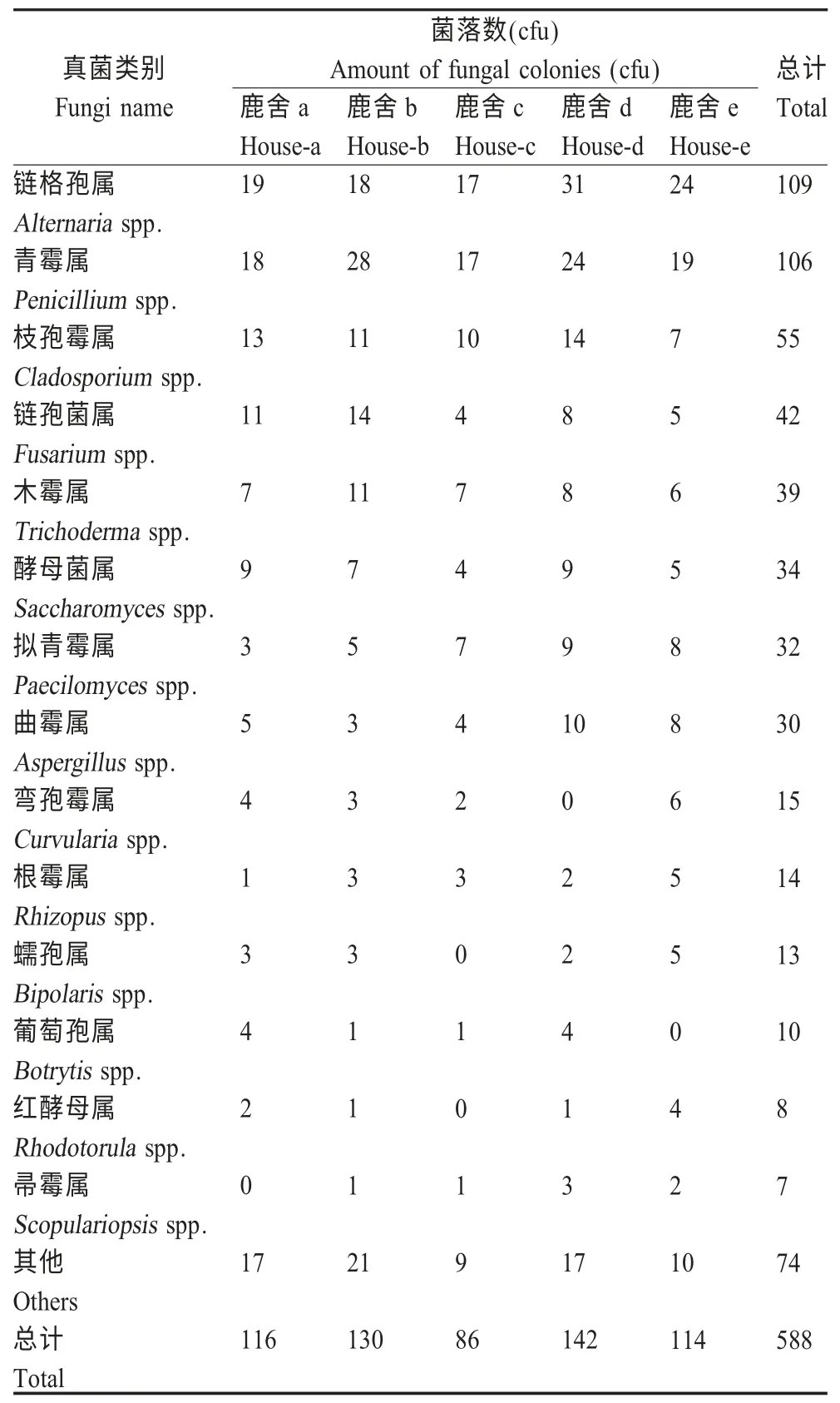
表4 鹿舍真菌气溶胶的优势种群及其分布Table 4 Distribution of the dominant fungi in the sampling deer houses
畜禽环境真菌气溶胶的浓度受到诸多因素的影响,如气候、光照、卫生条件、动物生活习性、动物舍结构等[5],本研究主要就可人为控制的动物饲养密度、温度、湿度几方面进行分析。研究表明,在其他因素相近的前提下,饲养密度越大,湿度越大,真菌气溶胶的密度也随之增大,与其他相关报道一致[6]。这也从另一侧面表明,通过人为地降低饲养密度,适宜的降低湿度,加强鹿舍的通风可以改善养殖环境的真菌气溶胶浓度,降低感染真菌病的风险。
不同粒径的气溶胶粒子进入和沉积畜禽以及人的呼吸系统的位置存在差异。粒径为20 μm~30 μm的可以进入鼻腔和上呼吸道并沉积在支气管,粒径在6 μm~10 μm 的可沉积在小支气管,而粒径在1 μm~5 μm 的气溶胶粒子则可进入肺的深部[7]。本研究中所采用的Andersen 采样器收集的真菌气溶胶粒径范围为0.3 μm~15 μm,该范围粒子对人和畜禽危害较大,尤其是粒径低于5 μm 的粒子,沉积率高达90 %。本研究在5 个鹿舍采集的样本CMD值为3.3 μm~3.4 μm,均比一般的细菌粒径小,原因可能是真菌粒子以单个孢子气溶胶的形式飘散在空气中;GSD 值均为1.7,表明粒径分布的离散度较大,预示真菌粒子很容易进入呼吸道深部,危害也更大[8]。
在本次调查中,共分离鉴定出真菌类别达14 个种属,表明鹿舍真菌气溶胶具有复杂的微生物多样性。在这些鉴定的真菌种类中,链格孢属、青霉属、枝孢霉属、链孢菌属等为优势真菌属,它们与真菌感染和真菌毒素中毒密切相关。比例最大的链格孢属,可引起皮肤链格孢病、过敏性肺炎和哮喘等,其产生的链格孢毒素可能与食管癌有关;青霉属也可诱发青霉菌病,引起脑和肺部病变,产生的毒素可导致人和动物的真菌性中毒;此外,枝孢霉属部分种类可引起皮肤着色霉菌病以及系统性暗色丝孢霉病,曲霉属的某些种群可导致人和动物的曲霉菌病等[9-10]。不同真菌种群致病力存在一定差异,而这些种类的真菌气溶胶对于人和畜禽的危害尚需要进一步更为深入的研究。
[1]Bauer H,Kasper-Giebl A,M,et al.The contribution ofbacteria and fungal spores to the organic carbon content of cloud water,precipitation and aerosols[J].Atmos Res,2002,64(1):109-119.
[2]郑世英,张永良,智强,等.地下医院真菌气溶胶的形成及其危害[J].中华医院感染学杂志,2005,15(3):297-299.
[3]Fischer G,Dott W.Relevance of airborne fungi and their secondary metabolites for environmental,occupational and indoor hygiene[J].Arch Microbiol,2003,179(2):75-82.
[4]王雅玲.养殖环境真菌气溶胶及相关真菌毒素的检测[J].山东农业大学,2006,32(11):51-56.
[5]Pei-Chih W,Huey-Jen S,Chia-Yin L.Characteristics of indoor and outdoor airborne fungi at suburban and urban homes in two seasons[J].Sci Total Environ,2000,253(1-3):111-118.
[6]王雅玲,柴同杰,吕国忠,等.养殖环境真菌气溶胶的研究[J].家畜生态学报,2005,26:51-56.
[7]Shelton B G,Kirkland K H,Flanders W D,et al.Profiles of airborne fungi in buildings and outdoor environments in the United States[J].Appl Environ Microbiol,2002,68(4):1743-1753.
[8]O'Connor G T,Walter M,Mitchell H,et al.Airborne fungi in the homes of children with asthma in low-income urban communities:The Inner-City Asthma Study[J].J Allergy Clin Immunol,2004,114(3):599-606.
[9]Shin S H,Ponikau J U,Sherris D A,et al.Chronic rhinosinusitis:an enhanced immune response to ubiquitous airborne fungi[J].J Allergy Clin Immunol,2004,114(6):1369-1375.
[10]Su Huey-jen,Wu Pei-chih,Chen Hsiu-ling,et al.Exposure assessment of indoor allergens,endotoxin,and airborne fungi for homes in southern Taiwan[J].Environ Res,2001,85(2):135-144.

