猪繁殖与呼吸综合征病毒Nsp9 与宿主CALM2 基因编码钙调蛋白的相互作用研究
胡 亮,郭东伟,李江南,尹曼曼,黄 丽,翁长江
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物病原监测与分子流行病学团队,黑龙江 哈尔滨 150001)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)为一类高度接触性传染病,以引起严重繁殖障碍、呼吸道疾病、哺乳仔猪死亡率增加和持续继发性感染为主要特征,对目前养猪业构成了严重威胁[1]。该病病原为PRRS 病毒(PRRSV),其基因组为单股正链RNA,至少含有10个开放阅读框(ORF),编码8 个结构蛋白和14 个非结构蛋白[2]。其中,非结构蛋白Nsp9 为该病毒RNA依赖的RNA 聚合酶(RNA-dependent RNA polymerase,RdRp)。动脉炎病毒复制转录复合体(RTC)体外分离实验表明Nsp9 可能同多个病毒蛋白和宿主因子一起组装形成膜附着的RTC,在病毒复制过程中发挥关键性的作用[3]。因此,筛选并研究与Nsp9 相互作用的宿主蛋白对了解Nsp9 功能及PRRSV 复制机理具有重要意义。
本研究采用酵母双杂交方法,以Nsp9 为诱饵蛋白,从实验室构建的猪肺泡巨噬细胞(PAM)酵母表达cDNA 文库中筛选与其相互作用的宿主蛋白,结果鉴定出宿主CALM2(Calmodulin 2)基因编码的钙调蛋白(CaM)与Nsp9 存在相互作用,为进一步深入研究PRRSV 复制和致病的分子机制提供参考。
1 材料和方法
1.1 病毒株、菌株、质粒、细胞和酵母表达文库PRRSV HuN4 株、E.coli DH5α 感受态、pFlag-CMV4和pCMV-HA 真核表达载体、HEK293 细胞、PAM细胞cDNA 及其酵母表达文库均由本实验室保存;酵母表达载体pGBKT7(pBD)、pGADT7(pAD)及酵母菌株Y2H 和Y187 均购自Clontech 公司。
1.2 主要试剂 酵母质粒提取试剂盒购自OMEGA公司;酵母YPDA、SD/-Trp、SD/-Leu、SD/-Trp-Leu(SD/-2)、SD/-His-Trp-Leu-Ade(SD/-4)等培养基和Aba、X-α-Gal、酵母转化试剂盒等均购自Clontech 公司;TRIzol 试剂及RT-PCR 试剂盒购自Invitrogen 公司;质粒提取试剂盒和胶回收试剂盒购自QIAGEN 公司;限制性内切酶和T4 DNA 连接酶购自NEB 公司;抗Flag 标签单克隆抗体(MAb)购自Abmart 公司;抗HA 标签MAb 购自Cell Signaling Technology(CST)公司;FITC 标记羊抗鼠IgG(IgG-FITC)和羊抗兔IgG-TRITC 购自北京中杉金桥生物技术有限公司;抗Flag(M2)琼脂糖珠、羊抗兔IgG-HRP、4',6'-二脒基-2-苯基吲哚(DAPI)均购自Sigma-Aldrich 公司;Super ECL 超敏发光液购自北京普利莱基因技术有限公司。
1.3 真核重组表达质粒的构建 提取PRRSV HuN4株RNA 并反转录制备cDNA,以其为模板通过RT-PCR 扩增nsp9 基因,分别克隆于pFlag-CMV4和pBD 载体中,构建重组质粒pFlag-nsp9 和pBDnsp9;根据GenBank 中猪CALM2(XM_003125163)的核苷酸序列设计引物,以PAM 细胞cDNA 为模板扩增CALM2 基因,分别克隆于pCMV-HA 和pAD载体中,构建重组质粒pHA-CALM2 和pADCALM2(相关引物序列见表1)。

表1 实验所用的引物Table 1 Primers used in this study
1.4 诱饵蛋白的自激活活性和毒性检测 将诱饵重组质粒pBD-nsp9 和空载体pAD 共转化Y2H 酵母菌株,分别涂于SD/-2、SD/-4、SD/-4/X-α-Gal/Aba(SD/-4/X/A)平板,培养3 d~5 d 后观察并比较各种平板上菌落的生长情况。pAD-T 与pBD-p53 共转化作为阳性对照,pAD-T 和pBD-Lam 共转化作为阴性对照。
1.5 酵母双杂交试验 将pBD-nsp9 转化后的Y2H酵母菌培养于SD/-Trp 琼脂培养基,挑取形态规则的单菌落接种于SD/-Trp 液体培养基,随后与PAM细胞cDNA 酵母表达文库进行杂交。收集、重悬菌体,涂布于SD/-4 平板。再将生长的单克隆菌体接种至SD/-4/X/A 平板,进行另一轮筛选。最后,挑选蓝色阳性克隆进行菌落PCR、测序和NCBI blast分析,以确定捕获的宿主蛋白。
1.6 酵母回返验证试验 将pBD-nsp9 与pAD-CALM2共转化感受态Y2H 酵母菌,分别涂于SD/-2、SD/-4、SD/-4/X/A 平板,观察平板上菌落生长情况。pBD空载体与pAD-T 共转化作为阴性对照,pBD-p53 与pAD-T 共转化作为阳性对照,pBD 空载体与pADCALM2 共转化作为自激活对照。
1.7 免疫共沉淀(Co-IP)试验 将pFlag-nsp9 和pHACALM2 分别与pCMV-HA 空载体共转染或pFlagnsp9 和pHA-CALM2 共转染HEK293 细胞,收集并裂解细胞,低温高速离心后收集上清。取部分细胞上清与抗Flag(M2)琼脂糖珠孵育,然后收集琼脂糖珠并利用细胞裂解缓冲液进行清洗,以去除结合不牢的杂蛋白;另一部分细胞上清作为对照。蛋白样品经变性处理后进行SDS-PAGE 电泳分离,进一步湿转至聚偏二氟乙烯膜。膜经过脱脂乳封闭后,分别以兔源抗HA 标签或抗Flag 标签MAb 为一抗,以羊抗兔IgG-HRP 为二抗,于暗室通过X 光片曝光进行Co-IP 试验。
1.8 激光共聚焦试验 将pFlag-nsp9 和pHA-CALM2共转染HEK293 细胞,细胞依次经多聚甲醛固定,Triton X-100 透膜处理,血清封闭,然后分别以鼠源抗Flag 标签MAb(1∶200)和兔源抗HA 标签MAb(1∶200)为一抗,以羊抗鼠IgG-FITC(1∶100)和羊抗兔IgG-TRITC(1∶100)为二抗,经DAPI 染色后,利用激光共聚焦显微镜观察细胞并拍照。
2 结果
2.1 酵母双杂交筛选与Nsp9 蛋白相互作用的宿主蛋白 将诱饵重组质粒pBD-nsp9 与pAD 空载体共转化Y2H 酵母菌株,结果显示,重组菌不能够在SD/-4 和SD/-4/X/A 平板上生长,表明诱饵蛋白Nsp9无自激活活性。而SD/-2 平板上的菌落与对照组菌落的生长速度和状态无明显差别,表明Nsp9 的表达对酵母无明显毒性作用。将pBD-nsp9 诱饵质粒转化的Y2H 酵母菌和PAM 细胞cDNA 酵母表达文库进行杂交,筛选获得的阳性克隆经质粒提取、测序和NCBI blast 分析显示,共筛选到18 个阳性克隆所对应的序列均为CALM2 基因。
2.2 Nsp9 与CaM 在酵母体系中的相互作用 将pBD-nsp9 和pBD 空载体分别与pAD-CALM2 共转化至Y2H 酵母菌,并分别在SD/-2、SD/-4 和SD/-4/X/A 培养基上培养。以pBD-p53 和pAD-T 共转化作为阳性对照,pBD-Lam 和pAD-T 共转化作为阴性对照。结果显示,pBD-p53 和pAD-T 抗原共转的酵母菌均可在SD/-4 和SD/-4/X/A 培养基正常生长,而pBD-Lam 与pAD-T 抗原共转的酵母菌不能在SD/-4和SD/-4/X/A 培养基正常生长,表明阳性对照和阴性对照均成立。pBD-nsp9 与pAD 及pBD 与pADCALM2 分别共转的酵母菌均不能在SD/-4 和SD/-4/X/A 培养基上生长,表明Nsp9 和CaM 均无自激活现象。pBD-nsp9 与pAD-CALM2 共转化的酵母在SD/-2、SD/-4 和SD/-4/X/A 均能够正常生长,表明Nsp9 和CaM 在酵母中存在相互作用(图1)。
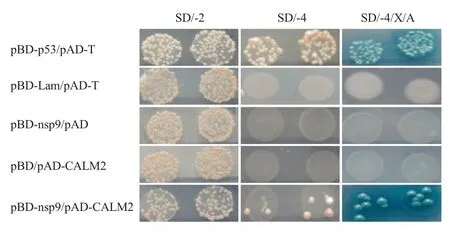
图1 酵母双杂交试验验证Nsp9 与CaM 的相互作用Fig.1 The interaction of Nsp9 and CaM was identified by Y2H
2.3 Co-IP 试验验证Nsp9 和CaM 的相互作用将pFlag-nsp9、pHA-CALM2 分别与pCMV-HA 共转染或pFlag-nsp9 与pHA-CALM2 共转染HEK293 细胞。对照样品(Input)通过western blot 检测,结果表明CaM 和Nsp9 均正常表达。同时,Co-IP 结果显示,CaM 能够与Nsp9 共沉淀,表明Nsp9 和CaM存在特异性的相互作用(图2)。
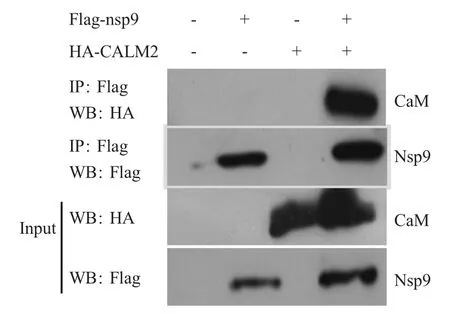
图2 Co-IP 试验验证Nsp9 与CaM 的相互作用Fig.2 The interaction of Nsp9 and CaM was confirmed by Co-IP
2.4 激光共聚焦试验验证Nsp9 与CaM 在HEK293细胞中的共定位 将真核表达质粒pFlag-nsp9 与pHA-CALM2 共转染HEK293 细胞,以研究Nsp9 和CaM 在HEK293 细胞中的定位情况。结果显示,Nsp9 和CaM 均表达在HEK293 细胞的细胞浆内,并呈现重叠分布(图3),表明Nsp9 和CaM 在HEK293细胞内存在共定位。
3 讨论
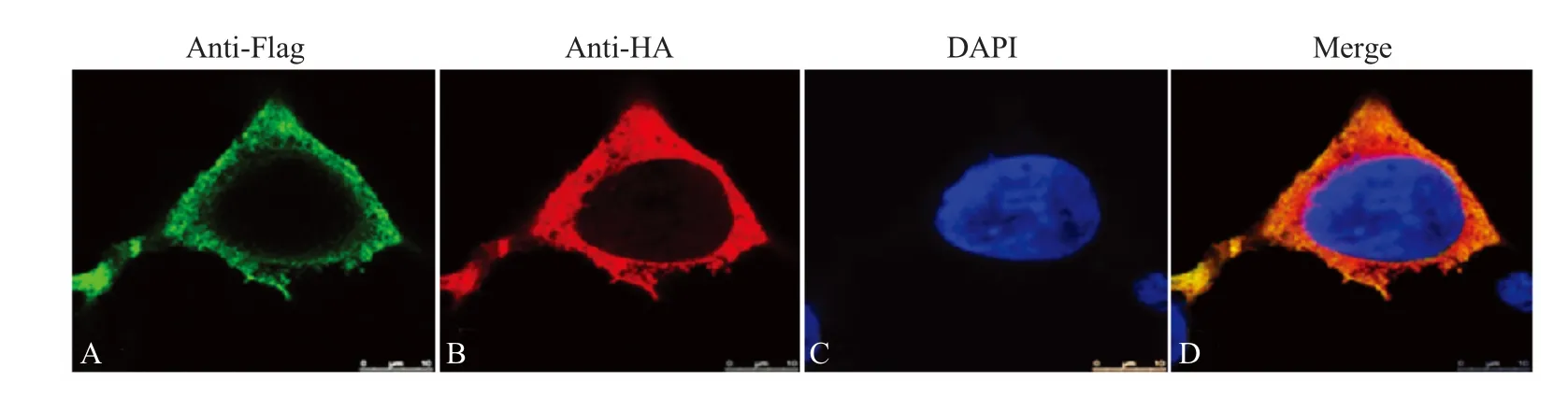
图3 激光共聚焦试验验证Nsp9 与CaM 的共定位Fig.3 Co-localization of Nsp9 and CaM in the cytoplasma of HEK293 cell
所有的正链RNA 病毒均编码RdRp,其作为关键的催化亚基与多个病毒蛋白和宿主因子共同参与病毒基因组的复制过程[4]。Li 等利用反向遗传操作平台逐一替换PRRSV 高致病株RvJXwn 和低致病株RvHB-1/3.9 的基因组片段后,发现Nsp9 和Nsp10两个基因共同决定了高致病PRRSV 的致病力和复制效率[5]。此外,siRNA 干扰Nsp9 的表达后可以显著抑制PRRSV 的复制[6]。表明Nsp9 作为PRRSV 的RdRp 对于病毒的复制和毒力非常关键。由于病毒复制过程需要宿主蛋白的参与,因而研究Nsp9 与宿主蛋白的相互作用非常重要。
本实验室前期研究发现宿主蛋白Annexin A2 与Nsp9 相互作用并有利于PRRSV 的复制[7];同时还发现宿主蛋白RACK1 与Nsp9 存在相互作用[8]。最近,宿主蛋白DDX5 和成视网膜细胞瘤蛋白也被证明可以与Nsp9 相互作用,并且参与调节PRRSV 的复制[9-10]。表明多个宿主蛋白能够与Nsp9 相互作用并参与调控PRRSV 复制过程。本研究以Nsp9 蛋白为诱饵,通过酵母双杂交系统从PAM 细胞酵母表达cDNA 文库中筛选到一个与其相互作用的新宿主蛋白-CaM,并进一步通过酵母回返试验和Co-IP 试验验证了这两个蛋白间的相互作用以及激光共聚焦试验证明两个蛋白在HEK293 细胞胞浆内存在共定位分布。
CaM 是真核细胞参与调节钙信号通路的关键蛋白。CaM 结合Ca2+后形成Ca2+/CaM 复合物,进而结合靶蛋白的自身抑制结构域,调节靶蛋白的生物学活性,参与诸如细胞分裂、新陈代谢、细胞骨架调节和信号转导等一系列基本的细胞生理过程[11]。哺乳动物中,CaM 分别由3 个处于不同染色体上具有自身独立启动子和内含子区的基因编码,即CALM1、CALM2 和CALM3。这3 个基因可以转录产生5 个5'UTR 或3'UTR 存在序列和长度差异的转录产物,但却均编码一个相同的具有149 个氨基酸的蛋白CaM[12]。同时,这些基因分别独立受到调控,相应的转录产物在不同的组织和病理条件下水平不一致。如关节软骨细胞CALM2 基因表达水平最高,并且CALM1 和CALM2 基因的高水平表达与骨关节炎的发生存在相关性[13];增生性畸形瘤细胞CALM3 基因表达量最高[14];退行性大细胞淋巴瘤中CALM2 基因表达量上调,并且在多种不同的癌细胞内,如乳腺癌,CaM 的表达量均上调,表明钙依赖性细胞内信号的改变可能与癌症的发生密切相关[15]。本研究结果表明CALM2 基因编码的CaM 与Nsp9存在相互作用,提示宿主细胞内的钙信号通路调节系统可能参与PRRSV 复制过程,但直接证据还有待于进一步的研究。
[1]Chand R J,Trible B R,Rowland R R.Pathogenesis of porcine reproductive and respiratory syndrome virus[J].Curr Opin Virol,2012,2:256-263.
[2]Han Ming-yuan,Yoo Dong-wan.Engineering the PRRS virus genome:updates andperspectives[J].Vet Microbiol,2014,174:279-295.
[3]van Hemert M J,de Wilde A H,Gorbalenya A E,et al.The in vitro RNA synthesizing activity of the isolated arterivirus replication/transcription complex is dependent on a host factor[J].J Biol Chem,2008,283:16525-16536.
[4]O'Reilly E K,Kao C C.Analysis of RNA-dependent RNA polymerase structure and function as guided by known polymerase structures and computer predictions of secondary structure[J].Virology,1998,252:287-303.
[5]Li Yan,Zhou Lei,Zhang Jia-long,et al.Nsp9 and Nsp10 contribute to the fatal virulence of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China[J].PLoS Pathog,2014,10:e1004216.
[6]Xie Jie-xiong,Zhou Han,Cui Jin,et al.Inhibition of porcine reproductive and respiratory syndrome virus by specific siRNA targeting Nsp9 gene[J].Infect Genet Evol,2014,28:64-70.
[7]Li Jiang-nan,Guo Dong-wei,Huang Li,et al.The interaction between host Annexin A2 and viral Nsp9 isbeneficial for replication of porcine reproductive and respiratory syndrome virus[J].Virus Res,2014,189:106-113.
[8]郭东伟,尹曼曼,张枫,等.猪繁殖与呼吸综合征病毒NSP9 蛋白与RACK1 蛋白相互作用的研究[J].中国预防兽医学报,2013,35:259-263.
[9]Zhao Shuang-cheng,Ge Xin-na,Wang Xiao-long,et al.The DEAD-box RNA helicase 5 positively regulates the replication of porcine reproductive and respiratory syndrome virus by interacting with viral Nsp9 in vitro[J].Virus Res,2015,195:217-224.
[10]Dong Jian-guo,Zhang Ning,Ge Xin-na,et al.The interaction of nonstructural protein 9 with retinoblastoma protein benefits the replication of genotype 2 porcine reproductive and respiratory syndrome virus in vitro[J].Virology,2014,464-465:432-440.
[11]Petri Kursula.The many structural faces of calmodulin:a multitasking molecular jackknife[J].Amino Acids,2014,46:2295-2304.
[12]Berchtold M W,Egli R,Rhyner J A,et al.Localization of the human bona fide calmodulin genes CALM1,CALM2,and CALM3 to chromosomes 14q24-q31,2p21.1-p21.3,and 19q13.2-q13.3[J].Genomics,1993,16:461-465.
[13]Mototani H,Iida A,Nakamura Y,et al.Identification of sequence polymorphisms in CALM2 and analysis of association with hip osteoarthritis in a Japanese population[J].J Bone Miner Metab,2010,28:547-553.
[14]Toutenhoofd S L,Foletti D,Wicki R,et al.Characterization of the human CALM2 calmodulin gene and comparison of the transcriptional activity of CALM1,CALM2 and CALM3[J].Cell Calcium,1998,23:323-338.
[15]Rust R,Visser L,van der Leij J,et al.High expression of calcium-binding proteins,S100A10,S100A11 and CALM2 in anaplastic large cell lymphoma[J].Br J Haematol,2005,131:596-608.

