结直肠癌组织E-cadherin表达及其与病理临床特征关系
王军 温达雄 黄秀凡 黄慧敏 温惠娟
结直肠癌组织E-cadherin表达及其与病理临床特征关系
王军 温达雄 黄秀凡 黄慧敏 温惠娟
目的探讨结直肠癌患者E钙粘蛋白(E-cadherin)的表达及其意义。方法免疫组化技术检测130例结直肠癌患者癌组织及30例癌旁正常组织E-cadherin的表达情况, 观察E-cadherin表达与患者病理临床特征间的关系。结果癌组织中E-cadherin的表达明显下降, 与癌旁正常组织比较,差异具有统计学意义(P<0.01);E-cadherin的低表达与发病部位、分化程度、淋巴结转移有关;与性别、年龄、浸润深度无关。结论E-cadherin蛋白低表达可能促进了结直肠癌的恶性进展及淋巴结的转移, 观察E-cadherin的表达情况, 有助于了解结直肠癌的恶性程度及判断预后。
E钙粘蛋白;结直肠癌;分化;转移
结直肠癌(colorectal cancer, CRC)包括结肠癌和直肠癌,是发病率和致死率较高的恶性肿瘤之一,2014年美国癌症协会(ACS)最新统计数据显示, 在癌症死亡中, 男性占8%, 女性占9%, 均排在第三位。2014年预计有160万新增癌症患者,结直肠癌位于所有人群恶性肿瘤发病率的第三位[1]。近期研究表明[2], 我国城乡人群结直肠癌发病率均呈上升趋势, 并预测我国结直肠癌新发病例仍将逐年增多。CRC的发生发展是一个多步骤、多环节、多基因参与的复杂过程, E-cadherin是一种钙依赖性细胞粘附分子, 存在于正常上皮细胞中以维持组织结构的完整性, E-cadherin的下调与肿瘤的浸润、转移及预后密切相关。本文观察E-cadherin在结直肠癌组织中的表达, 探讨其在结直肠癌的发生、浸润及转移的机制, 发展过程中的作用。
1 资料与方法
1.1 一般资料 收集河源市人民医院2011年1月1日~2013年12月31日病历资料完整的结直肠癌手术切除标本共130例, 取癌旁正常组织作为对照(30例), 标本均经病理检查确诊。所有患者术前均未接受任何治疗。
1.2 实验方法 所有标本常规取材, 经10%中性福尔马林固定, 石蜡包埋,4 μm厚连续切片, 贴于用多聚赖氨酸处理的玻片上,60℃烘烤4 h备用。免疫组化标记采用S-P法, 常规石蜡切片脱蜡水化,3%过氧化氢溶液, 室温下孵育10 min,以灭活内源性过氧化物酶, 高压锅内进行高温抗原修复, 每张切片滴加抗E-cadherin(即用型)、Ki-67(即用型)抗体,4℃冰箱孵育过夜, PBS冲洗, 用PBS代替一抗做阴性对照, 滴加二抗, 室温30 min, DBA显色, 苏木素复染, 常规脱水、透明、干燥、封片。E-cadherin鼠抗人单克隆抗体、Ki-67及其他免疫组化试剂均购自广州安必平医药科技有限公司。
1.3 结果判读 标本低倍镜(×100)下选取具有代表性阳性染色视野, 每张切片选择观察5个高倍(×400)视野, 每视野100个细胞, 计数阳性细胞百分数及染色强度, 取平均值。E-cadherin染色结果采用半定量积分法, 阳性表达为细胞膜和(或)细胞浆呈棕黄色颗粒着色。阳性细胞数:0分(阳性率≤5%),1分(6%~25%),2分(26%~50%),3分(51%~75%),4分(>75%);染色强度依次为:0分(无色),1分(淡黄色),2分(棕黄色),3分(棕褐色);两者乘积, ≤3分为阴性(-),>3分为阳性(+)。
1.4 统计学方法 采用SPSS17.0统计学软件对数据进行统计分析。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 临床病理特征 收集病历资料完整的结直肠癌手术患者130例, 其中男79例, 女51例;男性最小年龄29岁, 最大年龄96岁, 平均年龄66.13岁;女性最小年龄27岁, 最大年龄88岁, 平均年龄64.63岁。发病部位及淋巴结转移统计显示:回盲部12例, 升结肠9例, 结肠肝曲2例, 横结肠7例, 降结肠3例, 直乙交界5例, 乙状结肠27例(以上各部位淋巴结转移共12例), 直肠65例(淋巴结转移16例)。总体转移率为21.54%(28/130), 其中直肠癌转移率占转移总数的57.14%(16/28)。分化程度与淋巴结转移关系显示:高分化6例, 0例转移;中分化88例,15例转移, 转移率为17.05%(15/88);低分化36例,13例转移, 转移率为36.11%(13/36), 其中低分化以粘液腺癌为主要类型。
2.2 结直肠癌组织中E-cadherin的表达情况 结果显示E-cadherin在癌旁正常组织中表达率为93.33%, 而在结直肠癌组织中表达为40.00%, 差异具有统计学意义(χ2=27.733, P<0.01), 癌组织中E-cadherin的表达明显下降。见表1。
2.3 结直肠癌组织中E-cadherin的表达与病理临床特征关系 E-cadherin阳性蛋白表达率与患者的性别(χ2=0.264, P>0.05)、年龄(χ2=1.901, P>0.05)及肿瘤的浸润深度(χ2=0.513, P>0.05)无关;与肿瘤的部位(χ2=6.282, P<0.01)、淋巴结转移(χ2=8.024, P<0.05)有关;高、中、低分化各组E-cadherin的表达总体比较, 差异无统计学意义(χ2=5.079, P>0.05), 而高+中分化组及中分化组与低分化组E-cadherin的表达差异具有统计学意义(χ2=4.668, P<0.05;χ2=4.949, P<0.05)。见表2。
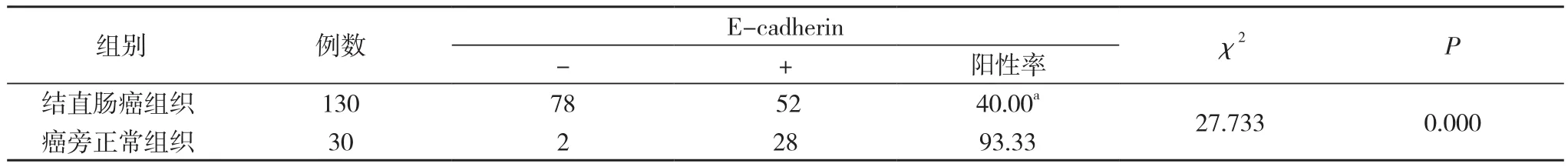
表1 结直肠癌组织中E-cadherin的表达情况(n, %)

表2 结直肠癌组织中E-cadherin的表达与病理临床特征关系(n, %)
3 讨论
E-cadherin是Takeichi最早发现的一种介导细胞间相互聚集的粘附分子, 定位于人染色体16q21.22, 由CDH1基因编码的跨膜糖蛋白, 分子量124 kDa, 在细胞外Ca2+的参与下, E-cadherin通过胞质连环素与细胞骨架蛋白相连, 介导上皮细胞之间及细胞与细胞外基质的粘附[3], 维持上皮组织结构完整性和极性。研究表明, 多种上皮源性肿瘤组织中, E-cadherin表达明显减少[4], 而且其表达下降与恶性肿瘤的分化、局部侵袭及淋巴结转移有关[5]。表1结果显示E-cadherin在正常结直肠组织中表达率为93.33%, 明显高于结直肠癌中的表达率40.00%(P<0.01), 结直肠癌组织中E-cadherin的表达较癌旁正常组织明显下降, 与Karamitopoulou等[6]的研究结果一致。推测结直肠癌组织E-cadherin表达明显减少可能与结直肠癌的发生发展密切相关。
临床病理资料统计显示, E-cadherin与患者性别、年龄、肿瘤浸润深度无关, 而与发病部位有关(χ2=6.282, P<0.01)。直肠占50%(65/130), 是结直肠癌发病的主要部位, 这与珠珠等[7]对昆明地区结直肠癌患者调查结果较一致。有关直肠发病部位E-cadherin低表达(29.23%)的机制有待进一步研究。
高、中、低分化各组E-cadherin的表达总体比较差异无统计学意义(χ2=5.079, P>0.05), 而高+中分化组及中分化组与低分化组E-cadherin的表达差异均有统计学意义(P<0.05), E-cadherin的表达与肿瘤的分化程度显著相关。E-cadherin在结直肠癌的表达较正常组织明显减少, 而且随着肿瘤分化程度下降(恶性程度上升)、淋巴结转移, 表达逐渐降低, 表明E-cadherin表达减少使同种细胞失去接触抑制及相互粘连减弱, 浸润和转移能力上升, 导致肿瘤细胞的侵袭性生长与转移, 促进了肿瘤的恶性进展。
在伴有淋巴结转移的28例结直肠癌中E-cadherin明显低表达, 其阳性表达率仅为21.43%, 统计结果显示, 结直肠癌E-cadherin蛋白表达与淋巴结转移呈显著相关(χ2=8.024, P<0.05)。提示E-cadherin的低表达与结直肠癌的淋巴转移密切相关。其原因可能为癌细胞E-cadherin表达明显减少,细胞间及细胞与基质间相互粘附能力减弱, 瘤细胞容易从原发灶脱落和游走, 进而引起肿瘤细胞淋巴结转移。因此, 检测E-cadherin蛋白表达可能为判断结直肠癌是否发生淋巴结转移及判断预后提供参考指标。
综上所述, E-cadherin蛋白低表达可能促进了结直肠癌的恶性进展及淋巴结的转移, 观察E-cadherin的表达情况,可有助于了解结直肠癌的恶性程度及判断预后。
[1]Trabulo D, Ribeiro S, Martins C, et al. Metabolic syndrome and colorectal neoplasms: An ominous association. World J Gastroenterol,2015,21(17):5320-5327.
[2]代珍, 郑荣寿, 邹小农, 等. 中国结直肠癌发病趋势分析和预测. 中华预防医学杂志,2012,46(7):598-603.
[3]Tinkle CL, Lechler T, Pasolli HA, et al. Conditional targeting of E-cadherin in skin:insights into hyperproliferative and degenerative responses. Proc Nat1 Acad Sci USA,2004,101(2):552-557.
[4]Bezdekova M, Brychtova S, Sedlakova E, et al. Analysis of snail-1, e-cadherin and claudin-1 expression in colorectal adenomas and carcinomas. Inter JMole Sci,2012,13(2):1632-1643.
[5]Nakamoto K, Nagahara H, Maeda K, et al. Expression of E-cadherin and KRAS mutation may serve as biomarkers of cetuximabbased therapy in metastatic eolorectal cancer. Oncol Lett,2013,5(4):1295-1300.
[6]Karamitopoulou E, Zlobec I, Patsouris E, et al. Loss of E-cadherin independently predicts the lymph node status in colorectal cancer. Pathology,2011,43(2):133-137.
[7]珠珠, 黄鉴, 李文亮, 等.1628例大肠癌临床发病特点及发病趋势分析. 昆明医科大学学报,2013(10):84-87.
Expression of E-cadherin in colorectal cancer tissue and its relationship with pathological clinical characteristics
WANG Jun, WEN Da-xiong, HUANG Xiu-fan, et al. Department of Pathology, Heyuan City People’s Hospital, Heyuan517000, China
ObjectiveTo investigate expression of E-cadherin in colorectal cancer patients and its significance.MethodsImmunohistochemical technique was applied to detect expression of E-cadherin in130 colorectal cancer tissue and30 normal tissue near cancer. Relationship between expression of E-cadherin and pathological clinical characteristics was observed.ResultsExpression of E-cadherin decreased remarkably in cancer tissue, and it had statistically significant difference comparing with that in normal tissue near cancer (P<0.01). Low expression of E-cadherin was correlated with lesion position, degree of differentiation and lymphatic metastasis, and it had no correlation with gender, age and infiltration depth.ConclusionLow expression of E-cadherin may accelerate malignant progress and lymphatic metastasis of colorectal cancer. Thus, observation of expression of E-cadherin is helpful for understanding severity and judging in colorectal cancer.
E-cadherin; Colorectal cancer; Differentiation; Metastasis
10.14164/j.cnki.cn11-5581/r.2015.15.007
2015-04-14]
517000 河源市人民医院病理科

