血小板衍生生长因子对失血性休克大鼠器官功能的保护作用
蓝 丹,朱 娱,彭小勇,刘良明,李 涛 (第三军医大学大坪医院野战外科研究所二室,创伤、烧伤与复合伤国家重点实验室,重庆 400042)
血小板衍生生长因子对失血性休克大鼠器官功能的保护作用
蓝丹,朱娱,彭小勇,刘良明,李涛(第三军医大学大坪医院野战外科研究所二室,创伤、烧伤与复合伤国家重点实验室,重庆 400042)
[摘要]目的观察PDGF对失血性休克大鼠存活时间、存活率、血流动力学指标、器官灌注和线粒体功能的影响。方法实验分为两部分,第1部分观察PDGF对休克动物存活率、存活时间、血流动力学的影响,第2部分观察PDGF对组织血流量和线粒体功能的影响。实验动物随机分为6组,休克对照组、LR组及PDGF 1、3.5、7、15 μg/kg组,其中PDGF给药组分别在2倍失血量的LR中加入PDGF 1、3.5、7、15 μg/kg进行输注。结果与LR组相比,PDGF各剂量组均能不同程度地提高休克大鼠的存活时间及存活率,改善血流动力学指标LVSP、±dp/dtmax,改善肝、肾血流量和线粒体功能,其中以PDGF 3.5 μg/kg剂量效果最好。结论PDGF对急性休克状态器官功能有明显的保护作用,其机制可能与其改善血流动力学指标、组织血流量和线粒体功能有关。
[关键词]PDGF;存活率;血流动力学;线粒体活性
失血性休克常发生于严重创伤、手术意外等引起的急性大量失血后,约1/3的创伤患者死于入院前失血性休克[1],其中发生在创伤后24 h内的致死率高达50%[2]。因此,寻找有效的抗休克治疗药物具有重要意义。血小板衍生生长因子(platelet-derived growth factor,PDGF)是细胞因子家族中的重要成员,既往研究报道PDGF作为血管活性药物Rac1的激动剂,对休克血管具有保护作用[3],但PDGF是否有抗休克作用,目前尚未见相关报道。为此,本实验采用失血性休克大鼠模型,观察PDGF对动物的存活情况、血流动力学和重要器官血流灌注及线粒体功能的影响。
1材料与方法
1.1实验动物及分组
SD大鼠96只,雌雄各半,体质量(230±25) g,由第三军医大学第三附属医院实验动物中心提供。动物禁食过夜,自由饮水,实验时采用3%戊巴比妥钠麻醉,行左侧股动脉、股静脉插管用于血压检测及液体输注。实验动物分为6组:休克对照组(SHK组)、乳酸林格液组(LR组)、PDGF 1 μg/kg、3.5 μg/kg、7 μg/kg和15 μg/kg组。休克对照组经放血后使大鼠血压降至40 mmHg,维持2 h;LR组在休克后输注2倍失血量LR,PDGF各剂量组在2倍失血量的LR中加入相应剂量的PDGF,输注速度为20 mL/h。
1.2检测大鼠存活情况和血流动力学指标
每组16只动物,行右颈动脉插管,观察左心室收缩压、左心室压力上升或下降最大速率。在休克前(B)、休克2 h(E)、复苏后1 h和复苏后2 h分别测动物的血流动力学指标,包括平均动脉压(mean arterial blood pressure,MAP)、左心室收缩压(left in traventricular systolic pressure,LVSP)、左心室压力上升或下降最大速率(the maximal change rate of left intraventicular pressure,±dp/dtmax),测量结束后结扎血管,缝合伤口,放回观察笼,记录存活时间。
1.3检测大鼠肝肾组织血流量和线粒体功能
实验检测时间点同前,每组每个时间点取8只动物。用激光多普勒组织血流量测定仪(Periflux system 5 000,Stockholm)的激光探针刺入肝、肾组织下约0.5 cm,测定器官血流量。然后活杀大鼠,取肝、肾组织各0.5 g用于测定线粒体功能。线粒体提取采用我室的常用方法[4],主要步骤包括将肝、肾组织置于冰的分离液中,进行组织匀浆、离心,收取线粒体,测定线粒体浓度,采用溶氧仪(MT200,Strathkelvin)测定线粒体功能。待30 ℃的测定介质平稳后注入线粒体悬液,当氧浓度曲线的斜率稳定以后(1态呼吸),注入0.5 mol/L苹果酸钠和0.5 mol/L谷氨酸钠的混合液80 μl,当氧浓度曲线再次出现稳定的斜率以后(4态呼吸),注入400 nmol/L ADP 50 μl,出现3态呼吸,待ADP完全消耗后线粒体又恢复到4态呼吸,分别测定加入ADP(3态呼吸)与ADP耗竭后(4态呼吸)的氧气消耗率,计算呼吸控制率(呼吸控制率=3态呼吸耗氧率/4态呼吸耗氧率)。
1.4统计学处理
2结果
2.1失血性休克大鼠的存活时间与存活率
休克对照组平均存活时间仅为(4.16±6.25)h,LR复苏可轻度延长休克大鼠存活时间,平均存活时间为(9.46±9.5)h,存活率为25%。与LR组相比,PDGF输注显著提高了存活时间和存活率,其中PDGF 3.5 μg/kg组效果最好,24 h平均存活时间为(19.09±9.24)h,存活率为75%(图1)。
2.2失血性休克大鼠血流动力学指标的变化
失血性休克后,大鼠LVSP明显低于休克前,LR复苏后LVSP无明显改善,输注PDGF后LVSP有不同程度改善,以PDGF 3.5 μg/kg效果最为显著。休克后大鼠的±dp/dtmax均明显降低,输注含不同浓度PDGF的LR液体后,±dp/dtmax有不同程度升高,其中PDGF 3.5 μg/kg组在输液后1 h增加尤为明显,显著高于LR组(图2)。
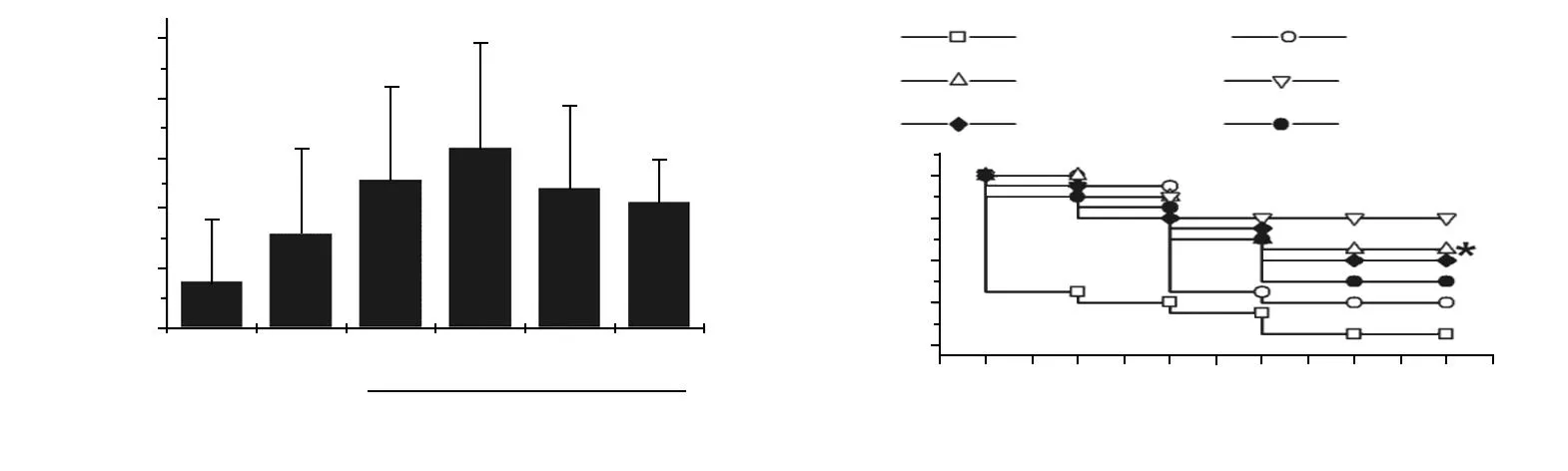
a:存活时间;b:存活动物数;*:与SHK组比较,P<0.05;#:与SHK组比较,P<0.01

a:LVSP;b:+dp/dtmax;c:-dp/dtmax;*:与LR组比较,P<0.05;#:与LR组比较,P<0.01
2.3失血性休克大鼠器官血流量的变化
失血性休克后,大鼠肝、肾血流量较休克前明显降低,LR复苏对肝、肾血流量无改善作用,不同浓度的PDGF输注对肝、肾血流量有显著改善,其中PDGF 1、3.5、7 μg/kg组的肝、肾血流量明显高于LR组,以PDGF 3.5 μg/kg效果最好(图3)。
2.4失血性休克大鼠器官线粒体功能的变化
失血性休克后,大鼠的肝、肾线粒体功能明显降低,单用LR复苏无明显改善,而不同浓度的PDGF复苏对肝、肾线粒体功能均有显著的改善作用(P<0.05),见图4。
3讨论
血小板衍生生长因子(PDGF)是细胞因子家族中的一个重要成员,广泛存在于组织和细胞中,包括平滑肌细胞和内皮细胞[5]。在以往的研究中,人们主要关注PDGF在伤口愈合和慢性疾病治疗中的作用,例如Judith及Yan等分别使用PDGF研究其对皮肤伤口的愈合,Mulder等研究其对糖尿病足的影响[6-10]。大量的研究结果证实PDGF在慢性难愈性伤口组织修复中起着重要作用[5-8]。我们通过前期研究,发现小剂量PDGF(20 ng/mL)作为血管活性药物Rac1的激动剂,对休克血管具有保护作用[3]。国内外其他学者的研究结果也证实,浓度小于20~30 ng/mL的PDGF可激活Rac1[11-12]。然而,PDGF是否对其他器官也具有类似的保护作用,尚需要进一步研究来证实。
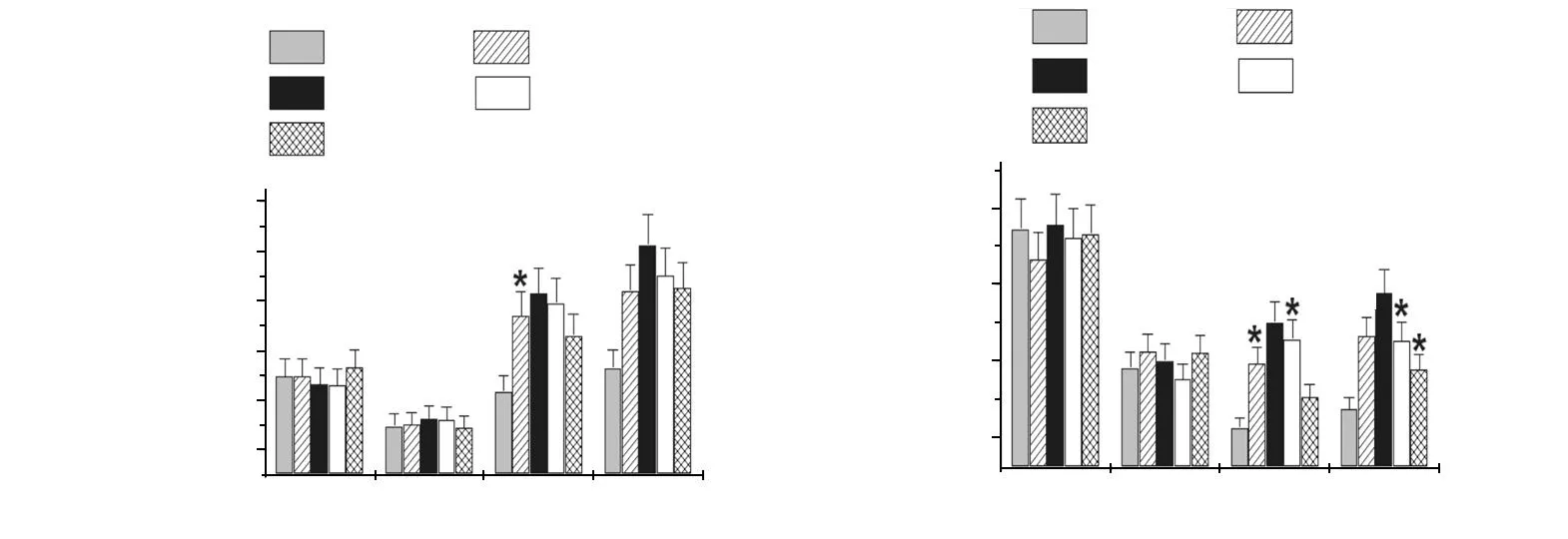
a:肝血流量;b:肾血流量;*:与LR组比较,P<0.05;#:与LR组比较,P<0.01
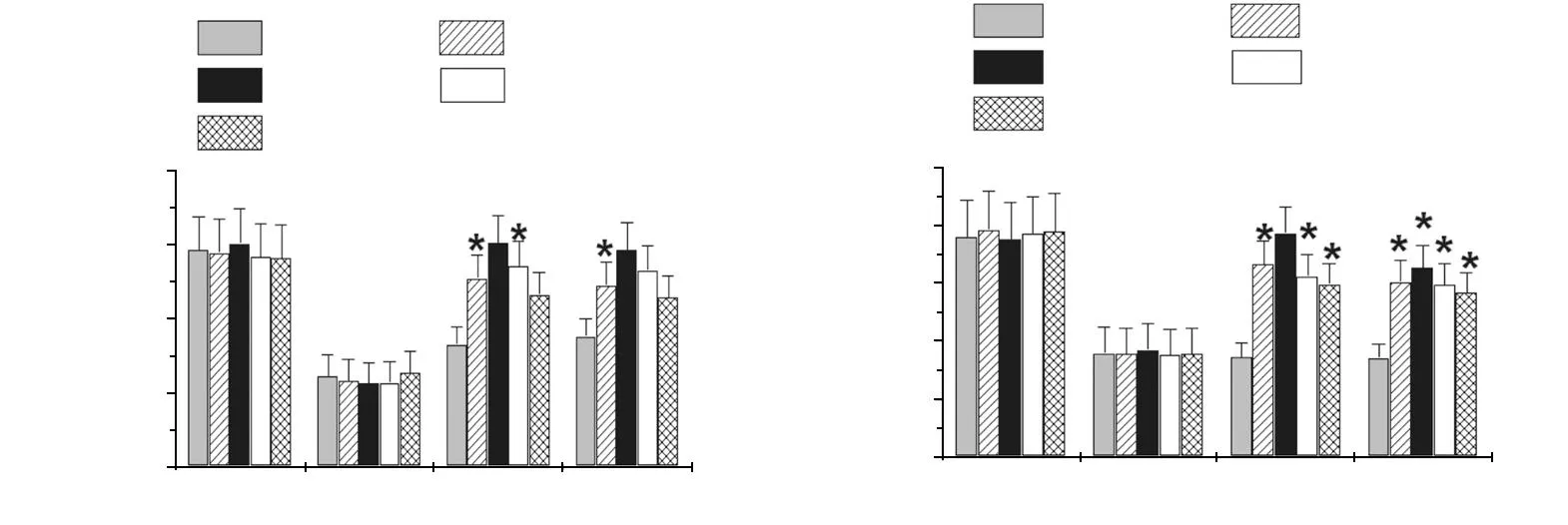
a:肝线粒体功能;b:肾线粒体功能;*:与LR组比较,P<0.05;#:与LR组比较,P<0.01
本实验采用大鼠失血性休克模型,观察PDGF对失血性休克动物血流动力学指标及24 h存活率的影响,发现给予外源性大剂量PDGF(1~15 μg/kg)后,动物的存活时间和存活率有显著提高,其中PDGF 3.5 μg/kg剂量组效果最好,其24 h平均存活时间和存活率显著高于休克对照组和仅输注LR复苏组。同时,我们观察到输注PDGF(1~15 μg/kg)可不同程度改善休克动物肝、肾等重要组织的血流量,提高器官线粒体功能,效果明显优于单纯给予LR复苏。
综上所述,本实验发现PDGF可提高失血性休克动物24 h存活时间和存活率,改善血流动力学状态和器官血流量,提高器官线粒体功能,从而在抗休克治疗中发挥一定的积极作用,但其具体作用机制还有待深入研究。
[参考文献]
[1] Villela NR,Tsai AG,Cabrales P,et al.Improved resuscitation from hemorrhagic shock with Ringer’s lactate with increased viscosity in the hamster window chamber Model[J].J Trauma,2011,71(2):418-424.
[2] Lomas-Niera JL,Perl M,Chung CS,et al.Shock and hemorrhage:an overview of animal models[J].Shock,2005,24(1):33-39.
[3] Li T,Yang GM,Xu J,et al.Regulatory effect of Rac1 on vascular reactivity after hemorrhagic shock in rats[J].J Cardivasc Pharma,2011,57(6):656-665.
[4] 徐竞,蓝丹,李涛,等.线粒体KATP在吡那地尓预处理后失血性休克大鼠组织血流灌注和线粒体功能保护效应中的作用[J].第三军医大学学报,2011,33(23):2441-2444.
[5] Hoch RV,Soriano P.Roles of PDGF in animal development[J].Development,2003,130(20):4769-4784.
[6] Judith R,Nithya M,Rose C,et al.Application of a PDGF-containing novel gel for cutaneous wound healing[J].Life Sci,2010,87(1-2):1-8.
[7] Hee CK,Dines JS,Solchaga LA,et al.Regenerative tendon and ligament healing:opportunities with recombinant human platelet-derived growth factor BB-homodimer[J].Tissue Eng Part B Rev,2012,18(3):225-234.
[8] Mulder G,Tallis AJ,Marshall VT,et al.Treatment of nonhealing diabetic foot ulcers with a platelet-derived growth factor gene-activated matrix (GAM501):results of a phase 1/2 trial[J].Wound Repair Regen,2009,17(6):772-779.
[9] Yan G,Sun H,Wang F,et al.Topical application of hPDGF-A-modified porcine BMSC and keratinocytes loaded on acellular HAM promotes the healing of combined radiation-wound skin injury in minipigs[J].Int J Radiat Biol,2011,87(6):591-600.
[10] Bordei P.Locally applied platelet-derived growth factor accelerates fracture healing[J].J Bone Joint Surg Br,2011,93(12):1653-1659.
[11] Zheng DT,Niu SQ,Yu D,et al.Abba promotes PDGF-mediated membrane ruffling through activation of the small GTPase Rac1[J].Biochem Biophys Res Commun,2010,401(4):527-532.
[12] Simeone-Penney MC,Severgnin M,Rozo L,et al.PDGF-induced human airway smooth muscle cell proliferation requires STAT3 and the small GTPase Rac1[J].Am J Physiol Lung Cell Mol Physiol,2008,294(4):L698-704.
(编辑:雷艳)
Role of platelet-derived growth factor after hemorrhagic shock in rats
LAN Dan,ZHU Yu,PENG Xiao-yong,LIU Liang-ming,LI Tao(Department 2,State Key Laboratory of Trauma,Burns and Combined Injury,Institute of Field Surgery,Daping Hospital,Third Military Medical University,Chongqing 400042,China)
Abstract:ObjectiveTo investigate platelet-derived growth factor (PDGF) protection on blood flow and mitochondrial function of hemorrhagic shock rats. MethodsNinety-six SD rats were randomly divided into six groups including shock group, lactated ringer's solution(LR) resuscitation group,PDGF treatment groups(1,3.5,7,15 μg/kg).Laster-Doppler and oxygen concentration determination method were applied to observe the protective effect of PDGF treatment on animal survival,blood flow and mitochondrial function in liver and kidney. ResultsAs compared with LR resuscitation group,PDGF treatment increased animal survival rate and also improved blood fiow of liver and kindy,mitochondrial respiration control ration(RCR),of which the group with 3.5μg/kg had the best result. ConclusionThis finding suggests that PDGF may be a potential agent to treat acute critical such as hemorrhagic shock.
Keywords:platelet-derived growth factor;survival rate;blood flow of liver and kindy;mitochondrial respiration control ration
[收稿日期]2014-09-20[修回日期] 2014-10-18
[通讯作者]李涛,E-mail:lt200132@163.com
[基金项目]重庆市杰出青年科学基金项目(cstc2011jjjq0019)
doi:10.11659/jjssx.06E014128
[中图分类号]R605.971
[文献标识码]A
[文章编号]1672-5042(2015)02-0166-04

