植物抗病毒基因工程研究进展
牙库甫江·阿西木,阿斯古丽·伊斯马伊力,王韵婧,刘玉乐
病毒是重要的植物病原,至今发现的致病性植物病毒约有450种[1]。它们通过多种传播途径感染农作物。植物病毒病被称作植物的“癌症”,一旦流行就可能造成较大的农作物损失,严重时甚至造成绝产。长期以来人们利用多种防治策略来控制病毒,例如培育抗病毒品种、使用化学杀菌剂、切断病毒的感染途径、组织脱毒、传统农业防治等,但都无法从根本上防治病毒病的危害。随着分子生物学理论和技术的不断发展完善,20世纪80年代初人们提出了利用基因工程手段提高植物抗病毒的设想。自Abel等[2]成功地将烟草花叶病毒 (Tobacco mosaic virus,TMV) 的外壳蛋白基因转化到烟草植物中获得稳定遗传的抗病毒烟草植株以来,植物基因工程技术已经取得了突飞猛进的发展。本文综述了植物抗病毒机制及目前比较常用的植物抗病毒基因工程策略。
1 植物先天抗病毒机制
病毒在适当的环境下可以成功侵染植物,而植物也对病毒的侵染有防御反应;如果病毒能够战胜植物防御机制,就会引发植物病毒病。植物主要通过两种方式响应具体病原体[3-6],一种是主要利用植物叶片表面的角质层、蜡质层、植物细胞壁、酶抑制剂以及部分抗微生物化合物等阻止病原体的侵入;另一种是主要通过激活寄主植物免疫反应抑制病原的侵染。那么寄主植物如何与病毒之间进行相互作用从而激活对病毒的抗性呢?一般来说,植物的抗病毒功能是通过植物先天免疫系统和植物体内的基因沉默两套机制来实现的。
1.1 植物先天免疫系统介导的抗病毒机制
与动物等多细胞生物一样,植物也有先天免疫系统,它通过植物细胞生产特定物质来应答病原的侵入[7]。根据从植物与细菌、真菌相互作用获得的知识,植物先天免疫可分为两个层次。一是通过细胞表面的模式识别受体(Pattern-recognition receptors,PRRs) 识别病原体相关分子模式 (Pathogen-associated molecular patterns,PAMPs) 产生的免疫反应,称为病原体相关分子激发的免疫反应 (PAMP-triggered immunity,PTI)[8]。尽管目前对于植物是否存在针对病毒的 PTI一直存在争议,但病毒学家通常认为RNA沉默是植物针对病毒的PTI。另一种是指植物通过自身的抗性基因 (Resistance gene,R基因) 特异地识别病原物效应因子所产生的免疫反应,也称为效应因子激发的免疫反应 (Effector-triggered immunity,ETI)[9-10]。所谓的效应因子 (Effectors) 是指病原体为了克服植物PTI而产生的物质,被植物R基因识别后可诱发植物抗病反应。
在与病原体相互作用的长期进化过程中,植物逐渐产生了抗病基因 (Resistance genes,R基因) 系统,使植物对病原体的侵染表现出了一系列的防御反应。上个世纪初 Biffen[11]开始关注单基因对植物抗病性的影响,1971年Flor[12]首次报道植物具有显性 R基因,提出植物的抗性取决于病原体的无毒基因 (Avirulence gene,Avr基因) 和植物相应的R基因之间的亲和性。植物的R基因编码的蛋白 (R蛋白) 直接或者间接地识别病原物编码的无毒蛋白效应子 (Avr),激活下游级联信号网络,诱导植物产生一系列抗性反应,并最终限制病原在入侵寄主上的扩散和不同寄主间的传播[13-14]。R蛋白称为受体,而相应的Avr蛋白称为激发子[15-16]。当avr基因丢失或突变后,R蛋白无法识别Avr蛋白,二者无法互作,下游网络信号无法激活,植物也因此不能产生有效的防御反应,导致植物病害发生。
植物R蛋白具有抵抗真菌、细菌、病毒以及线虫等病原体的功能[17]。根据结构特征,植物R蛋白可分为两大类:一是NBS-LRRs结构型蛋白,二是非 NBS-LRRs结构型蛋白。R蛋白中绝大多数是属于 NBS-LRRs结构型蛋白,主要负责识别胞内的信号。NBS-LRRs结构型蛋白由 3个结构域组成,即含有核苷酸结合结构域 NBS (Nucleotide-Binding site)、亮氨酸重复序列结构域LRRs (Leucine-rich repeats) 以及N末端的卷曲螺旋CC (Coiled-coil) 结构或Toll和白介素1受体结构域TIR (Toll and interleukin-1 receptor)[7]。非NBS-LRRs结构型蛋白包括胞内激酶类R蛋白、含有LRRs的受体激酶类R蛋白、跨膜并具有胞外 LRRs结构域的R蛋白、跨膜但仅有胞内CC结构域的R蛋白。这种R蛋白主要负责识别胞外的信号[18-21]。至今在植物体内已经克隆获得了100多种R基因[22],其中具有病毒抗性的R基因约有40多种 (表1)。
R基因介导的抗病反应过程实际上是一个信号转导的过程:当无毒因子存在时,无毒因子可以通过某种机制活化原本处于失活状态的R蛋白,有活性的R蛋白再通过一系列信号转导过程激活各种抗病反应,抵御病原物的侵害。R 基因介导的植物抗性常表现为超敏反应(Hypersensitive response,HR) 和系统性抗性(Systemic resistance,SR)。HR是植物抵抗病原物入侵的一种主动、快速的应答反应,以程序性细胞死亡形式表现。最初病毒侵染位点周围的细胞由于快速诱导的细胞程序化死亡形成了肉眼可见的局部坏死斑,病毒通常会被局限在损害的局部而不能扩散到周围健康的组织。发生HR的细胞会产生信号分子,传递给周围的细胞,然后通过植物韧皮部扩散到整个植株,使植物能够产生对更多种类的病原物的抗性[24],即诱导产生系统抗性。
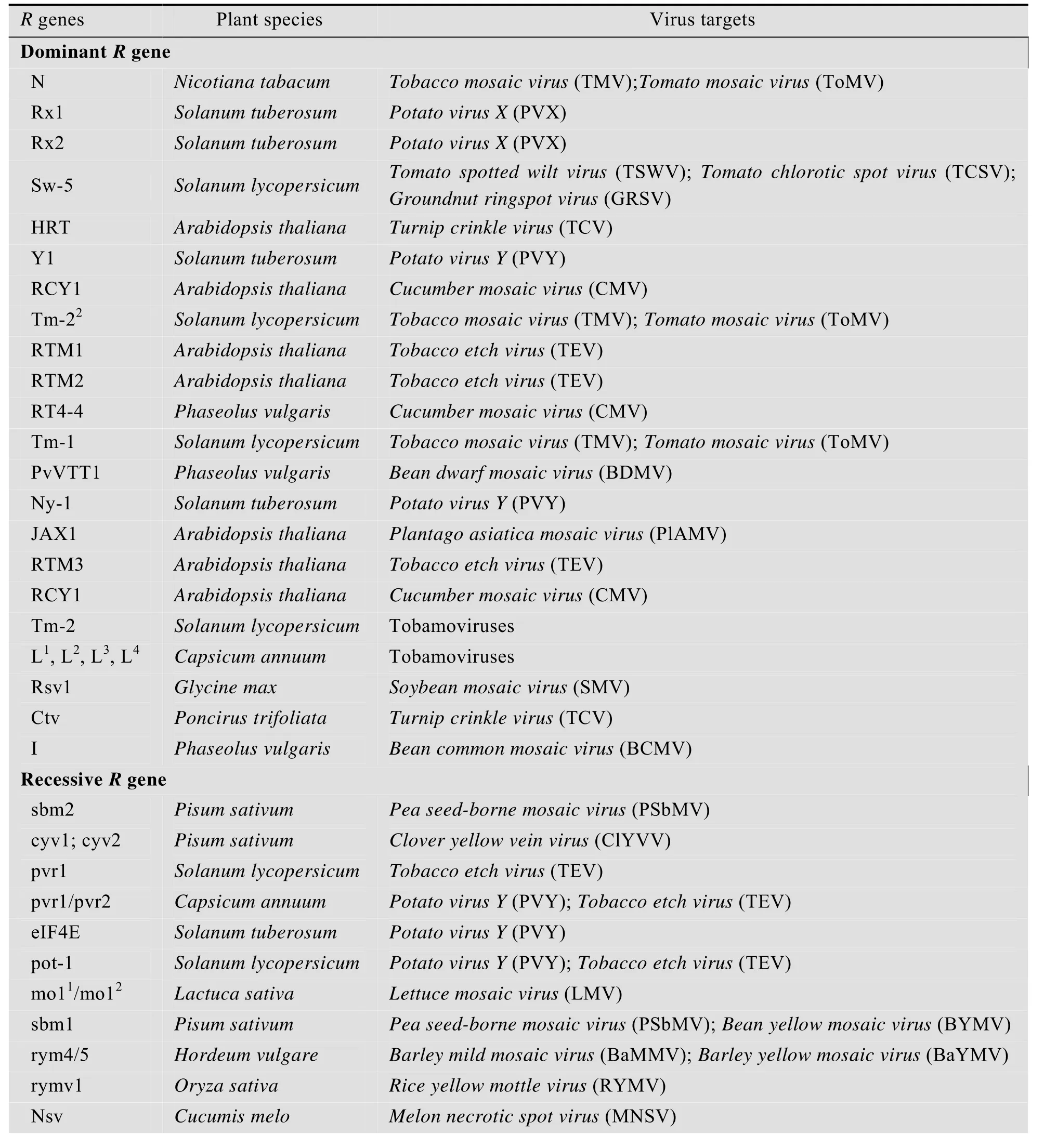
表1 已克隆的植物R基因[23]Table 1 Plant R genes conferring resistance to viruses[23]

1.2 基因沉默介导的抗病毒机制
RNA 沉默 (RNA silencing) 或基因沉默(Gene silencing) 是植物抵抗外来核酸 (转座子、转基因或病毒) 入侵并保护自身基因组完整性的一种防御机制,它最显著的特征就是能产生具有序列特异性调控功能的小 RNA。小RNA(Small RNA,sRNA) 是长度为21−24 nt的非编码蛋白的小RNA分子,在真核生物中参与生长发育、基因表达调控、染色体修饰、抗病毒以及保护宿主细胞基因组稳定性等多种生物学过程[25]。有一类 sRNA称为小干扰 RNA (Small interfering RNA,siRNA),是由双链 RNA(Double-stranded RNA,dsRNA) 产生的片段。siRNA一般来源于基因组上的重复序列(Repeated sequences)、反向重复序列 (Inverted repeats)、转座子 (Transposons) 或反转录子(Retroelements)[26-27]。除此之外,siRNA还可以由病毒和含有发卡结构的外源性基因产生[28]。siRNA主要通过指导与其互补的mRNA或病毒RNA的降解、翻译抑制或组蛋白修饰等过程抑制靶基因的表达或翻译。RNA沉默在植物抗病毒机制中都具有重要意义。
RNA沉默介导的植物抗病毒反应是植物抵抗病毒侵染的有效手段。大多数植物病毒是RNA病毒,在病毒成功入侵植物后,病毒RNA复制成双链RNA (dsRNA)。dsRNA会被植物体内的Dicer (一种RNA酶) 降解成21−25 nt的小的干扰 siRNA。这些 siRNA再与植物体内的AGO蛋白结合,形成具 RNA诱导的沉默复合体 (RNA-induced silencing complex,RISC)。RISC按照碱基互补配对的原则,与外源 RNA特异结合后,在结合部位切割RNA,从而降解外源RNA[29-31],抵抗病毒的侵入。病毒在与植物漫长的竞赛中进化出 RNA 沉默抑制子抑制宿主RNA沉默系统,从而逃避植物的防御,增强致病能力。
2 植物抗病毒基因工程策略
1984年首次报道将细菌抗抗生素基因通过农杆菌转入到烟草体内并表达成功[32],开创了植物转基因之路,为植物抗病毒基因工程领域奠定了基础。1986年,Abel等[2]通过植物基因工程技术首次将烟草花叶病毒 (TMV) 外壳蛋白基因转人烟草,培育出能稳定遗传的抗病毒工程植株,由此开启了抗病毒植物基因工程这一新的领域。自此以后,人们利用不同的策略来获得抗病毒工程植株。
2.1 病毒来源的抗性
2.1.1 病毒外壳蛋白介导的策略
1985年Sanford和Johnston[33]首次提出通过病毒来源的抗性 (Pathogen derived resistance,PDR) 抑制病毒的设想,即把病毒的某一个基因或基因组的一部分序列导入宿主植物来诱导植物产生抗性从而抑制病毒。1986年Abel等[2]将TMV的外壳蛋白 (Coat protein, CP) 基因转入烟草中进行表达而使烟草获得一定程度的对TMV的抗性,证明了病毒蛋白可以诱导植物产生对相应病毒的抗性。自此之后,对PDR方法的研究一直成为抗病毒的研究热点。
外壳蛋白是形成病毒颗粒的结构蛋白,其功能是包被并保护病毒基因组核酸,参与病毒的长距离运输等。外壳蛋白介导的抗性是研究最早,也是到目前为止比较成功的抗病毒手段。外壳蛋白介导的抗性 (Coat protein mediated resistance,CPMR) 策略是将病毒的外壳蛋白基因转化到植物细胞内,从而使得转基因植物获得抗病毒的能力[34]。此种方法产生的病毒抗性有些是广泛的,有些是比较局限的[35],抗性范围可能因病毒种类不同而不同,如转马铃薯花叶病毒 (Potato mosaic virus,PMV) CP基因的马铃薯对PMV和其他的同组病毒均有抗性[36],但是转化木瓜环斑病毒 (Papaya ringspot virus,PRSV) HA株系CP基因的木瓜只能对PRSV HA株系产生抗性[37]。后来发现,株系专一的抗性常是由于RNA沉默导致的。至今通过CPMR策略获得抗约35种病毒的转基因植物,如有转番茄花叶病毒 (Tomato mosaic virus, ToMV),黄化叶病毒 (Yellow mosaic virus),黄瓜花叶病毒(Cucumber mosaic virus,CMV) 以及番茄黄化曲叶病毒 (Tomato yellow leaf curling virus,TYLCV) 外壳蛋白基因的番茄[38],其中抗CMV的番茄等经济作物已经通过认证商业化[39]。此外,刘小红等还将玉米矮花叶病毒 (Maize dwarf mosaic virus, MDMV) 外壳蛋白基因转入玉米,获得了对MDMV有抗性的玉米[40]。
2.1.2 病毒复制酶介导的策略
除了病毒外壳蛋白提供有效的植物病毒抗性外,用其他病毒蛋白,如复制酶和运动蛋白转基因也可获得病毒抗性[41-44]。复制酶是指由病毒编码的能特异合成病毒正、负链 RNA的RNA聚合酶。1990年Golemboski等[45]报道将TMV复制酶的一段核酸序列转入烟草后产生对TMV的抗性。随后的研究显示转病毒复制酶基因的部分,全长以及突变序列的植物均有病毒抗性,但是抗性的程度和范围不尽相同[46]。研究显示不同病毒复制酶转基因介导的抗性机制不同,一些在蛋白质水平上介导抗性,但许多是RNA介导的病毒抗性[47]。在蛋白水平上,转基因植物表达的复制酶在病毒的侵染过程中作为一种调节蛋白发挥功能,从而打破了病毒复制的平衡,或者是干扰了催化产生复制酶的酶活性的反馈抑制途径[48]。复制酶介导的抗性对于植物病毒的种类具有很高的特异性,因此其应用范围可能会受到一定的限制。李华平等利用番木瓜环斑病毒 (Papaya ringspot virus,PRSV) 的复制酶基因转化番木瓜获得抗 PRSV的转基因植株,并且此种抗病番木瓜已经获得生产应用的安全证书[49]。
2.1.3 病毒运动蛋白介导的策略
植物病毒侵染植物后在体内的运转方式主要有两种,一是通过胞间连丝在细胞之间的移动,二是通过植物维管组织进行的系统转移。病毒在细胞间的移动是一个主动的过程,需要病毒的运动蛋白 (Movement protein, MP) 的参与。N末端3个氨基酸缺失导致功能缺陷的TMV MP的基因转入烟草后,TMV的侵染受到抑制,症状出现延迟[50]。许多病毒的基因组有 1个三基因重叠区 (Triple gene block, TGB),编码3个不同的运动蛋白,白三叶草花叶病毒 (White clover mosaic virus,WCIMV) 为马铃薯X病毒属的病毒,其运动蛋白 13a中一段序列在所有具有TGB的病毒中保守,在该保守区将13a蛋白突变获得的突变体转基因后不仅抗 WCIMV多个株系,而且抗同病毒属的马铃薯病毒 X(Potato virus X,PVX) 和水仙花叶病毒(Narcissus mosaic virus),甚至抗香石竹潜病毒组的马铃薯病毒S (Potato virus S)[51]。利用MP介导的病毒抗性策略常获得较广泛的病毒抗性,目前大多应用于马铃薯和番茄这两种作物上。
2.1.4 其他病毒蛋白介导的抗性策略
植物抗病毒基因工程往往需要以病毒外壳蛋白/复制酶/运动蛋白及病毒基因组作为靶向[52]。除此之外,人们还利用病毒的其他蛋白转基因获得病毒抗性。双生病毒 (Geminiviruses)是DNA病毒,其复制不同于RNA病毒,主要是以滚环复制的方式进行复制[53]。双生病毒编码的复制起始蛋白 (Replication initiation protein, Rep) 具有核酸内切酶和连接酶活性,是双生病毒复制过程中的关键因子。研究报道部分双生病毒 Rep全长基因转化的植株对相应的病毒产生抗性,这些病毒包括TYLCV[54],棉花曲叶病毒 (Cotton leaf curl virus, CLCuV)[55],台湾番茄曲叶病毒 (Tomato leaf curl Taiwan virus,ToLCTWV)[56]等。
除了双生病毒 Rep之外,还有利用烟草脉斑驳病毒 (Tobacco vein mottling virus, TVMV)NIa蛋白酶[57],马铃薯病毒Y (Potato virus Y, PVY)编码的P1蛋白[58-59]等都能产生病毒抗性。
2.1.5 卫星RNA介导的抗性策略
某些植物病毒有卫星RNA (Satellite RNA,satRNA)。卫星 RNA是一类依赖于辅助病毒才能复制的低分子量RNA,它不能编码外壳蛋白,只装配于辅助病毒的外壳蛋白中,其复制、运动必须依靠辅助病毒进行[60]。satRNA及辅助病毒在同一植物内的共同存在导致两种截然不同的结果,或加重症状,或抑制辅助病毒的复制。satRNA抑制病毒复制的功能被用于植物病毒抗性研究中。20世纪世纪80年代初,我国田波院士研究组[61]首次在国际上开展了利用 satRNA防治病毒病害的研究工作,结果表明黄瓜花叶病毒 (CMV) satRNA作为生物防治因子能有效地防治由强毒株系 CMV引起的严重病害。1986年 Baulcombe等[62]首次成功地将 CMV的satRNA导入烟草,接种 CMV后,植株体内satRNA增加,CMV基因组RNA水平大幅下降,植株不表现症状。后来类似抗性在矮牵牛和辣椒中报道[63-64]。1992年田波院士研究组报道,将表达CMV的satRNA和CP嵌合蛋白的序列转化烟草,进一步提高了转基因植株的抗性效率[65]。
一般认为 satRNA介导的病毒抗性的机理是 satRNA与病毒基因组 RNA 争夺病毒复制酶位置,最终以数量优势抑制了病毒基因组的复制。但是最近研究报道,这种抗性中还会存在RNA沉默途径[66-67]。卫星 RNA 介导的抗性只需很低的表达,就能使植株获得高抗作用,而且这种抗性并不产生特异蛋白,这样提高了转基因植物的生物安全性等优点。但是也存在一些缺点:含有卫星RNA的病毒种类少,应用范围不广。另外卫星RNA转基因植株只在农作物生长的晚期抗病,对早期的初侵染没有抗性。BaMV的卫星RNA转基因的烟草和拟南芥也有很强的抗性[68]。
2.1.6 核酶介导抗性策略
20世纪80年代初,Cech等[69]研究原生动物四膜虫rRNA时,首次发现RNA基因转录产物的Ⅰ型内含子剪切和外显子拼接过程可在无任何蛋白质存在的情况下发生,证明了RNA具有催化功能。后来这种RNA被称为核酶[70]。核酶是一类具有特殊二级结构、能特异性催化切割自身以及其他RNA分子的小分子RNA。
根据核酶的功能人们预测了当核酶序列嵌入到病毒RNA互补序列中时,核酶能够序列特异性地降解病毒RNA从而抑制病毒。有关研究报道,利用核酶能控制病毒,即依据已知的病毒基因组的特定区域序列设计核酶序列,使它能特异识别切割病毒的特定区域,从而切断病毒基因组,破坏其生物功能。在植物抗病毒方面,Kwon等[71]成功设计能切割CMV RNA1和RNA2的核酶后在烟草体内表达获得对CMV的抗性。此外,Yang等[72]用能切割马铃薯纺缍块茎类病毒 (Potato spindle tuber viroid,PSTV)的核酶基因,并转化马铃薯后成功地控制了PSTV感染。Huttner等[73]报道,通过多核酶序列同时靶向WMV和ZYMV病毒,提供新的方法。核酶基因介导的抗性虽已取得一定的成效,但仍然存在核酶的切割效率低、表达量不高、稳定性差和依赖高浓度的表达量等问题。
2.1.7 RNA沉默介导的策略
正义RNA介导的策略:NaPoli等[74]将与成花色素合成有关的CHS基因转入矮牵牛,期望获得花色加深的转基因植株,结果原本开紫花的矮牵牛不但花色没有加深反而出现了白花。研究表明导入的CHS基因与同源的内源CHS基因的mRNA水平同时降低,称为共抑制或正义RNA介导的基因沉默。当外源基因在植物中高效表达或受到病毒侵染时在植物中积累大量病毒RNA并达到一定阈值时会激活细胞内的一种监视机制,用以排除过量的 RNA[75]。 后来知道这种监视机制是RNA沉默。通过表达病毒正义 RNA片段有时可以获得抗病毒植物,如:Dougherty等[76]将 Tobacco etch virus (TEV) 的一段不能编码病毒外壳蛋白的病毒基因序列转化烟草过量表达后,转基因植株产生对TEV的抗性。最近研究报道利用类似的方法也能够得到对Papaya ringspot virus (PRSV)[77-78]等其他许多病毒抗性的植物。
反义RNA介导的策略:反义RNA是一类与mRNA互补配对的单链RNA,它能通过与靶向mRNA互补配对从而产生相应的dsRNA或降解目的mRNA来抑制目的基因表达。Bird等[79]首次利用这门技术,成功抑制了番茄类胡萝卜素合成。从此该技术开始运用于植物抗病毒领域,至今已在许多中植物中获得成功。Day等[80]将TGMV (Tomato golden mosaic virus) 的AL1基因的反义 RNA转入烟草后烟草会产生对TGMV的抗性。此后人们通过这种方法成功地抑制了MYMV (Mungbean yellow mosaic virus)[81]、ACMV (African cassava mosaic virus)[82]、PVY[83]等对植物的侵染。
反向重复序列介导的策略:1998年Waterhouse等[84]首次报道,将正义和反义的GUS基因序列相互串联重组构成的反向重复(Inverted repeat,IR) 序列转入水稻 (转GUS基因的植物) 后产生 dsRNA,使体内稳定表达的GUS基因沉默。人们也通过此种方式将病毒蛋白编码的基因进行沉默达到控制病毒的目的。Tougou等[85]报道,Soybean dwarf virus (SDV)的外壳蛋白 (CP) 基因通过 IR介导 RNA沉默方法对相应的病毒进行控制。周雪平研究组将TMV运动蛋白基因和CMV复制酶基因片段融合的反向重复序列转化烟草获得对 TMV和CMV抗性[86]。与正义和反义RNA介导的抗性策略相比,IR介导的抗性策略至少具有两种优势:一是由于 IR序列的转录不依赖于 RdRp(RNA dependent RNA polymerase)[87],抗病毒效率高[88-89];二是通过一种重组序列能够防御多种植物病毒。最近的研究显示,将来自于 3种不同的大豆病毒的反向重复序列重组导入大豆后,这种转基因大豆能够抗御 AIMV、BPMV和SMV等多种病毒[90]。
miRNA介导的植物病毒策略:miRNA(MicroRNAs) 是最早在秀丽隐杆线虫Caenorhabditis elegance[91]中发现的一类内源性的具有调控功能的非编码 RNA,其大小长约20−25个核苷酸。miRNA在序列同源性基础上与相应的mRNA特异结合,从而抑制转录后基因表达,在调控基因表达、细胞周期、生物体发育时序等方面起重要作 用[92-93]。Niu等[94]首次报道人工改造的miRNA在拟南芥体内稳定表达后能够跟 TYMV (Turnip yellow mosaic virus) 和TuMV病毒的HC-Pro基因转录的RNA结合使其沉默,从而抑制病毒产生抗性。Ai等[95]报道在烟草中利用人工 miRNA可以有效地沉默 PVX病毒的 HcPro基因和 PVY 病毒的TGB1/p25基因从而抑制病毒感染。Zhang等[96]也利用类似的方法有效地抑制 CMV病毒对番茄的感染。方荣祥和郭惠珊研究组用此方法利用针对CMV mRNA的人工miRNA在烟草体内取得对CMV的抗性[97-98]。近年来发现,病毒会通过在靶向位点突变来降低人工miRNA和病毒mRNA的结合,逃避人工miRNA的降解,从而导致植物病毒抗性丧失[99-100]。所以为了解决这个问题人们靶向病毒基因的不同保守区构建了多种人工miRNA的载体。但这种措施只有对部分病毒很有效[97],这可能是由于靶向mRNA的结构不同时人工miRNA的有效性也不同。
2.2 寄主基因介导的抗性
2.2.1 显性R基因介导的策略
目前已克隆多个抗病毒的 R基因,人们利用植物 R基因来控制病毒。R基因介导的抗性策略中最典型的例子是烟草 N基因转入番茄,转基因的番茄有效抵抗 TMV[101]。此外马铃薯Rx抗PVX,转化烟草后仍对Potexviruses有抗性[102],番茄 Tm-22基因抗 ToMV和 TMV,转化烟草对TMV和ToMV也有相同的抗性[103]等。多数 R基因的抗性不仅具有特异性,而且有可能随着病菌群体组成的变化和快速进化而丧失。在植物 R基因的利用上可以从以下几方面考虑:1) 根据已有的R基因结构特征设计新的基因;2) 进行异源表达;3) 可以向一株植物中导入多个R基因。在同一品种中导入多个R基因或过表达一个 R基因可能使植物可以对抗多种病原且抗性持久。
2.2.2 隐性R基因介导的策略
植物易感基因能够编码病毒侵入所必需的蛋白,帮助病毒侵染。但是它的等位基因突变时不但不能帮助病原体入侵而且会使宿主形成病毒抗性,即隐性抗性。至今许多隐性抗性基因 (隐性R基因) 已被克隆,大部分编码与真核翻译起始复合体 (Eukaryotic translation initiation complex) 相关的蛋白。真核翻译起始因子 (Eukaryotic translation initiation factors,eIFs),尤其eIF4E和eIF4G蛋白家族是部分RNA病毒 (例如potyviruses) 侵染的决定因子[104-106]。通过表达突变的与病毒蛋白不能互作的植物蛋白可以使植物抗病毒,如:辣椒 pvr12基因(eIF4E基因的等位基因) 在马铃薯过量表达时,转基因植株能够抵抗多种PVY病毒[107]。
通过沉默eIFs也可以产生病毒抗性。如:李痘病毒 (Plum pox virus, PPV) 侵入李子Prunus domestica植物需要eIF(iso)4E (eIF4E的异构体) 的协助,用 RNA沉默技术设计靶向eIF(iso)4E时,李子对PPV产生抗性,但是eIF4E基因沉默的植株不能产生对PPV的抗性,说明potyvirus侵入宿主时需要跟eIFs异构体的特异性互作[108]。
2.2.3 其他寄主蛋白介导的抗性策略
参与植物防御反应的主要有乙烯应答元件结合因子 (Ethylene response factors,ERF)、MYB、WRKY、bZIP (Basic leucine zipper) 家族和 homeodomain蛋白。过表达一些含ERF元件的基因可以使植物显示对病毒的抗性,如抗烟草花叶病毒组 (Tobamoviruses) 和 PMMoV[109-112]。许多编码防御反应相关蛋白的基因可以使植物对病毒产生一定抗性。如来自黄灯笼辣椒编码类萌蛋白的基因 (CchGLP) 在烟草体内过量表达后减轻或延迟 Pepper huasteco yellow vein virus(PHYVV) 和 Pepper golden mosaic virus(PepGMV) 的感染[113]。
植物凝集素基因JAX1在烟草体内过量表达后特异性地抑制potexviruses[114];编码RdRp的基因Ty1、Ty3的番茄通过超甲基化TYLCV的CP基因启动子区来抑制TYLCV[115-116]。水稻基因 STV11编码磺基转移酶,能够调节水杨酸途径对Rice stripe virus (RSV) 产生抗性[117]。后二者转化入敏感植物或其他植物极可能可以抗相应的双生病毒或RSV。
2.3 其他来源的基因介导的抗性策略
2.3.1 核糖体失活蛋白介导的策略
核糖体失活蛋白 (Ribosome-inactivating proteins, rIPs) 是一种N糖苷酶,能够特异性地水解28S核糖体RNA在A4324处的腺嘌呤糖苷键,从而阻止EF2/GTP复合物与核糖体60S大亚基的结合,抑制蛋白质的合成。目前用于植物抗病毒基因工程的植物来源性RIPs有:美洲商陆抗病毒蛋白 (Pokeweed antiviral protein,PAP) 和天花粉蛋白 (Trichosanthin, TCS)。PAP是从美洲商陆 (Phytolacca americanai L.) 植物中分离出的一种碱性蛋白,分子量约30 kDa,属于广谱抗植物病毒蛋白。Lodge等[118]将 pap基因导入到烟草和马铃薯后,成功表达PAP的转基因烟草马铃薯都表现出了对多种病毒的抗性。这种PAP蛋白合成后会运输到细胞质中,在正常情况下不会影响核糖体功能,只是在病毒侵染细胞后使核糖体失活,从而抑制病毒RNA翻译。值得注意的是许多植物PAP蛋白是多核苷酸N糖苷酶,不仅能够水解核糖体上的腺嘌呤糖苷键还能够水解DNA和RNA中的腺嘌呤[119],在清除病毒基因组方面起到一定作用。据报道,C末端缺失的PAP蛋白不能水解宿主细胞中的核糖体RNA中的腺嘌呤,但是仍能够抑制病毒感染[120]。
TCS是从药用植物栝楼(Trichosanthes kirilowii Maxim.) 块根中提取出来的分子量约26 kDa的碱性蛋白。TCS原本作为中草药天花粉的有效成分应用于妊娠引产、治疗绒毛膜皮上癌等。近年来发现,TCS对艾滋病毒 (HIV)及乙肝病毒等 7种病毒均有广谱抗性。Lam等[121]研究发现,将重组后的TCS转化烟草和菜心,能限制TuMV (Turnip mosaic virus) 侵染烟草后局部坏死斑的形成,并且延迟 TuMV侵染菜心后花叶症状的出现。
2.3.2 植物抗体介导的抗性策略
1989年Hiatt等[122]获得了能够表达完整抗体的转基因烟草,这种植物表达出来的抗体具有与抗原结合的活性,开创了植物抗体的先河。随后研究证明,植物能产生从小分子抗体到全抗体等各种工程抗体。抗病毒蛋白的抗体基因在植物中的表达,有可能使植物抗病毒。Tavladoraki等[123]在烟草中表达抗菊芋花斑皱叶病毒 (Artichoke mottled crinkle virus,AMCV)外壳蛋白的单链抗体的可变区片段 (Singlechain variable fragment, scFv),使转基因植株产生了对AMCV的抗性。在这种抗性策略中,scFv表达水平和稳定性不太理想,转基因植物不能产生较强的抗性,只能延迟病毒感染时间及降低感染水平,因此当时这种策略不太受欢迎。后来的研究取得了scFv的稳定性表达[124],也拓宽了对靶向蛋白的选择,除病毒外壳蛋白之外还增加了病毒复制蛋白[125]和一些非结构性病毒蛋白[126-127]等作为靶向蛋白。
2.3.3 核酸酶介导的抗性策略
动植物细胞都有识别PAMPs的能力,并且通过结合PRRs激发免疫反应。2′-5′寡聚腺苷酸合成酶 (2′-5′ Oligoadenylates synthesis, OAS)是在动物细胞中发现的一种干扰素诱导产生的抗病毒蛋白,在机体的抗病毒免疫过程中发挥着重要作用。当细胞受到病毒侵染后,机体产生干扰素,干扰素刺激细胞产生OAS。OAS只有在dsRNA存在下才具有活性,病毒基因组的dsRNA、RNA病毒复制、DNA病毒转录过程中产生的短暂存在的dsRNA都能够激活OAS[128]。在被dsRNA激活后,OAS家族中的蛋白将ATP聚合成 pppA(2′p5′A)n (n=1 或 n>1) 寡聚体,进而激活潜在的核糖核酸酶 L (RNaseL),被激活的RNaseL使病毒的mRNA降解,起到抗病毒的作用[129]。
虽然在植物中未发现OAS/RNase L系统,但是通过转基因在烟草体内引入OAS系统后,转基因烟草在病毒感染后产生类似于 HR的反应,植物表现较广泛的病毒抗性[130-131]。此外,在转基因的烟草中还发现,TMV感染后 OAS系统能够激活 SAR[132]。单独转 OAS基因的转基因植物没有表现出病毒抗性,只有与RNase L基因同时转基因时才能产生病毒抗性。李大伟研究组[133]将大肠杆菌中编码特异识别 dsRNA的核糖核酸内切酶基因转化玉米后发现转基因植株对RBSDV (Rice black-streaked dwarf virus)产生抗性。
2.3.4 其他抗性策略
除了上述抗病毒策略之外,人们还发展其他抗性策略。如:项瑜等[134]构建了PVY Nib基因和解淀粉芽胞杆菌Bacillus amyloliquefaciens的 RNase基因 (Barnase) 的融合基因,该融合基因的转基因植株对PVY侵染表现局部抗性。其原理是该融合基因编码的融合蛋白没有Barnase活性,但在 PVY侵染后,融合蛋白被病毒蛋白酶加工,有活性的 Barnase被释放出来,杀死被病毒侵染的细胞,使病毒不能进一步扩散[134]。此外王志华等将来源于苜蓿银纹夜蛾核多角体病毒的 p35基因转化烟草,转基因植株也表现对TMV产生抗性[135]。
3 展望
基因工程是植物抗病育种工作中十分有效和有用的手段。自1986年人们首次获得抗病毒工程植株以来,经过近30年的探索和完善,植物抗病毒基因工程研究不论在深度上还是广度上都已经得到了很大的发展,相关技术和方法不断发展和更新。基因工程技术最大的优点是可以将人们所感兴趣的外源目的基因特异性地导入植物体内,使其产生人们需要的表型和特征。一些病毒来源的抗性策略,尤其是小RNA介导的策略已经能使植物产生免疫的抗性[137],该策略也适用于控制多种植物病毒;植物和其他来源的基因也可产生强且安全的病毒抗性。此外,一些抗病毒转基因作物已经广泛种植并证明了很好的效果,可以相信抗病毒转基因作物会得到更广泛的应用。
[1] Soosaar JLM, Burch-Smith TM, Dinesh-Kumar SP. Mechanisms of plant resistance to viruses. Nat Rev Microbiol, 2005, 3(10): 789–798.
[2] Abel PP, Nelson RS, De B, et al. Delay of disease development in transgenic plants that express the Tobacco mosaic virus coat protein gene. Science,1986, 232(4751): 738–743.
[3] Vergne E, Grand X, Ballini E, et al. Preformed expression of defense is a hallmark of partial resistance to rice blast fungal pathogen Magnaporthe oryzae. BMC Plant Biol, 2010, 10:1471–2229.
[4] Pieterse CM, van Wees SC, Hoffland E, et al.Systemic resistance in Arabidopsis induced by bio control bacteria is independent of salicylic acid accumulation and pathogenesis-related gene expression. Plant Cell, 1996, 8(8): 1225–1237.
[5] Loon LC, Bakker PA, Pieterse CM. Systemic resistance induced by rhizosphere bacteria. Annu Rev Phytopathol, 1998, 36: 453–483.
[6] Compant S, Duffy B, Nowak J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects. Environ Microbiol, 2005, 71(9):4951–4959.
[7] Moffett P. Mechanisms of recognition in dominant R gene mediated resistance. Adv Virus Res, 2009,75: 1–33, 228–229.
[8] Nicaise, Roux M, Zipfel C. Recent advances in pAMP-triggered immunity against bacteria:pattern recognition receptors watch over and raise the alarm. Plant Physiol, 2009, 150(4):1638–1647.
[9] Dang JL, Jones JD. Plant pathogens and integrated defense responses to infection. Nature, 2001,411(6839): 826–833.
[10] Zipfel C, Felix G. Plants and animals: a different taste for microbes?. Curr Opin plant biol, 2005,8(4): 353–360.
[11] Biffen RH. Mendel’s laws of inheritance and wheat breeding. J Agric Sci, 1905, 1(1): 4–48.
[12] Flor HH. Current status of gene-for-gene concept.Annu Rev Phytopathol, 1971, 9: 275–296.
[13] Heath MC. Non host resistance and nonspecific plant defenses. Curr Opin Plant Biol, 2000, 3(4):315–319.
[14] Shirasu K, Schulze-Lefert P. Complex formation,promiscuity and multi-functionality: protein interactions in disease-resistance pathways.Trends Plant Sci, 2003, 8(6): 252–258.
[15] Gabriel DW, Rolfe BG. Working models of specific recognition in plant-microbe interactions.Annu Rev Phytopathol, 1990, 28: 365–391.
[16] Ellis J, Dodds P, Pryor T. Structure, function and evolution of plant disease resistance genes. Curr Opin Plant Biol, 2000, 3(4): 278–284.
[17] Martin GB, Bogdanove AJ, Sessa G.Understanding the functions of plant disease resistance proteins. Annu Rev Plant Biol, 2003,54: 23–61.
[18] Song WY, Wang GL, Chen LL, et al. A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21. Science, 1995, 270(5243):1804–1806.
[19] Riely BK, Martin GB. Ancient origin of pathogen recognition specificity conferred by the tomato disease resistance gene Pto. Proc Natl Acad Sci USA, 2001, 98(4): 2059–2064.
[20] Vleeshouwers VGAA, Martens A, van Dooijeweert W, et al. Ancient diversification of the Pto kinase family preceded speciation in Solanum. Mol Plant Microbe Interact, 2001, 14(8):996–1005.
[21] Sun XL, Cao YL, Yang ZF, et al. Xa26, a gene conferring resistance to Xanthomonas oryzae pv oryzae in rice, encodes an LRR receptor kinase-like protein. Plant J, 2004, 37(4): 517–527.
[22] Sanseverino W, Ercolano MR. In silico approach to predict candidate R proteins and to define their domain architecture. BMC Res Notes, 2012, 5:678.
[23] Galvez LC, Banerjee J, Pinar H, et al. Engineered plant virus resistance. Plant Sci, 2014, 228: 11–25.
[24] Conrath U, Pieterse CMJ, Mauch-Mani B. Priming in plant-pathogen interactions. Trends Plant Sci,2002, 7(5): 210–216.
[25] Mello CC, Conte DJr. Revealing the world of RNA interference. Nature, 2004, 431(7006):338–342.
[26] Meister G, Tuschl T. Mechanisms of gene silencing by double-stranded RNA. Nature, 2004,431(7006): 343–349.
[27] Finnegan EJ, Matzke MA. The small RNA world.J Cell Sci, 2003, 116(23): 4689–4693.
[28] Hamilton AJ, Baulcombe DC. A species of small antisense RNA in post transcriptional gene silencing in plants. Science, 1999, 286(5441):950–952.
[29] Voinnet O. Origin Biogenesis, and activity of plant microRNAs. Cell, 2009, 136(4): 669–687.[30] Carthew RW, Sontheimer EJ. Origins and mechanisms of miRNAs and siRNAs. Cell, 2009,136(4): 642–655.
[31] Ding SW. RNA-based antiviral immunity. Nat Rev Immunol, 2010, 10(9): 632–644.
[32] De Block M, Herrera-Estrella L, van Montagu M,et al. Expression of foreign genes in regenerated plants and in their progeny. EMBO J, 1984, 3(8):1681–1689.
[33] Sanford JC, Johnston SA. The concept of parasite-derived resistance-deriving resistance genes from the parasite’s own genome. J Theor Biol, 1985, 113(2): 395–405.
[34] Beachy RN, Loesch-Fries S, Tumer NE. Coat protein-mediated resistance against virus infection. Ann Rhthol, 1990, 28: 451–472.
[35] Tepfer M. Risk assessment of virus-resistant transgenic plants. Annu Rev Phytopathol, 2002,40: 467–491.
[36] Malnoë P, Farinelli L, Collet GF, et al. Small-scale field tests with transgenic potato, cv. Bintje, to test resistance to primary and secondary infections with Potato virus Y. Plant Mol Biol, 1994, 25(6):963–975.
[37] Tennant PF, Gonsalves C, Ling KS, et al.Differential protection against Papaya ringspot virus isolates in coat protein gene transgenic papaya and classically cross-protected papaya.Phytopathology, 1994, 84: 1359–1366.
[38] Dasgupta I, Malathi VG, Mukherjee SK. Genetic engineering for virus resistance. Curr Sci, 2003,84: 341–354.
[39] James C. GM events with viral disease resistance(2014) [EB/OL]. http://www.isaaa.org/gmapprovaldatabase/gmtrait/default.asp?TraitID=7&GMTrait=Viral disease resistance.
[40] Liu XH, Zhang HW, Liu X, et al. Isolation of the capsid protein gene of maize dwarf mosaic virus and its transformation in maize. Chin J Biotech,2005, 21(1): 144–148 (in Chinese).
刘小红, 张红伟, 刘昕, 等. MDMV CP基因的克隆及其转基因玉米的研究. 生物工程学报,2005, 21(1): 144–148.
[41] Beachy RN. Coat-protein-mediated resistance to Tobacco mosaic virus: discovery mechanisms and exploitation Philos. Trans R Soc Lond Biol Sci,1999, 354(1383): 659–664.
[42] Yoshikawa N, Saitou Y, Kitajima A, et al.Interference of long-distance movement of Grapevine berry inner necrosis virus in transgenic plants expressing a defective movement protein of Apple chlorotic leaf spot virus. Phytopathology,2006, 96(4): 378–385.
[43] Morroni M, Thompson JR, Tepfer M. Twenty years of transgenic plants resistant to Cucumber mosaic virus. Mol Plant Microb Interact, 2008,21(6): 675–684.
[44] Cooper B, Lapidot M, Heick JA, et al. A defective movement protein of TMV in transgenic plants confers resistance to multiple viruses whereas the functional analog increases susceptibility.Virology, 1995, 206(1): 307–313.
[45] Golemboski DB, Lomonossoff G P, Zaitlin M.Plants transformed with a Tobacco mosaic virus nonstructural gene sequence are resistant to the virus. Proc Natl Acad Sci USA, 1990, 87(16):6311–6315.
[46] Palukaitis P, Zaitlin M. Replicase-mediated resistance to plant virus disease. Adv Virus Res,1997, 48: 349–377.
[47] Lomonossoff GP. Pathogen-derived resistance to plant viruses. Ann Rev Phytopathol, 1995, 33:323–343.
[48] Carr J P, Gal-On A, Palukaitis P, et al. Replicasemediated resistance to Cucumber mosaic virus in transgenic plants involves suppression of both virus replication in the inoculated leaves and long distance movement. Virology, 1994, 199(2):439–447.
[49] 李华平, 张曙光, 饶雪琴, 等. 抗病毒转基因番木瓜华农 1号的安全性评价// 彭友良. 中国植物病理学会 2007年学术年会论文集-病毒及病毒病害. 杨凌: 西北农林科技大学出版社, 2007:209–212.
[50] Lapidot M, Gafny R, Ding B, et al. A dysfunctional movement protein of Tobacco mosaic virus that partially modifies the plasmodesmata and limits virus spread in transgenic plants. Plant J, 1993, 4(6): 959–970.
[51] Beck DL, van Dolleweerd CJ, Lough TJ, et al.Disruption of virus movement confers broad-spectrum resistance against systemic infection by plant viruses with a triple gene block.Proc Natl Acad Sci USA, 1994, 91(22):10310–10314.
[52] Collinge DB, Jørgensen HJL, Lund OS, et al.Engineering pathogen resistance in crop plants:current trends and future prospects. Ann Rev Phytopathol, 2010, 48: 269–291.
[53] Hanley-Bowdoin L, Settlage SB, Orozco BM, et al. Geminiviruses: models for plant DNA replication, transcription, and cell cycle regulation. Crit Rev Biochem Mol Biol, 2000,35(2): 105–140.
[54] Yang Y, Sherwood TA, Patte CP, et al. Use of Tomato yellow leaf curl virus (TYLCV) Rep gene sequences to engineer TYLCV resistance in tomato. Phytopathology, 2004, 94(5): 490–496.
[55] Hashmi JA, Zafar Y, Arshad M, et al. Engineering cotton (Gossypium hirsutum L.) for resistance to cotton leaf curl disease using viral truncated AC1 DNA sequences. Virus Genes, 2011, 42(2):286–296.
[56] Lin CY, Tsai WS, Ku HS, et al. Evaluation of DNA fragments covering the entire genome of a monopartite begomovirus for induction of viral resistance in transgenic plants via gene silencing.Transgenic Res, 2012, 21(2): 231–241.
[57] Maiti IB, Murphy JF, Shaw JG, et al. Plants that express a potyvirus proteinase are resistant to virus infection. Proc Natl Acad Sci USA, 993,90(13): 6110–6114.
[58] Mäki-Valkama T, Valkonen JPT, Lehtinen A, et al.Protection against Potato virus Y (PVY) in the field in potatoes transformed with the PVY P1 gene. Am J Potato Res, 2001, 78(3): 209–214.
[59] Pehu TM, Mäki-Valkama TK, Valkonen JPT, et al.Potato plants transformed with a potato virus Y P1 gene sequence are resistance to PVY-O. Am J Potato Res, 1995, 72(9): 523–532.
[60] Simon AE, Roossinck MJ, Havelda Z. Plant virus satellite and defective interfering RNAs: new paradigms for a new century. Ann Rev Phytopathol, 2004, 42: 415–437.
[61] Tien P, Zhang X. Control of two plant viruses by protetion inoculation in China. Seed Sci Technol,1983, 11: 969–972.
[62] Baulcombe DC, Saunders GR, Bevan MW, et al.Expression of biologically active viral satellite RNA from the nuclear genome of transformed plants. Nature, 1986, 321(6068): 446–449.
[63] Kim SJ, Kim BD, Paek KH. In vitro translation inhibition and in vivo viral symptom development attenuation by cucumber mosaic-virus RNA3 cDNA fragments. Mol Cells, 1995, 5(1): 65–71.
[64] Kim SJ, Lee SJ, Kimet BD, et al.Satellite-RNA-mediated resistance to Cucumber mosaic virus in transgenic plants of hot pepper(Capsicum annuum cv. Golden Tower). Plant Cell Rep, 1997, 16(12): 825–830.
[65] Yie Y, Zhao F, Zhao SZ, et al. High resistance to cucumber mosaic virus conferred by satellite RNA and coat protein in transgenic commercial tobacco cultivar G-140. Mol Plant Microb Interact, 1992,5(6): 460–465.
[66] Cillo F, Finetti-Sialer MM, Papanice MA, et al.Analysis of mechanisms involved in the Cucumber mosaic virus satellite RNA-mediated transgenic resistance in tomato plants. Mol Plant Microbe Interact, 2004, 17(1): 98–108.
[67] Taliansky ME, Ryabov EV, Robinson DJ. Two distinct mechanisms of transgenic resistance mediated by groundnut rosette virus satellite RNA sequences. Mol Plant Microbe Interact, 1998,11(5): 367–374.
[68] Lin KY, Hsu YH, Chen HC, et al. Transgenic resistance to Bamboo mosaic virus by expression of interfering satellite RNA. Mol Plant Pathol,2013, 14(7): 693–707.
[69] Cech TR, Zaug AJ, Grabowski PJ. In vitro splicing of the ribosomal RNA precursor of Tetrahymena:involvement of a guanosine nucleotide in the excision of the intervening sequence. Cell, 1981,27(3 Pt 2): 487–496.
[70] Kruger K, Grabowski PJ, Zaug AJ, et al.Self-splicing RNA: autoexcision and autocyclization of the ribosomal RNA intervening sequence of Tetrahymena. Cell, 1982, 31(1):147–157.
[71] Kwon CS, Chung WI, Paek KH. Ribozyme mediated targeting of Cucumber mosaic virus RNA 1 and 2 in transgenic tobacco plants. Mol Cells, 1997, 7(3): 326–334.
[72] Yang XC, Ye Y, Zhu F, et al. Ribozyme 2 mediated high resistance against Potato spindle tuber viroid in transgenic potatoes. Proc Natl Acad Sci USA,1997, 94(10): 4861–4865.
[73] Huttner E, Tucker W, Vermeulen A, et al.Ribo-zyme genes protecting transgenic melon plants against potyviruses. Curr Issues Mol Biol,2001, 3(2): 27–34.
[74] Napoli C, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into Petunia results in reversible co-suppression of homologous genes in trans. Plant Cell, 1990, 2(4):279–289.
[75] Stam M, Mol JNM, Kooter JM. The silence of genes in transgenic plants. Ann Bot, 1997, 79(1):3–12.
[76] Dougherty WG, Lindbo JA, Smith HA, et al.RNA-mediated virus resistance in transgenic plants: exploitation of a cellular pathway possibly involved in RNA degradation. Mol Plant Microb Interact, 1994, 7(5): 544–552.
[77] Lines RE, Persley D, Dale JL, et al. Genetically engineered immunity to Papaya ringspot virus in Australian papaya cultivars. Mol Breed, 2002,10(3): 119–129.
[78] Souza MT, Nickel O, Gonsalves D. Development of virus resistant transgenic papayas expressing the coat protein gene from a Brazilian isolate of Papaya ringspot virus. Fitopatologia Brasileira,2005, 30(4): 357–365.
[79] Bird CR, Ray JA, Fletcher JD, et al. Using antisense RNA to study gene function: inhibition of carotenoid biosynthesis in transgenic tomatoes.Nat Biotechnol, 1991, 9(7): 635–639.
[80] Day AG, Bejarano ER, Buck KW, et al. Expression of an antisense viral gene in transgenic tobacco confers resistance to the DNA virus Tomato golden mosaic virus. Proc Natl Acad Sci USA,1991, 88(15): 6721–6725.
[81] Haq QMI, Ali A, Malathi VG. Engineering resistance against Mungbean yellow mosaic India virus using antisense RNA. Indian J Virol, 2010,21(1): 82–85.
[82] Zhang P, Vanderschuren H, Fütterer J, et al.Resistance to cassava mosaic disease in transgenic cassava expressing antisense RNAs targeting virus replication genes. Plant Biotechnol J, 2005, 3(4):385–97.
[83] Xiang Y, Yang LY, Peng XX, et al. High virus-resistance of transgenic tobacoo plants mediated by expression of modified NIb gene of potato virus Y. Chin J Biotech, 1996, 12(3):258–265 (in Chinese)
项瑜, 杨兰英, 彭学贤, 等. 改造的马铃薯Y病毒复制酶基因介导高度抗病性. 生物工程学报,1996, 12(3): 258–265.
[84] Waterhouse PM, Graham MW, Wang MB. Virus resistance and gene silencing in plants can be induced by simultaneous expression of sense and antisense RNA. Proc Natl Acad Sci USA, 1998,95(23): 13959–13964.
[85] Tougou M, Furutani N, Yamagishi N, et al.Development of resistant transgenic soybeans with inverted repeat-coat protein genes of Soybean dwarf virus. Plant Cell Rep, 2006, 25(11):1213–1218.
[86] Hu Q, Niu YB, Zhang K, et al. Virus-derived transgenes expressing hairpin RNA give immunity to Tobacco mosaic virus and Cucumber mosaic virus. Virol J, 2011, 8(1): 41.
[87] Brodersen P, Voinnet O. The diversity of RNA silencing pathways in plants. Trends Genet, 2006,22(5): 268–280.
[88] Smith NA, Singh SP, Wang MB, et al. Total silencing by intron-spliced hairpin RNAs. Nature,2000, 407(6802): 319–320.
[89] Waterhouse PM, Helliwell CA. Exploring plant genomes by RNA-induced gene silencing. Nat Rev Genet, 2003, 4(1): 29–38.
[90] Zhang XC, Sato S, Ye XH, et al. Robust RNAi-based resistance to mixed infection of three viruses in soybean plants expressing separate short hairpins from a single transgene.Phytopathology, 2011, 101(11): 1264–1269.
[91] Lee RC, Feinbaum RL, Ambros V, et al. The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14.Cell, 1993, 75(5): 843–854.
[92] Bartel DP. MicroRNAs: genomics, biogenesis,mechanism, and function. Cell, 2004, 116(2):281–297.
[93] Ambros V. The functions of animal microRNAs.Nature, 2006, 431(7006): 350–355.
[94] Niu QW, Lin SS, Reyes JL, et al. Expression of artificial microRNAs in transgenic Arabidopsis thaliana confers virus resistance. Nat Biotechnol,2006, 24(11): 1420–1428.
[95] Ai T, Zhang L, Gao Z, et al. Highly efficient virus resistance mediated by artificial microRNAs that target the suppressor of PVX and PVY in plants.Plant Biol, 2011, 13(2): 304–316.
[96] Zhang XH, Li HX, Zhang JH, et al. Expression of artificial microRNAs in tomato confers efficient and stable virus resistance in a cell-autonomous manner. Transgenic Res, 2011, 20(3): 569–581.
[97] Qu J, Ye J, Fang RX. Artif i cial microRNA-mediated virus resistance in plants. J Virol, 2007, 81(12): 6690–6699.
[98] Duan CG, Wang CH, Fang RX, et al. Artif i cial microRNAs highly accessible to targets confer eff i cient virus resistance in plants. J Virol, 2008,82(22): 11084–11095.
[99] Simón-Mateo C, Garcia JA. MicroRNA-guided processing impairs Plum pox virus replication, but the virus readily evolves to escape this silencing mechanism. J Virol, 2006, 80(5): 2429–2436.
[100] Lin SS, Wu HW, Elena SF, et al. Molecular evolution of a viral non-coding sequence under the selective pressure of amiRNA-mediated silencing. PLoS Pathog, 2009, 5(2): e1000312.
[101] Whitham S, McCormick S, Baker B. The N gene of tobacco confers resistance to Tobacco mosaic virus in transgenic tomato. Proc Natl Acad Sci USA, 1996, 93(16): 8776–8781.
[102] Baurès I, Candresse T, Leveau A, et al. The Rx gene confers resistance to a range of Potexviruses in transgenic Nicotiana plants. Mol Plant Microbe Interact, 2008, 21(9): 1154–1164.
[103] Zhang HL, Zhao JP, Liu SS, et al. Tm-22confers different resistance responses against Tobacco mosaic virus dependent on its expression level,Molec Plant, 2013, 6(3): 971–974.
[104] Kang BC, Yeam I, Jahn MM. Genetics of plant virus resistance. Ann Rev Phytopathol, 2005, 43:581–621.
[105] Maule AJ, Caranta C, Boulton MI. Sources of natural resistance to plant viruses: status and prospects. Mol Plant Pathol, 2007, 8(2): 223–231.
[106] Palukaitis P, Carr JP. Plant resistance responses to viruses. J Plant Pathol, 2008, 90: 153–171.
[107] Cavatorta J, Perez KW, Gray SM, et al.Engineering virus resistance using a modified potato gene. Plant Biotechnol J, 2011, 9(9):1014–1021.
[108] Wang XH, Kohalmi SE, Svircev A, et al. Silencing of the host factor eIF(iso)4E gene confers Plum pox virus resistance in plum. PLoS ONE, 2013,8(1): e50627.
[109] Cao YF, Wu YF, Zheng Z, et al. Overexpression of the rice EREBP-like gene OsBIERF3 enhances disease resistance and salt tolerance in transgenic tobacco. Physiol Mol Plant Pathol, 2005, 67(3/5):202–211.
[110] Fischer U, Dröge-Laser W. Overexpression of NtERF5, a new member of the tobacco ethylene response transcription factor family enhances resistance to Tobacco mosaic virus. Mol Plant Microbe Interact, 2004, 17(10): 1162–1171.
[111] Shin R, Han JH, Lee GJ, et al. The potential use of a viral coat protein gene as a transgene screening marker and multiple virus resistance in pepper plants coexpressing coat proteins of Cucumber mosaic virus and Tomato mosaic virus. Transgenic Res, 2002, 11(2): 215–219.
[112] Zhang G, Chen M, Li L, et al. Overexpression of the soybean GmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco. J Exp Bot, 2009, 60(13): 3781–3796.
[113] Guevara-Olvera L, Ruíz-Nito ML, Rangel-Cano RM, et al. Expression of a germin-like protein gene (CchGLP) from a geminivirus-resistant pepper (Capsicum chinense Jacq.) enhances tolerance to geminivirus infection in transgenic tobacco. Physiol Mol Plant P, 2012, 78: 45–50.
[114] Yamaji Y, Maejima K, Komatsu K, et al.Lectin-mediated resistance impairs plant virus infection at the cellular level. Plant Cell, 2012,24(2): 778–793.
[115] Butterbach P, Verlaan M G, Dullemans A, et al.Tomato yellow leaf curl virus resistance by Ty-1 involves increased cytosine methylation of viral genomes and is compromised by cucumber mosaic virus infection. Proc Natl Acad Sci USA, 2014,111(35): 12942–12947.
[116] Verlaan MG, Hutton SF, Ibrahem RM, et al. The Tomato yellow leaf curl virus resistance genes Ty-1 and Ty-3 are allelic and code for DFDGD-class RNA–dependent RNA polymerases. PLoS Genetics, 2013, 9(3):e1003399.
[117] Wang Q, Liu YQ, He J, et al. STV11 encodes a sulphotransferase and confers durable resistance to Rice stripe virus. Nat Commun, 2014, 5: 4768.
[118] Lodge JK, Kaniewski WK, Tumer NE.Broad-spectrum virus resistance in transgenic plants expressing pokeweed antiviral protein. Proc Natl Acad Sci USA, 1993, 90(15): 7089–7093.
[119] Hudak KA, Bauman JD, Tumer NE. Pokeweed antiviral protein binds to the cap structure of eukaryotic mRNA and depurinates the mRNA down-stream of the cap. RNA, 2002, 8(9):1148–1159.
[120] Tumer NE, Hwang DJ, Bonness M. C-terminal deletion mutant of pokeweed antiviral protein inhibits viral infection but does not depurinate host ribosomes. Proc Natl Acad Sci USA, 1997,94(8): 3866–3871.
[121] Lam YH, Wong YS, Wang B, et al. Use of trichosanthin to reduce infection by Turnip mosaic virus. Plant Sci, 1996, 114(1): 111–117.
[122] Hiatt A, Cafferkey R, Bowdish K. Production of antibodies in transgenic plants. Nature, 1989,342(6245): 76–78.
[123] Tavladoraki P, Benvenuto E, Trinca S, et al.Transgenic plants expressing a functional single-chain Fv antibody are specifically protected from virus attack. Nature, 1993, 366(6454):469–472.
[124] Conrad U, Fiedler U. Compartment-specif i c accumulation of recombinant immunoglobulin in plant cells: an essential tool for antibody production and immunomodulation of physiological functions and pathogen activity.Plant Mol Biol, 1998, 38(1/2): 101–109.
[125] Boonrod K, Galetzka D, Nagy PD, et al.Single-chain antibodies against a plant viral RNA-dependent RNA polymerase confer virus resistance. Nat Biotechnol, 2004, 22(7): 856–862.
[126] Gargouri-Bouzid R, Jaoua L, Rouis S, et al.PVY-resistant transgenic potato plants expressing an anti-NIa protein scFv antibody. Mol Biotechnol, 2006, 33(2): 133–140 nol.
[127] Nickel H, Kawchuk L, Twyman RM, et al.Plantibody-mediated inhibition of the Potato leaf roll virus P1 protein reduces virus accumulation.Virus Res, 2008, 36(1/2): 140–145.
[128] Ucci JW, Kobayashi Y, Choi G, et al. Mechanism of interaction of the double-stranded RNA(dsRNA) binding domain of protein kinase R with short dsRNA sequences. Biochemistry, 2007,46(1): 55–65.
[129] Shimazu M, Kawai G, Okutsu T, et al.Conformational properties of 2', 5' linked Rp- and Sp-phosphorothioate oligoadenylates studied by circular dichroism and NMR. Biopolymers, 2003,72(1): 48–58.
[130] MitraA, Higgins DW, Langenberg WG, et al.Silverman A mammalian 2–5A system functions as an antiviral pathway in transgenic plants. Proc Natl Acad Sci USA, 1996, 93(13): 6780–6785.
[131] Ogawa T, Hori T, Ishida I. Virus-induced cell death in plants expressing the mammalian 2′,5′oligoadenylate system. Nat Biotechnol, 1996,14(11): 1566–1569.
[132] Honda A, Takahashi H, Toguri T, et al. Activation of defense-related gene expression and systemic acquired resistance in Cucumber mosaic virus-infected tobacco plants expressing the mammalian 2′,5′ oligoadenylate system. Arch Virol, 2003, 148(5): 1017–1026.
[133] Cao X, Lu Y, Di D, et al. Enhanced virus resistance in transgenic maize expressing a dsRNA-specific endoribonuclease gene from E.coli. PLoS ONE, 2013, 8(4): e60829.
[134] Xiang Y, Liu JJ, Yang LY, et al. A new strategy derived from plant hypersensitivity against the infection of potato virus Y. Chin J Biotech, 1996,12(4): 422–428 (in Chinese).
项瑜, 刘俊君, 杨兰英, 等. 一种基于过敏性反应机制的抗植物病毒侵染策略. 生物工程学报,1996, 12(4): 422–428.
[135] Wang ZH, Song JH, Zhang Y, et al. Mechanism analysis of broad-spectrum disease resistance induced by expression of anti-apoptotic p35 gene in tobacco. Chin J Biotech, 2008, 24(10):1707–1713 (in Chinese).
王志华, 宋建华, 张勇, 等. 杆状病毒 p35基因诱导烟草产生广谱抗病机理分析. 生物工程学报, 2008, 24(10): 1707–1713.
[136] Cillo F, Palukaitis P. Transgenic resistance. Adv Virus Res, 2014, 90: 135–146.

